老鼠簕生物碱A对大鼠非酒精性脂肪肝的改善作用及其机制研究
徐万鹏 梁英琴 韦秀桂 王红园 张华 周焕芳 林兴 林军


摘 要 目的:研究老鼠簕生物碱A(HBOA)对大鼠非酒精性脂肪肝的改善作用及其机制。方法:将SD大鼠随机分为空白对照组、模型组、水飞蓟宾胶囊组(阳性对照,26.25 mg/kg)和HBOA高、中、低剂量组(100、50、25 mg/kg),每组10只。除空白对照组喂养普通饲料外,其余各组大鼠连续喂养高脂饲料8周以复制非酒精性脂肪肝模型。于第9周起,空白对照组和模型组大鼠灌胃等体积0.6%羟甲基纤维素钠溶液,各给药组大鼠灌胃相应药物,每日1次,连续4周。观察各组大鼠一般情况并计算其体质量增量、脏器(肝、肾、脾)指数;检测肝组织中天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、总胆固醇(TC)、三酰甘油(TG)、游离脂肪酸(NEFA)含量,以及血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)含量;采用免疫组织化学法检测肝组织中过氧化物酶体增殖物激活受体α(PPARα)蛋白的表達情况。结果:与空白对照组比较,模型组大鼠体质量增量和肝指数均显著升高(P<0.01);肝内可见脂肪沉积现象,血清中SOD、GSH-Px活性均显著降低,MDA含量以及肝组织中AST、ALT、TC、TG、NEFA含量均显著升高,PPARα蛋白表达水平显著降低(P<0.01)。与模型组比较,各给药组大鼠体质量增加量和肝指数均显著降低(P<0.05或P<0.01),肝内脂肪沉积现象改善,血清中SOD、GSH-Px活性(除HBOA低剂量组外)均显著升高,MDA含量以及肝组织中AST、ALT、TC(除HBOA低剂量组外)、TG(除HBOA低剂量组外)、NEFA含量均显著降低,PPARα蛋白表达水平(除HBOA低剂量组外)均显著升高(P<0.05或P<0.01),且高剂量组上述部分指标显著优于中、低剂量组(P<0.05)。结论:老鼠簕生物碱A对高脂饮食致大鼠非酒精性脂肪肝有一定的改善作用,其机制可能与改善脂质代谢紊乱、抗氧化应激及上调PPARα表达有关。
关键词 老鼠簕生物碱A;大鼠;非酒精性脂肪肝;氧化应激;脂代谢紊乱
ABSTRACT OBJECTIVE: To study improvement effect and mechanism of ilicifoliosids alkaloid A (HBOA) on non-alcoholic fatty liver disease in rats. METHODS: SD rats were randomly divided into blank control group, model group, Silybin capsule group (positive control, 26.25 mg/kg), HBOA high-dose, medium-dose and low-dose groups (100, 50, 25 mg/kg), with 10 rats in each group. Except that blank control group fed normal feed, the other groups were continuously fed with high-fat diet for 8 weeks to induce non-alcoholic fatty liver disease model. Form the 9th week, blank control group and model group were given constant volume of 0.6% CMC-Na solution, and administration groups were given corresponding drugs by intragastric admini- stration, once a day, for consecutive 4 weeks. The general information of rats were observed and the body weight increase, organ (liver, kidney and spleen) indexes were calculated; the contents of AST, ALT, TC, TG and NEFA in liver tissue were detected, and SOD, GSH-Px activities and MDA content in the serum were also determined. The protein expression of PPARα in liver tissue was detected by immunohistochemistry. RESULTS: Compared with blank control group, the body mass increase and liver index of rats in model group were increased significantly (P<0.01); fat deposition could be observed in the liver; the activities of SOD and GSH-Px in serum were reduced significantly, and the contents of MDA, the contents of AST, ALT, TC, TG and NEFA in liver tissue were significantly increased, and the protein expression of PPARα was decreased significantly (P<0.01). Compared with model group, the body mass increase and liver index of the rats were decreased significantly in administration groups (P<0.05 or P<0.01), liver fat deposition was improved, the activity of SOD and GSH-Px in serum (except for HBOA low-dose group) were increased significantly while MDA content, the contents of AST, ALT, TC (except for HBOA low-dose group), TG (except for HBOA low-dose group) and NEFA in liver tissue were decreased significantly, while protein expression of PPARα was increased significantly (P<0.05 or P<0.01). Some of the above indexes of HBOA high-dose group were significantly better than HBOA medium- and low-dose group (P<0.05). CONCLUSIONS: HBOA has a certain improvement effect on non-alcoholic fatty liver disease in rats caused by high-fat diet, and its mechanism may be related to improving lipid metabolism disorders, anti-oxidative stress and up-regulating the expression of PPARα.
KEYWORDS Ilicifoliosids alkaloid A; Rat; Non-alcoholic fatty liver disease; Oxidative stress; Lipid metabolism disorder
随着人们膳食水平的提升,非酒精性脂肪肝(Nonalcoholic fatty liver disease,NAFLD)的发病率呈逐年上升趋势,对人们身体健康造成严重的危害[1-3]。NAFLD最初由Ludwig J等学者提出,是指除过量饮酒以外的其他因素所致肝细胞弥散性脂肪变性与脂质累积的一类疾病,其可由单纯脂肪肝变性演变而成,进一步进展为肝纤维化、肝硬化及肝癌[4-5]。NAFLD致病机制十分复杂,至今尚不明确,但越来越多的研究指出,经典的“二次打击”学说在一定程度上可解释NAFLD的发生发展,包括“一次打击”学说中的肥胖、脂质代谢紊乱、2型糖尿病等引起的胰岛素抵抗[6],以及“二次打击”学说中的氧化应激和脂质过氧化反应,均可造成大量的氧自由基生成,反向加重肝细胞损伤[7]。因此,积极探索延缓NAFLD病情进展的干预方法对后续阐明其发病机制具有重要的临床指导意义。
红树林植物老鼠簕(Acanthus ilicifolius L.)是一种分布于热带海岸地区的爵床科老鼠簕属植物,又名软骨牡丹、老鼠怕,其味微咸、性凉,具有消肿散结、凉血清热、解毒之功效,且民间将其用于治疗肝炎、肝脾肿大、淋巴结肿大等症的历史悠久[8-11]。本课题组前期已从老鼠簕属植物中分离出一个活性单体化合物——老鼠簕生物碱A[4-hydroxy-2(3H)-benzoxazolone,HBOA],并已成功合成。药理实验表明,HBOA具有较好的保肝和抗氧化作用[12-13],然而其对NAFLD是否也具有改善作用目前尚未可知。因此,本文研究了HBOA对大鼠NAFLD的改善作用,并初步探讨了其作用机制,旨在为进一步明确HBOA的药理作用及其临床合理应用提供有力的数据支撑。
1 材料
1.1 仪器
SpectraMaxPlus384型扫描式酶标仪(香港分子仪器有限公司);EG11501-1型快速组织包埋机、RM2255型全自动轮转切片机(德国Leica公司);BX53型正置光学显微镜(日本Olympus公司);TV-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司);KZ-Ⅱ型高速组织研磨仪(武汉赛维尔生物科技有限公司);Micro17R小型高速冷冻离心机(赛默飞世尔科技有限公司)。
1.2 药物与试剂
HBOA(由广西医科大学药学院药物化学教研室合成,批号:20170321,纯度:>99%);水飞蓟宾胶囊(天津天士力圣特制藥有限公司,批号:950701001,规格:35 mg);羧甲基纤维素钠(CMC-Na,西陇科学股份有限公司,批号:1903052);生理盐水(四川科伦药业股份有限公司,批号:L119101501);水合氯醛(成都市科隆化学品有限公司,批号:2017091901);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、总胆固醇(TC)、三酰甘油(TG)、游离脂肪酸(NEFA)酶联免疫吸附(ELISA)检测试剂盒(南京建成生物工程研究所,批号分别为20190516、20190712、20190624、20190627、20190627、20190718、20190829、20190718);兔过氧化物酶体增殖物激活受体α(PPARα)多克隆抗体(北京博奥森生物技术有限公司,批号:AI10115187);大鼠/兔通用型免疫组化检测试剂盒(美国Proteintech Group公司,批号:30202003);山羊血清封闭液(北京中杉金桥生物技术有限公司,批号:19110701);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司,批号:010719190603);苏木精-伊红(HE)染色液(北京雷根生物技术有限公司,批号:0904A18);二甲苯、乙醇均由广西中医药研究院中药药理所免疫组化实验室提供;其余试剂均为分析纯,实验用水为蒸馏水。
1.3 动物
60只健康雄性SD大鼠,SPF级,4周龄左右,体质量(120±20) g,来自于广西医科大学实验动物中心,动物使用许可证号:SYXK(桂)2014-0003。高脂饲料(配方:81.5%基础饲料、3%胆固醇、0.5%三号胆盐、5%蛋黄粉、10%猪油)购自北京博爱港商贸有限公司。所有大鼠均饲养于室温(23±2) ℃、湿度(50±10)%、每12 h明暗交替的环境下,并自由摄食和饮水。
2 方法
2.1 分组、造模与给药
60只大鼠适应性喂养1周后,按随机数字表法分为空白对照组、模型组、水飞蓟宾胶囊组(阳性对照,26.25 mg/kg,剂量设置源于文献方法[14])和HBOA高、中、低剂量组(100、50、25 mg/kg,剂量设置按照本课题组前期实验结果[15]),每组10只。除空白对照组大鼠给予普通饲料外,其余各组大鼠连续喂养高脂饲料8周以复制NAFLD模型。待第8周结束后,随机选取1只空白对照组大鼠和3只造模大鼠,取其肝组织做病理学检查,HE染色结果显示,与空白对照组比较,模型组大鼠肝细胞出现严重的脂肪变性,脂肪空泡明显且呈气球样变,汇管区存在明显的炎性和嗜酸性坏死细胞。上述病理特征变化表明NAFLD模型复制成功。从第9周起,每组随机保留8只大鼠,给药组灌胃相应药物(以0.6%CMC-Na溶液作为溶剂,临用新配),空白对照组和模型组灌胃等体积0.6%CMC-Na溶液,每日1次,连续4周。
2.2 标本采集、形态观察与脏器指数检测
给药期间,每日观察各组大鼠的一般情况,包括精神状态、饮食、活动状况等。末次给药当晚禁食10 h、不禁水,于次日清晨,称取大鼠体质量,与实验前体质量比较,计算体质量增量;腹腔注射10%水合氯醛(3 mL/kg)麻醉,于腹主动脉取血后,迅速剖离肝、肾、脾,经冰冷生理盐水漂洗除去血迹,吸掉表面液体后,观察形态,称取湿质量,计算相应脏器指数,脏器指数=脏器湿质量(g)/ 体质量(g)×100%。全血经静置后,以3 500 r/min离心15 min,取上清液;每只大鼠均于左叶相同部位切取约1 cm×1 cm×1 cm的组织,固定在4%多聚甲醛溶液中。上述样本均于-80 ℃环境下分装保存。
2.3 肝组织中AST、ALT、TC、TG、NEFA含量检测
采用ELISA检测,按试剂盒说明书方法操作:取各组大鼠肝组织适量,用生理盐水作为匀浆介质,按照1 ∶ 9(g/mL)的比例制备肝组织匀浆液,于4 ℃条件下以3 000 r/min离心10 min,取上清液,使用酶标仪检测AST、ALT、TC、TG、NEFA含量。
2.4 血清中SOD、GSH-Px活性及MDA含量检测
采用ELISA法检测,按试剂盒说明书方法操作:取各组大鼠血清适量,使用酶标仪检测SOD、GSH-Px活性及MDA含量。
2.5 肝组织中PPARα蛋白表达检测
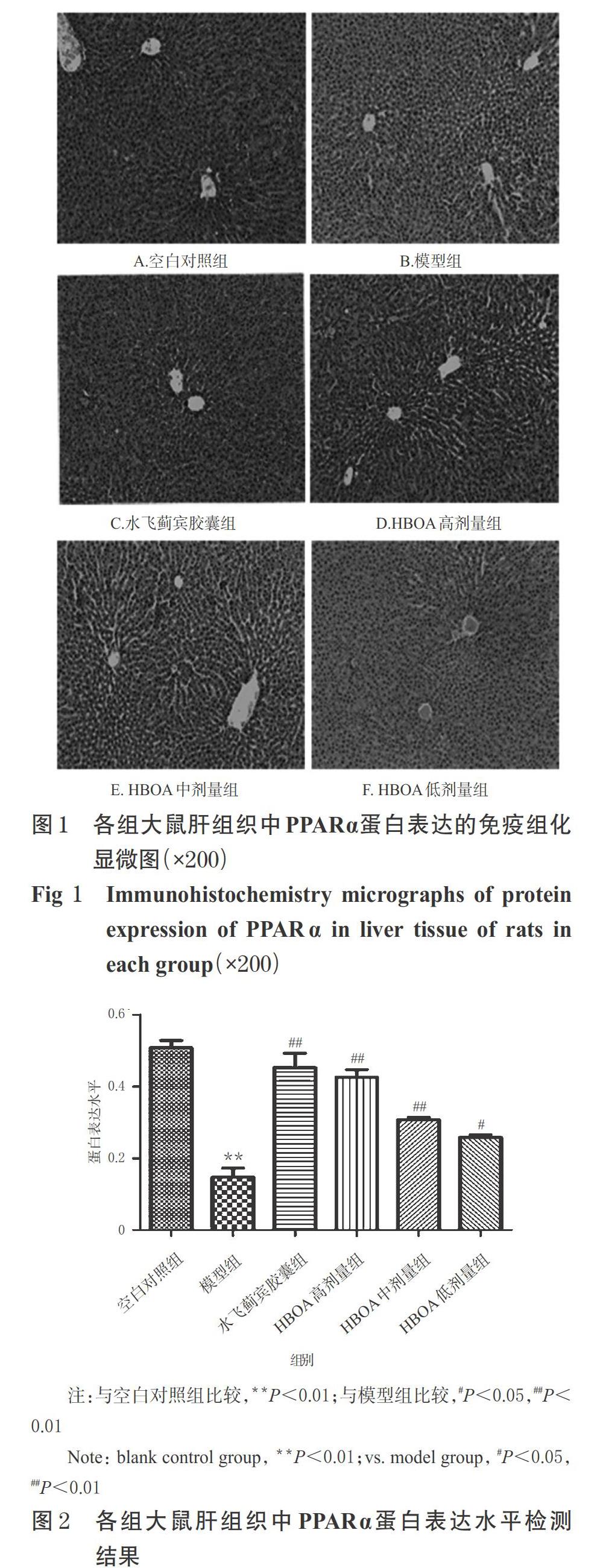
利用免疫组织化学法检测,按照抗体及免疫组化试剂盒说明书方法操作:取肝组织适量,经石蜡包埋后,切成厚度为5 μm的切片,先将切片置于二甲苯中进行脱蜡,再依次用100%、95%、80%、60%乙醇进行水化;然后进行抗原修复、内源性过氧化物酶灭活、10%山羊血清封闭,滴加PPARα一抗(稀释比例1 ∶ 400),4 ℃孵育过夜;次日用磷酸盐缓冲液(PBS,pH 7.4~7.6)清洗3次,每次1 min,滴加对应生物素标记的抗兔/鼠辣根过氧化物酶标记聚合物,37 ℃孵育30 min后,PBS清洗3次,每次1 min;滴加DAB工作液显色,用水清洗后,经苏木精复染2 min,乙醇脱水,置于二甲苯中透明2次,每次10 min,干燥后,用中性树脂封片,置于光学显微镜下拍照(棕黄色区域表示阳性),每张照片随机拍摄5个视野(×200),利用Image Pro plus 6.0软件进行分析,以组化图中的累积光密度值占总区域的比值表示PPARα蛋白的表达水平。
2.6 统计学方法
采用SPSS 23.0软件对数据进行统计分析。计量资料用x±s表示,多组间比较采用单因素方差分析,两两比较采用LSD检验(方差齐)或Dunnetts T3检验(方差不齐)。P<0.05为差异有统计学意义。
3 结果
3.1 HBOA对NAFLD模型大鼠一般情况的影响
空白对照组大鼠毛色光泽,食欲旺盛,精神状态良好。模型组大鼠毛色乏黄且暗淡,精神萎靡,懶动,不活泼。与模型组比较,水飞蓟宾胶囊组和HBOA各剂量组大鼠精神状态均有改善。
3.2 HBOA对NAFLD模型大鼠体质量的影响
与空白对照组比较,模型组大鼠体质量增量显著升高(P<0.01)。与模型组比较,各给药组大鼠体质量增量均显著降低,且HBOA高剂量组显著低于HBOA低剂量组(P<0.05或P<0.01)。各组大鼠体质量测定结果见表1。
3.3 HBOA对NAFLD模型大鼠脏器的影响
空白对照组大鼠肝脏为红褐色,表面光滑,边缘锐利,形态正常;模型组大鼠肝脏为灰黄色,表面触之伴有油腻感,边缘较钝且肿大,有花斑块形成,部分可见少量白色脂肪沉积;各给药组大鼠肝脏色泽逐渐恢复正常,上述肝脂变程度得到明显改善。与空白对照组比较,模型组大鼠肝指数显著增加(P<0.01)。与模型组比较,各给药组大鼠肝指数均显著降低(P<0.05或P<0.01),HBOA各剂量组肝指数组间比较差异均无统计学意义(P>0.05)。此外,各组大鼠肾、脾脏色泽、形态均无明显变化,肾指数和脾指数组间比较差异均无统计学意义(P>0.05)。各组大鼠脏器指数测定结果见表2。
3.4 HBOA对NAFLD模型大鼠肝组织中AST、ALT含量的影响
与空白对照组比较,模型组大鼠肝组织中AST、ALT含量均显著升高(P<0.01)。与模型组比较,各给药组大鼠肝组织中AST、ALT含量均显著降低,且HBOA高剂量组显著低于HBOA中、低剂量组(P<0.05或P<0.01)。各组大鼠肝组织中AST、ALT含量检测结果见表3。
3.5 HBOA对NAFLD模型大鼠肝组织中TC、TG、NEFA含量的影响
与空白对照组比较,模型组大鼠肝组织中TC、TG、NEFA含量均显著升高(P<0.01)。与模型组比较,水飞蓟宾胶囊组和HBOA高、中剂量组大鼠肝组织中TC、TG含量以及各给药组大鼠肝组织中NEFA含量均显著降低,且HBOA高剂量组均显著低于HBOA中、低剂量组(P<0.05或P<0.01)。各组大鼠肝组织中TC、TG、NEFA含量检测结果见表4。
3.6 HBOA对NAFLD模型大鼠氧化应激指标的影响
与空白对照组比较,模型组大鼠血清中SOD、GSH-Px活性显著降低,MDA含量显著升高(P<0.01)。与模型组比较,水飞蓟宾胶囊组和HBOA高、中剂量组大鼠血清中SOD、GSH-Px活性均显著升高,MDA含量均显著降低(P<0.05或P<0.01),但上述指标组间比较差异均无统计学意义(P>0.05)。各组大鼠血清中SOD、GSH-Px活性和MDA含量检测结果见表5。
3.7 HBOA对NAFLD模型大鼠肝组织中PPARα蛋白表达的影响
与空白对照组比较,模型组大鼠肝组织中PPARα蛋白的表达水平显著降低(P<0.01)。与模型组比较,各给药组大鼠肝组织中PPARα蛋白的表达水平均显著升高(P<0.05或P<0.01),但组间比较差异均无统计学意义(P>0.05)。各组大鼠肝组织中PPARα蛋白表达的免疫荧光显微图见图1,蛋白表达水平检测结果见图2。
4 討论
NAFLD是一种以肝细胞脂质过度蓄积为特征的慢性肝脏疾病[16]。近年来,学者们为深入研究NAFLD的致病机制,成功建立了多种造模方法,主要包括营养失调型、转基因改良型及药物和毒物损伤型[17]。其中,营养失调型中的高脂饮食法较贴近于人类NAFLD的发生过程,且造模成功率高、死亡率低、重复性强且操作简单,故本研究采用此方法复制NAFLD动物模型。已有研究表明,HBOA有较好的护肝和抗炎效果,对四氯化碳(CCl4)诱导肝纤维化模型大鼠的改善作用呈剂量依赖性[9-10],但在NAFLD方面的干预效果尚不明确。另有研究显示,水飞蓟宾胶囊对NAFLD模型大鼠有明显的改善作用[18]。基于上述理论与研究基础,本研究在建立NAFLD大鼠模型的基础上,以水飞蓟宾胶囊为阳性对照,初步探讨了HBOA对大鼠NAFLD的改善作用及其机制。
常用于反映肝损害程度的酶学指标有AST、ALT。当肝细胞受到损伤后,会引起细胞内AST、ALT流入血液中,使外周血中转氨酶含量显著上升,且不同类型肝病所致转氨酶含量上升的程度也有明显差异[19]。SOD和GSH-Px是细胞内天然的抗氧化物酶,能清除生物的体内氧自由基,提升机体抗氧能力并阻断生物体内脂质过氧化反应进程[20]。有研究表明,持续的氧化应激反应会降低体内SOD、GSH-Px活性,从而导致脂质过氧化代谢产物MDA含量升高,引起肝细胞变性、凋亡,其含量高低可间接反映肝脏的受损程度[21]。本研究结果表明,与空白对照组比较,模型组大鼠血清中SOD、GSH-Px活性均显著降低,MDA含量和肝组织中AST、ALT活性均显著升高,表明大鼠的肝功能受到了破坏;经HBOA治疗后,大鼠血清中SOD、GSH-Px活性均显著升高,MDA含量以及肝组织中AST、ALT活性均显著降低,这表明HBOA对高脂饮食所致的大鼠肝损害有一定的改善作用。
机体发生脂质代谢的主要部位在肝脏。PPARs是由配体激活的核转录因子,属于核甾体激素受体超家族中的一员[22]。根据其亚型的特异性及在不同生理部位中表达水平的不同,可分成PPARα、PPARβ、PPARγ。其中,PPARα高表达于肝脏、心脏及骨骼肌等脂代谢能力较强部位,而在其余脂代谢能力较弱部位则呈低表达[23]。近来研究发现,胰岛素抵抗是引起脂质代谢紊乱的首要原因之一[24-26]。在该状态下,肝中TG、TC、NEFA等合成与降解平衡失调,且随着时间的推移,大量脂肪堆积于肝脏内,导致肝细胞损伤,最终引发NAFLD。然而,由于NAFLD患者体内脂质异常堆积,引起肝肿大,肝细胞脂肪变性、脂质代谢紊乱,降低机体对胰岛素的灵敏性,进一步加重胰岛素抵抗[27-28]。而PPARα是能调节胰岛素敏感性的一个重要转录因子,并且活化的PPARα能够降低患者胰岛素抵抗的发生概率,故可延缓NAFLD患者的病情进展[29]。本研究结果显示,与空白对照组比较,模型组大鼠体质量增量、肝指数及肝组织中TC、TG、NEFA含量均显著升高,表明高脂饮食能使大鼠发生脂代谢紊乱。经HBOA治疗后,大鼠体质量增量、肝指数及肝组织中TC、TG、NEFA含量均显著下降,表明HBOA可以有效改善大鼠的脂代谢紊乱状态。此外,免疫组化结果显示,空白对照组大鼠肝组织中PPARα蛋白的表达水平很高,模型组大鼠肝组织中PPARα蛋白的表达水平显著降低;经HBOA治疗后,大鼠肝组织中PPARα蛋白的表达水平显著升高,表明HBOA可通过上调PPARα蛋白的表达来发挥对NAFLD的治疗作用。
综上所述,HBOA对高脂饮食所致大鼠NAFLD有一定的改善作用,其机制可能是通过改善脂质代谢紊乱、调节氧化应激、上调PPARα蛋白表达等有关,本文为HBOA防治NAFLD的后续研究开拓了新的思路。但NAFLD致病机制极其复杂,更加具体的治疗靶点及机制还有待进一步探讨。
参考文献
[ 1 ] 张磊,吕文.非酒精性脂肪肝诊疗新进展[J].当代医学,2019,25(16):191-194.
[ 2 ] 王海英,梁翠梅,崔静文,等.针刺通过抑制肝脏氧化应激改善腹型肥胖型非酒精性脂肪肝病大鼠的肝脏脂质代谢[J].针刺研究,2019,44(3):189-194、215.
[ 3 ] TAKAHASHI Y,FUKUSATO T. Histopathology of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. World J Gastroenterol,2014,20(42):15539-15548.
[ 4 ] TUYAMA AC,CHANG CY. Non-alcoholic fatty liver disease[J]. J Diabetes,2012,4(3):266-280.
[ 5 ] JANG MK,NAM JS,KIM JH,et al. Schisandra chinensis extract ameliorates nonalcoholic fatty liver via inhibition of endoplasmic reticulum stress[J]. J Ethnopharmacol,2016. DOI:10.1016/j.jep.2016.03.021.
[ 6 ] BROWNING MG,KHORAKI J,DEANTONIO JH,et al. Protective effect of black relative to white race against non-alcoholic fatty liver disease in patients with severe obesity,independent of type 2 diabetes[J]. Int J Obes:Lond,2018,42(4):926-929.
[ 7 ] ZHAO W,LIU L,WANG Y,et al. Effects of a combination of puerarin,baicalin and berberine on the expression of proliferator-activated receptor-γ and insulin receptor in a rat model of nonalcoholic fatty liver disease[J]. Exp Ther Med,2016,11(1):183-190.
[ 8 ] 韦秀桂,王红园,黄秀昆,等.老鼠簕生物碱A对小鼠药物性肝损伤的保护作用[J].中国实验方剂学杂志,2019,25(15):103-107.
[ 9 ] 黄秀昆,孙雪梅,朱勋帅,等. 4-羟基苯并噁唑-2-酮对四氯化碳诱导大鼠肝纤维化的改善作用及机制研究[J].中国药房,2019,30(6):747-751.
[10] 孙雪梅,黄秀昆,朱勋帅,等.基于MAPK信号通路研究4-羟基苯并噁唑-2-酮抗肝纤维化的作用机制[J].中国医院药学杂志,2019,39(1):25-28.
[11] 黄燕军,梅燕,祁平,等.4-羟基苯并噁唑-2-酮对四氯化碳诱导小鼠急性肝损伤的保护作用[J].医学理论与实践,2013,26(15):1961-1975.
[12] 韦明中,莫思燕,邱金慧,等.老鼠簕生物碱A对肝纤维化大鼠Ⅰ、Ⅲ型胶原表达的影响[J].广西医科大学学报,2015,32(6):891-894.
[13] 卢顺玉,祁平,梁颖娥,等.老鼠簕生物碱A及其衍生物对四氯化碳致大鼠肝纤维化的保护作用[J].时珍国医国药,2013,24(2):310-311.
[14] WANG D,LAO L,PANG X,et al. Asiatic acid from Potentilla chinensis alleviates non-alcoholic fatty liver by regulating endoplasmic reticulum stress and lipid metabolism[J]. Int Immunopharmacol,2018. DOI:10.1016/j.intimp.2018.10.013.
[15] SUN X,HUANG X,ZHU X,et al. HBOA ameliorates CCl4-incuded liver fibrosis through inhibiting TGF-β1/Smads,NF-κB and ERK signaling pathways[J]. Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2019.108901.
[16] 宋正伟,夏平,黎黎,等.淫羊藿苷介导AMPK/PGC-1α/GLUT4通路对高脂诱导的大鼠非酒精性脂肪肝损伤和脂代谢的调节作用[J].临床和实验医学杂志,2019,18(16):1702-1707.
[17] 陈剑明,王丙信,伏爱国,等.高脂饮食诱导非酒精性脂肪肝大鼠模型的实验研究[J].中华中医药学刊,2016,34(11):2709-2712.
[18] 高华武,陈明,龙子江,等.水飞蓟宾对高脂诱导非酒精性脂肪肝大鼠的调脂保肝作用[J].药物评价研究,2017,40(6):773-777.
[19] 娄新睿,廖康,朱明君,等.黄芪水煎剂对SD大鼠非酒精性脂肪肝的干预作用[J].中国医学创新,2019,16(25):12-16.
[20] 刘波,翟玉荣,丁汀汀,等.苦瓜皂苷改善非酒精性脂肪肝大鼠中氧化应激的作用研究[J].中药药理与临床,2017,33(4):49-52.
[21] 谭丹枫,陶月英,姜媛,等.胆石六号颗粒对模型小鼠非酒精性脂肪肝的改善作用研究[J].中国药房,2018,29(22):3106-3110.
[22] CHOUDHARY NS,KUMAR N,DUSEJA A. Peroxisome proliferator-activated receptors and their agonists in nonalcoholic fatty liver disease[J]. J Clin Exp Hepatol,2019,9(6):731-739.
[23] 隋晓丹.肝脂溶颗粒对非酒精性脂肪肝模型大鼠肝脏组织PPARα表达的影响[J].中国中医药现代远程教育,2018,16(9):99-100.
[24] YANG H,YANG T,HENG C,et al. Quercetin improves nonalcoholic fatty liver by ameliorating inflammation,oxidative stress,and lipid metabolism in db/db mice[J]. Phytother Res,2019,33(12):3140-3152.
[25] WU Z,ZHANG Y,GONG X,et al. The preventive effect of phenolic-rich extracts from Chinese sumac fruits against nonalcoholic fatty liver disease in rats induced by a high-fat diet[J]. Food Funct,2020,11(1):799-812.
[26] 宣寧昕,俞文芹.利拉鲁肽联合维生素E改善抗非酒精性脂肪肝小鼠肝损伤和胰岛素抵抗的作用及机制研究[J].世界华人消化杂志,2018,26(29):1688-1695.
[27] 瞿玉兰,韩泽广.脂代谢紊乱在非酒精性脂肪肝发病中的作用[J].中国科学:生命科学,2017,47(5):496-507.
[28] 秦艳,张晾,潘杰.高脂饮食对非酒精性脂肪肝影响机制研究进展[J].实用肝脏病杂志,2010,13(1):72-74.
[29] 付蓉,荣向路,郭姣.复方贞术调脂方对非酒精性脂肪肝的肝PPARα及其下游基因的影响[J].中国中西医结合杂志,2017,37(6):735-740.
(收稿日期:2020-05-09 修回日期:2020-06-07)
(编辑:邹丽娟)

