PTEN和Cyclin D1在口腔鳞癌中的表达及其预后价值
冯 钦 洪晨善 魏晓龙 曾芸珠 许少伟 彭汉伟
口腔癌在我国发病率并不高,但预后较差。口腔癌以鳞状细胞癌(oral squamous cell carcinoma,OSCC)最常见,约占90%[1]。目前OSCC的治疗以手术±放/化疗为主,总的5年生存率约50%~70%[2]。PTEN作为第一个被发现具有双磷酸酶活性的抑癌基因在细胞周期G1期的负性调节中起着重要的作用[3];而Cyclin D1则是细胞周期G1/S期中重要的正性调控因子,在肿瘤的发生发展中扮演重要角色[4],两者共同参与细胞的有丝分裂并影响细胞功能。有研究发现PTEN和Cyclin D1在肿瘤组织中表达水平的高低与OSCC患者的临床病理特征之间有密切的关系[5-6],而PTEN和Cyclin D1在OSCC组织中的表达与预后关系的报道较少。本研究通过免疫组化的方法检测手术存档的原发灶石蜡标本中PTEN和Cyclin D1蛋白表达,探索上述基因的表达及其与的预后关系,为评估OSCC的预后提供依据。
1 材料与方法
1.1 研究对象纳入标准
2014年12月至2016年12月汕头大学医学院附属肿瘤医院头颈科共收治OSCC 216例,选择其中符合下列标准者78例作为研究对象:①病理确诊口腔鳞癌;②在我院接受根治性手术±放疗治疗者;③术前未进行放化疗或生物治疗;④术前评估无远处转移者;⑤病例资料完整。
1.2 临床资料收集
78例口腔鳞癌患者中,男性48例,女性30例;中位年龄60岁(34~83岁);原发部位包括口颊8例,舌44例,口底11例,牙龈13例,硬腭2例。吸烟标准:吸烟指数≥200,饮酒标准:平均每次饮白酒量300克以上,每周1次以上,连续10年以上。按照国际抗癌联盟/美国癌症联合会(UICC/AJCC)分期标准系统第7版进行分期,其中T117例、T231例、T321例,T49例;N059例,N17例、N211例、N31例;Ⅰ期13例,Ⅱ期26例,Ⅲ期21例,Ⅳ期18例;高分化64例,中分化12例,低分化2例。单纯手术治疗67例,术后辅助放/化疗11例。
1.3 免疫组化
实验试剂:PTEN及Cyclin D1单克隆抗体和广谱超敏SP试剂盒购自福建迈新公司。方法:按照操作说明书和免疫组化常规方法完成。PBS液代替一抗做阴性对照。用已知PTEN及Cyclin D1蛋白阳性切片作为阳性对照。
1.4 结果判读
免疫组化计数由2位副高以上病理科医师独立进行。Cyclin D1以胞核出现棕黄色颗粒为阳性,反之阴性,PTEN以胞核和胞质出现棕黄色颗粒为阳性,反之阴性。着色强度分为4级:0为未着色,1为浅棕色,2为棕色,3为深棕色。着色密度分为5级:0为未着色,1为着色细胞率<20%,2为着色细胞率21%~40%,3为着色细胞率41%~60%,4为着色细胞率>60%。着色强度与密度级数和:0为(-),不表达;1~3为(+),低表达;4~5为(++),中表达;6~7为(+++),高表达。
1.5 随访
全组78例,获随访76例,失访2例,随访率97%;随访截止日期为2019年3月31日。总生存(OS)时间定义为疾病确诊至任何原因引起的死亡间隔时间。无病生存(DFS)时间定义为从疾病确诊至肿瘤复发或肿瘤所致的死亡的间隔时间,非肿瘤原因所致死亡记录为删失数据。
1.6 统计学分析
应用SPSS 23软件进行分析。PTEN和Cyclin D1间表达与临床病理特征之间的相关性采用Spearman检验,采用Kaplain-Meier法做复发及生存曲线,并用Log-rank检验进行组间比较,采用Cox比例风险模型进行预后多因素分析。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 PTEN和Cyclin D1在口腔鳞癌组织中的表达情况
PTEN和Cyclin D1在OSCC中表达率为100%,其中PTEN高表达22例(28.2%),中表达47例(60.3%),低表达9例(11.5%);Cyclin D1高表达39例(50%),中表达29例(37.2%),低表达10例(12.8%)。
2.2 PTEN表达与Cyclin D1表达的相关性及其临床病理特征的相关性
Spearman相关性分析结果显示:PTEN表达与cyclin D1表达无统计学相关(γ=0.114,P=0.320)(表1);PTEN表达与Cyclin D1表达均与OSCC患者的年龄、组织分化、吸烟、饮酒、复发、淋巴结转移、肿瘤是否浸润包膜、血管及神经、T分期、术后病理分期无统计学相关,P均>0.05。
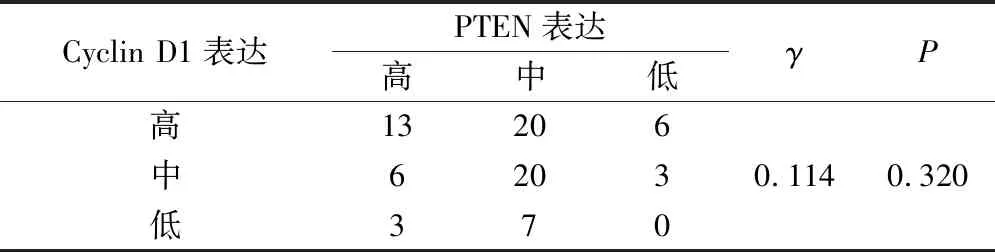
表1 口腔鳞癌患者PTEN和Cyclin D1表达相关性分析/例
2.3 PTEN表达和Cyclin D1表达与患者预后的关系
全组失访2例,随访率97.4%,中位随访时间33个月(5~51个月)。全组的78例中复发29例,其中原发灶复发15例,颈部复发8例,远处转移4例,原发灶及颈部同时复发2例;死亡26例,其中23例死于肿瘤复发或远处转移,1例死于放疗后第二原发颈段食管癌,2例死因不明;存活52例,1例带瘤生存,1例放疗后第二原发癌治疗中。
全组3y-OS为65.4%,3y-DFS为53.8%。PTEN高、中、低表达组患者的3y-OS分别为75.0%、61.4%、55.6%(P=0.095),3y-DFS分别为51.1%、52.9%、55.6%(P=0.367),差异均不具有统计学意义(图1)。Cyclin D1高、中、低表达组患者的3y-OS分别为65.3%、69.0%、60.0%(P=0.918),3y-DFS分别为55.1%、54.5%、50.0%(P=0.993),差异均不具有统计学意义(图2)。
2.4 影响患者预后的单因素和多因素分析
单因素分析结果显示,吸烟(OS:P=0.020,DFS:P=0.040)、饮酒(OS:P=0.018,DFS:P=0.087)、淋巴结转移(OS:P=0.050;DFS:P=0.018)和术后病理分期(OS:P=0.007;DFS:P=0.057)是影响患者OS和DFS的相关因素(表2)。
将影响生存的可能因素包括年龄、吸烟、饮酒、术后病理分期、组织分化、PTEN表达和Cyclin D1表达等,采用Enter法引入Cox比例风险模型中进行多因素分析,结果显示PTEN低表达(P=0.046)和Cyclin D1高表达(P=0.011)是影响患者无病生存的不良预后因素,PTEN低表达(P=0.049)也是影响患者总生存的不良预后因素(表3)。

图1 PTEN表达对口腔鳞癌术后患者无病生存(A)和总生存(B)的影响

图2 Cyclin D1表达对口腔鳞癌术后患者无病生存(A)和总生存(B)的影响
3 讨论
389例口腔鳞癌的回顾性分析研究发现N分期、临床分期、分化程度和淋巴结外侵犯(ENE)与预后相关[7]。尽管上述因素在一定程度上对口腔鳞癌患者术后的预后有一定的预测作用,但是目前仍然缺乏能够预测生存和复发概率的精准手段。为了更加精准地进行个体化治疗,则需要寻找更理想的肿瘤标志物以协助治疗方案决策和疗效预测。
复习文献发现PTEN蛋白具有脂质磷酸酶及蛋白磷酸酶的双重活性,可以使第二信使PIP3(三磷酸磷脂酰肌醇)去磷酸化,进一步阻断对应的细胞信号传导通路,下调Cyclin D1的表达,而后者在细胞周期G1/S期中具有重要的正性调控作用,从而抑制细胞生长[5,8-9]。本研究着重探索肿瘤发生发展中两个重要的细胞周期调控基因PTEN及Cyclin D1在OSCC病理组织中的表达,以及两者之间的相关性和预后的价值。
有学者[5-6,10]发现PTEN和Cyclin D1在口腔癌组织中的表达存在异于正常组织,且与肿瘤病理分级及病理分期之间存在关联,并指出PTEN能够下调Cyclin D1的表达。张媛媛等[11]发现Cyclin D1过表达与组织低分化和促进淋巴结转移有关。相反,有研究[12]结果显示未发现头颈鳞癌组织中有Cyclin D1的过表达。王心蕊等[13]认为PTEN 基因突变在头颈部癌症的过程中可能不起主导作用。但是,关于上述两者在OSCC患者中的表达及其预后的关系相关研究报道较少。

表2 影响口腔鳞癌患者生存的单因素分析/%
本研究以未经诱导化疗、放疗或生物治疗,直接接受手术±放/化疗的OSCC78例为研究对象,通过免疫组化法检测原发灶组织中PTEN蛋白和Cyclin d1蛋白的表达情况。结果发现所有病例中PTEN及Cyclin D1均有不同水平的表达,PTEN表达水平和Cyclin D1表达水平之间,以及它们和临床病理参数之间无统计学相关,这与部分国外[10]和国内[5-6,14]的报道不一致。在本研究实验操作严格按照操作说明书和免疫组化常规方法完成蛋白的检测和双盲读片,并且设有阳性和阴性对照,石蜡标本保存时间不长,重复检测结果一致;但是样本量相对较少而且解剖亚区分布较广可能导致统计学偏倚。当然,上述其他学者的研究多为回顾性且入组病例数量也并不多。因而,我们认为PTEN表达和Cyclin D1表达的相关性尚有待加大样本量优化研究设计进一步探索。
在预后价值上,Pickhard等[12]回顾性分析180例头颈鳞癌病例,结果显示的PTEN 的表达与预后无关。另一项来自Lee等[15]学者的研究也发现PTEN在舌癌中的表达降低,但是未发现PTEN 低表达的患者其OS和DFS有明显下降。相反,Snietura等[16]认为PTEN也许能作为一种有价值的头颈部鳞状细胞癌术后放疗的预后指标。Baghaei等[17]一项49例口腔鳞癌病例的回顾性分析表明PTEN的低表达很可能在口腔鳞癌的发生发展中起重要影响。同样,关于Cyclin D1的表达对预后影响的研究结果也不一致,Pickhard A等的研究结果显示Cyclin D1过表达的患者预后较差,但无统计学意义(P=0.065)。其他研究[18]结果也发现没有证据支持Cyclin D1蛋白可作为预后因子。然而Gioacchini等[19]分析研究证明Cyclin D1的过表达与高T分期、N分期和临床分期等不良预后因素均有关,是口腔鳞癌患者预后的潜在重要指标。

表3 影响口腔鳞癌患者生存的多因素分析
我们的研究发现:单因素分析中PTEN的高表达OSCC患者的OS优于低表达组和中表达组,但是不具有统计学意义(P=0.095),PTEN 的表达水平不影响患者的DFS(P=0.367);Cyclin D1的表达水平与OSCC患者的预后无统计学相关(OS:P=0.918;DFS:P=0.993)。然而,当我们将年龄、吸烟、饮酒、术后病理分期、组织分化、PTEN表达和Cyclin D1表达等相关临床病理因素进行多因素Cox模型分析时发现PTEN低表达是影响OSCC患者OS和DFS的独立不良预后因素,Cyclin D1高表达则是影响患者DFS的独立不良预后因素。
鉴于PTEN和Cyclin D1在Kaplain-Meier生存分析中、两者之间和与OSCC患者的临床病理参数之间均缺乏统计学相关,我们推测主要是因为病例数不足及随访时间过短所致。本组病例Ⅰ期~Ⅱ期3年OS为81.4%,Ⅲ期~Ⅳ期3年OS为51.4%(P=0.007),N0组与N+组的3年OS分别为71.9%和47.4%(P=0.050),各组预后趋势显著,进一步说明上述分析是合理的。
综上所述,本队列研究结果提示,在行手术±放疗治疗的OSCC中,PTEN表达和Cyclin D1表达可能缺乏统计学相关性,PTEN低表达和Cyclin D1高表达是影响OSCC生存的独立不良预后因素,对OSCC患者的预后判断有一定的价值。确切的结论尚有待加大样本量优化研究设计进一步探索。

