胃癌组织中ZMYND8蛋白的表达及临床病理学意义
刘长兵,姚 丰,牛多山,张佐阳
(1.宣城职业技术学院,安徽宣城 242000;2.宣城人民医院病理科;3.安徽医科大学基础医学院,安徽合肥 230031)
DNA损伤会引起组蛋白翻译后修饰的异常,进一步导致DNA复制、转录、翻译及损伤修复机制的受损[1-3]。溴区结合蛋白ZMYND8(锌指-MYND8型蛋白)可以识别组氨酸上乙酰化的赖氨酸残基,调控一系列DNA损伤修复基因的表达[4-5]。研究表明,ZMYND8在肿瘤组织中可能起到抑癌基因的作用[6-7]。目前,国内外文献中关于ZMYND8在胃癌组织中的作用和意义的研究较少。本文拟通过使用免疫组化及RT-qPCR等方法,研究ZMYND8在胃癌组织及癌旁组织中的表达,分析其表达与临床病理特征及胃癌患者生存率之间的关系,探讨ZMYND8蛋白在预测胃癌患者预后中的作用。
1 材料与方法
1.1 临床资料
收集2018年5月~2019年12月安徽省宣城市人民医院收治的胃癌患者术后新鲜肿瘤及瘤旁(距肿瘤6cm)新鲜标本30例,标本收取后立即置入液氮罐中保存备用。另选取60例具有完整临床病理学资料及生存资料的胃癌患者肿瘤及相应癌旁蜡块(均经病理证实),其中男性患者25例,女性患者35例,年龄49~65岁,平均年龄(57.1±4.9)岁;肿块直径小于5cm的患者36例,大于或等于5cm的患者24例;中+高分化患者27例,低分化33例;共28例患者发生淋巴结转移,其中7例患者发生远程转移,组内其余32例患者无淋巴结转移;TNM分期Ⅰ+Ⅱ期24例,Ⅲ+Ⅳ期36例。所有患者术前均未进行放、化疗。
随访资料:将经电话咨询及邮件咨询获得生存资料后的胃癌患者入组,截止至2019年12月,共收集60例有效随访病例。
1.2 试剂和方法
1.2.1 试剂 总RNA提取试剂RNAiso plus及RT-qPCR sybrgreen I试剂盒均购自日本TAKARA公司;异丙醇、氯仿、100%乙醇等实验耗材均购自合肥科创生物公司;ZMYND8及GAPDH引物由上海生工合成;RT-qPCR使用美国ABI 7500型荧光定量qPCR仪;兔抗人免疫组化用ZMYND8多克隆抗体购自美国Santa cruz公司;SABC二抗试剂盒及显色试剂盒DAB均购自福州迈新公司。
1.2.2 RNA提取方法 从液氮罐中快速取出标本,碾碎后立刻加入1ml Trizol并充分混匀。每个样品加入200μl氯仿,用力震荡后,静置5min,12000 r/min 4℃离心10min;吸取上清至另一无酶EP管中,并加入等量异丙醇,轻轻混匀后静置15min;12000 r/min 4℃离心10min,肉眼可见沉淀即为RNA。1ml 75%乙醇清洗RNA,12000 r/min 4℃离心10min,弃上清,空气干燥RNA,加20μl DEPC水溶解后检测RNA浓度。
逆转录:逆转录体系按照Takara 逆转录试剂盒说明配置,将RNA逆转成cDNA。
RT-qPCR:按照Takara RT-qPCRsybrgreen I试剂盒说明书配置体系。引物如下:Z M Y N D8 正向:TA A G G A G C A G G AT G G A C G G A,反向:T C T C G T T T T T G G C A A G C A G C;G A P D H 正向:G G A G C G A G AT C C C T C C A A A AT,反向:GGCTGTTGTCATACTTCTCATGG。反应程序设置为:94℃2min;94℃ 30s,60℃ 30s,72℃ 30s,合计40个循环;72℃5min。每个样品设置3个复孔,反应结束后读取结果。
RT-qPCR结果判断读取每个样品模板及内参的Ct值(循环数),计算△Ct值后(Ct目的基因-Ct内参基因),进一步计算Foldchange值=2-ΔΔCt。
1.2.3 免疫组织化学 SABC法石蜡切片常规60℃ 2h烤干后,脱蜡至水;血清封闭液15min;甩干,加一抗30μl;4℃,过夜;冲洗后,加二抗孵育30min;甩干冲洗后,加SABC复合物30min;甩干冲洗后,DAB显色10min;终止显色;苏木素复染细胞核30s;脱水,透明,封片后,显微镜下观察结果。ZMYND8一抗浓度为1∶200;以PBS 作为阴性对照。
免疫组织化学结果判断:采用半定量积分法判断阳性结果[8]。(1)按染色强度评分:低倍镜下(×100)随机10个视野,无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;(2)按染色面积:低倍镜下对每张切片随机取10个视野,计算阳性区域面积占癌或癌旁组织总面积百分比;无阳性细胞为0分,<25%为1分,25%~50%为2分,>50%为3分。两项评分相乘,<2记为阴性,≥2记为阳性。
1.3 统计学方法
所有研究数据均应用SPSS 26.0及Graphpad prism 7.0软件进行分析和处理。采用配对t检验法分析RT-qPCR结果;采用χ2检验分析ZMYND8表达免疫组织化学染色结果与临床病理参数的关系;生存分析采用Kaplan-Meier生存分析法;以P<0.05表示差异具有统计学意义。
2 结果
2.1 胃癌组织及癌旁组织中ZMYND8 mRNA的表达
采用实时荧光定量PCR法检测30对新鲜胃癌组织及其癌旁组织中ZMYND8mRNA的表达水平,结果发现:30对组织中,有24对癌旁组织中ZMYND8的mRNA表达水平高于相应的癌组织(图1A,P<0.05);ZMYND8 mRNA在胃癌组织中的Foldchange显著低于相应癌旁组织(图1B,P<0.05)。这些结果均提示,ZMYND8mRNA在癌组织中的表达量低于对应的癌旁组织。
2.2 胃癌组织及癌旁组织中ZMYND8蛋白表达
采用免疫组织化学SABC法检测60对胃癌组织及癌旁组织石蜡标本中ZMYND8基因在蛋白水平的表达,结果发现:ZMYND8主要定位于细胞核内,成棕黄色颗粒状阳性表达(图2);在60例胃癌组织中,有13例ZMYND8表达阳性,47例表达阴性,阳性率为21.7%;而在60例癌旁组织中,ZMYND8表达阳性数为51例,阳性率为85.0%(表1);差异均具有显著统计学意义(P<0.05)。这些结果提示ZMYND8蛋白在胃癌组织中的表达显著低于其在相应癌旁组织中的表达。

表1 胃癌组织及癌旁组织石蜡标本中ZMYND8蛋白表达Tab.1 The expression of ZMYND8 protein in gastric cancer and adjacent paraff in tissues
2.3 胃癌组织中ZMYND8的表达与临床病理学参数的相关性
利用统计学工具结合以上免疫组织化学标记结果,笔者分析了胃癌组织石蜡标本中ZMYND8的表达与临床病理学参数的相关性。结果表明:胃癌组织中ZMYND8的表达与肿瘤的浸润深度、淋巴结转移及TNM分期呈负相关(P<0.05),提示在胃癌的发生、发展及演进过程中ZMYND8可能起抑癌基因的作用。见表2:
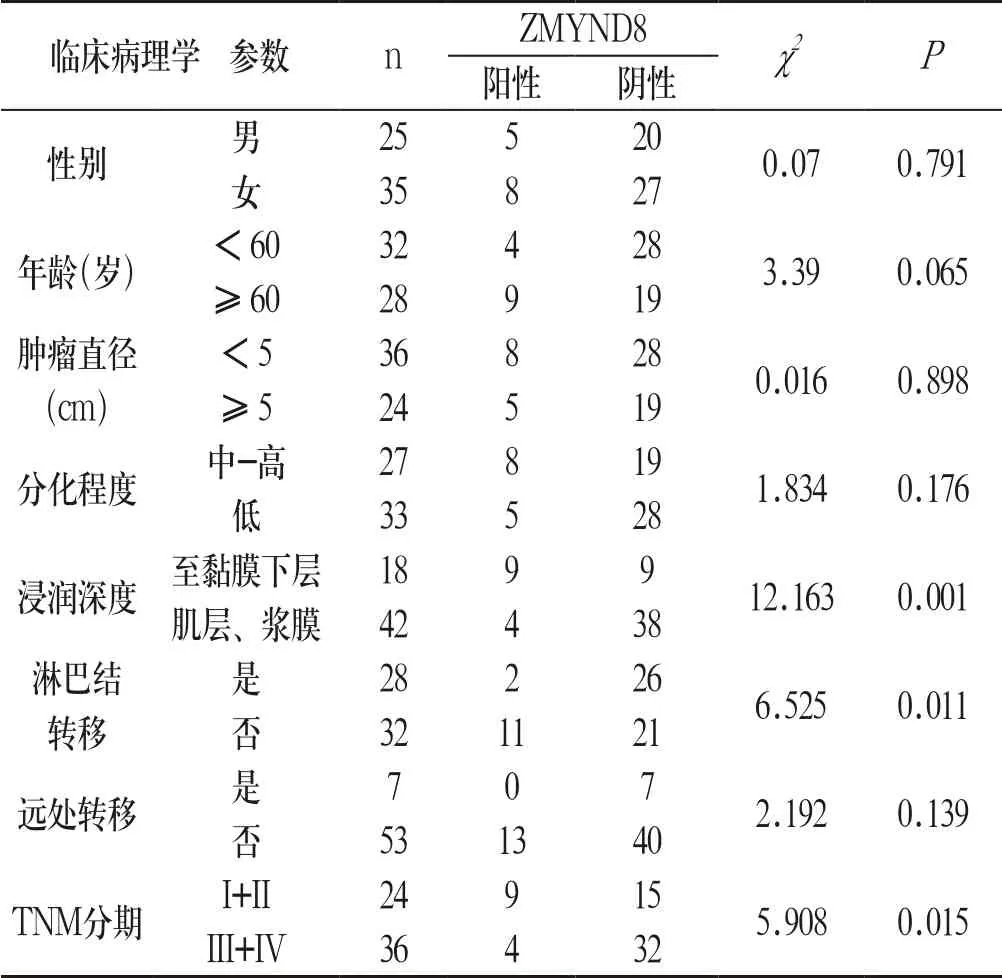
表2 胃癌组织中ZMYND8的表达与临床病理学参数的相关性Tab.2 The relationship between the expression of ZMYND8 and clinical pathological paraments in gastric cancer tissues
2.4 ZMYND8的表达与胃癌患者5年生存率的相关性
采用Kaplan-Meier生存曲线对60例胃癌患者肿瘤石蜡标本中ZMYND8的表达水平与患者预后关系进行分析。结果表明:ZMYND8表达阳性患者生存率为76.9%(10/13),显著高于ZMYND8表达阴性的患者的31.9%(15/47)。ZMYND8表达阳性患者5年生存率显著高于阴性表达者,两组间差异具有统计学意义;ZMYND8的表达与患者生存率呈正相关(P=0.0001)。见图3:
3 讨论
胃癌在我国消化系统恶性肿瘤疾病的发病率中排名首位[9]。目前,对于胃癌发生、发展的整体认识仍存在较多争议[10-11]。染色体结构的重塑导致DNA损伤是导致肿瘤发生及进展的重要机制之一,本文初步探讨了组蛋白上溴区结合蛋白ZMYND8在胃癌组织中的表达和意义。
ZMYND8是一种蛋白激酶C结合蛋白,依靠其N-末端及C-末端的特殊结构域与多种复合物结合并相互作用,发挥多种功能[12]。RCOR2可以与ZMYND8 C-末端MYND结构域结合,并调控神经系统分化[13];组氨酸去甲基化酶KDM5与ZMYND8相互作用后,调控基因损伤后修复反应[4]。
近期研究表明,ZMYND8在乳腺癌、前列腺癌及卵巢腺癌中发挥的作用各不相同。Chen等[6]的研究表明,在乳腺癌中乙酰化的ZMYND8可促进乳腺癌的形成和进展,通过干扰ZMYND8的表达可显著降低癌细胞的浸润、转移能力。Mukherjee等[14]的研究表明,同样在乳腺癌组织中,ZMYND8通过稳定上皮细胞标记物,抑制上皮-间质转化(EMT)的发生,从而发挥抑癌基因的作用。Chen等[15]的研究表明,鼻咽癌组织中ZMYND8的低表达与肿瘤的侵袭转移能力呈正相关,这提示在鼻咽癌组织中ZMYND8可能起了抑癌基因的作用。本文利用免疫组化及RT-qPCR方法检测胃癌及其癌旁组织中ZMYND8的表达,发现癌组织中ZMYND8表达显著低于对应的癌旁组织,并且ZMYND8蛋白在石蜡包埋癌组织中的表达与淋巴结转移、肿瘤浸润深度及TNM分期呈负相关;ZMYND8蛋白阳性表达的患者5年生存率显著高于阴性表达的患者。这些结果提示ZMYND8可以作为一个胃癌患者的预后指标。值得注意的是,ZMYND8的表达与胃癌患者的远处转移无明显相关性,笔者推测其原因可能为胃癌远处转移患者的例数较少。
肿瘤细胞中染色体结构重塑涉及到多个步骤,其中组氨酸的乙酰化修饰是关键步骤之一。本文初步阐明ZMYND8在胃癌组织中的表达及意义,但是其抑癌机制有待于进一步研究。

