芽孢杆菌NCB-01胞外蛋白酶酶学特性的初步研究
孙艺轩,郑国栋,林 剑
(烟台大学 生命科学学院,山东 烟台264003)
蛋白酶是非常重要的一种水解酶,在所有的工业酶制剂中,蛋白酶大约占据75%,是最大最重要的工业用酶类之一,蛋白酶制剂的销售总量占世界酶制剂销售量的60%以上[1-2]。其中碱性蛋白酶的销售份额又占整个蛋白酶市场的40%左右,是目前需求量最大的酶类[3]。
海洋因其极端的生存环境,使海洋微生物具有丰富的优于陆生生物的酶基因及物理特性,这些特点极大的促进了人类对于海洋生物新酶源的开发与利用[4]。目前,国内外对碱性蛋白酶产生菌株的筛选主要集中在陆地微生物,而海洋微生物产碱性蛋白酶的研究却相对较少[5]。近年来,国内外越来越多的学者都相继开始将目光投向海洋,以期利用海洋环境的特点,从深海微生物中开发出更多新功能蛋白酶类[6-8]。中国科学院海岸带研究所从渤海海域沉积物中分离得到一枝能够分泌胞外蛋白酶的菌株7-5,通过对该菌株的形态特征、生理生化、16S rDNA序列比对等系统研究表明该菌株是海洋独有的芽孢杆菌属[9],本研究将其命名为NCB-01。初步研究表明该菌株既能水解酪蛋白又对明胶蛋白具有一定的水解能力,其胞外蛋白酶属于海洋微生物碱性蛋白酶,摇瓶培养后发酵液中的酶活力可以达到53.09 U/mL,但其酶学性质是未知的。
本研究以菌株NCB-01的发酵液为原料,对其所分泌的胞外蛋白酶经过一系列的分离纯化后,对其酶学性质进行了初步研究,以进一步明确该酶的酶学特征,为该蛋白酶的进一步应用研究提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及海水菌株NCB-01:烟台大学生物工程实验室保存;海水:渤海海水经沉积后取用。
1.1.2 试剂
二乙氨乙基(diethylaminoethyl,DEAE)-琼脂糖凝胶(Sepharose)fast flow(FF)阴离子交换层析柱:北京索莱宝科技有限公司;Tris、酪素等所有常规试剂均为进口或国产分析纯。
1.1.3 培养基
种子培养基:酵母提取物0.25%、蛋白胨0.5%,海水配制。
发酵培养基:酵母粉0.25%、酪素1.5%、明胶2.5%,海水配制。
上述培养基均在121 ℃条件下灭菌20 min。
1.2 仪器与设备
UV-5000型紫外可见分光光度计:上海元析仪器有限公司;PHS—3C型酸度计:意大利哈纳公司;20PR-52D型高速冷冻离心机:日本HITACHI公司;BONA-GM-18型有机膜分离实验机:济南博纳生物技术有限公司;SBS-100型数控计滴自动部分收集器:上海沪西分析仪器厂有限公司
1.3 实验方法
1.3.1 菌株NCB-01种子液及发酵液的制备
种子液的制备:将菌株NCB-01接入种子培养基,在25 ℃、180 r/min下培养24 h,即得种子液。
发酵液的制备:将菌株NCB-01种子液按照接种量10%接入发酵培养基中,在pH 8.0、25 ℃、180 r/min下摇瓶培养72 h,即得发酵液。
1.3.2 酶的分离纯化
将发酵液在4 ℃、10 000 r/min条件下离心10 min后取上清液,首先利用截留分子质量30 kDa的聚醚砜(polyethersulfone,PES)超滤膜进行一级超滤得透过液,再利用截留分子质量20 kDa的PES膜进行二级超滤得截留液,酶液浓缩后进行DEAE-Sepharose fast flow阴离子交换层析,收集有酶活性的组分检测其纯度并用于酶学特性研究。
1.3.3 酶反应最适作用温度
将1 mL酶液与1 mL 2%酪蛋白底物分别在5 ℃、10 ℃、20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃水浴中反应10 min,测定酶活力。以最高酶活力为100%,其他条件下酶活力与之相比较,计算相对酶活力,下同。
1.3.4 酶的热稳定性
将1 mL酶液分别在10 ℃、20 ℃、30 ℃、40 ℃、50 ℃、60 ℃保温,每个温度条件下放6个样品,每隔20 min取出一个样品管,放入冰水冷却后测定酶活力,以未经过热保温的酶液作为空白对照(100%),计算相对酶活力。
1.3.5 酶的最适作用pH
将纯化后的蛋白酶在不同pH 5.0~12.0条件下进行酶促反应以测定其最适pH值。所用缓冲液为:Na2HPO4-CA缓冲液(pH 5.0),Na2HPO4-NaH2PO4缓冲液(pH 6.0、7.0),Tris-HCl缓冲液(pH 8.0),Gly-NaOH缓冲液(pH 9.0、10.0),Na2HPO4-NaOH缓冲液(pH 11.0、12.0)
1.3.6 酶的pH稳定性
将1 mL酶液加入等体积的不同pH缓冲液中,于60 ℃保温1 h后,按1.3中方法测定剩余蛋白酶的活力。
1.3.7 金属离子对酶活力的影响
向 酶 液 中 加 入 用 蒸 馏 水 配 制 的Fe3+、Fe2+、Cu2+、K+、Zn2+、Na+、Mn2+、Ca2+、Mg2+的盐溶液,使金属离子的终浓度为5 mmol/L,放置1 h后,按1.3中方法测蛋白酶活力。以不加金属离子的酶液为对照,即设为100%。
1.3.8 蛋白酶抑制剂对酶活力的影响
在酶的最适反应温度和最适pH条件下,分别加入乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)及苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)蛋白酶抑制剂,使试剂终浓度分别为1 mmol/L和5 mmol/L,以不加抑制剂的酶液为空白对照(100%)。
1.3.9 表面活性剂对酶活力的影响
向酶液中加入各种表面活性剂,并使各试剂终浓度为:吐温-20体积分数10%,吐温-80体积分数10%,TritonX-100体积分数10%,Span-80体积分数10%,十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)5 mmol/L。以不加表面活性剂的酶液为空白对照(100%)。
1.3.10 盐浓度对酶活力的影响
向酶液中加入一定量的NaCl,使反应体系中NaCl终质量浓度分别为10 mg/mL、20 mg/mL、30 mg/mL、40 mg/mL、50 mg/mL、60 mg/mL、100 mg/mL,分别测定各盐度下的酶活,以不加NaCl的酶液为对照,此时酶活设为100%。
1.3.11 碱性蛋白酶反应动力学常数的测定
分别配制质量浓度为1.6 mg/mL、2.0 mg/mL、2.5 mg/mL、3.0 mg/mL、5.0 mg/mL、10.0 mg/mL的酪蛋白溶液。向1 mL各酪蛋白溶液中加入1mL的酶液,在最适条件下反应10min,测定酪氨酸浓度,根据Lineweaver-Burk 双倒数法作图,可计算出以酪蛋白为底物时的碱性蛋白酶的米氏常数(Km)和最大反应速率(Vmax)。
1.3.12 测定方法
蛋白酶酶活力的测定:采用Folin-酚显色法测定蛋白酶的活力[10]。蛋白酶酶活定义:在40 ℃、pH 8.0条件下,每毫升液体酶水解酪蛋白每分钟释放1 μg酪氨酸所需要的酶量称为1个酶活力单位(U/mL)。
2 结果与分析
2.1 DEAE-阴离子交换层析
由图1可以看出,在整个洗脱过程中出现了三个较大的蛋白峰和两个蛋白酶活力峰。经检测,蛋白峰处都没有蛋白酶酶活力,而酶活峰2处虽然有酶活力,但酶活力较低且蛋白含量较高。在0 mol/L NaCl洗脱阶段,出现了蛋白酶活力峰1,此处不仅酶活力较高且蛋白含量较少,说明蛋白酶组分并没有被填料有效的吸附,但杂蛋白是被吸附了的,达到了分离的目的。
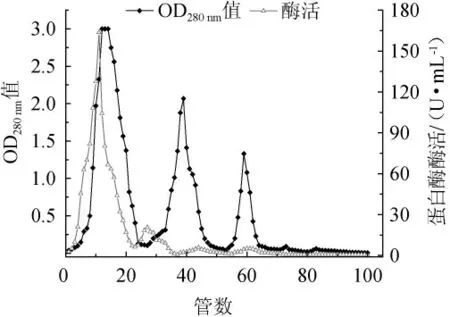
图1 DEAE-Sepharose FF离子交换柱层析图Fig. 1 Chromatography of DEAE Sepharose FF ion exchange column
2.2 碱性蛋白酶纯化结果
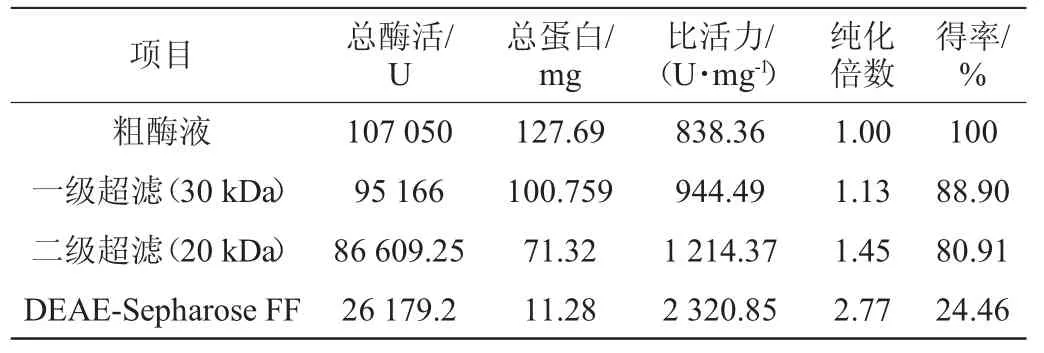
表1 菌株NCB-01产碱性蛋白酶的纯化步骤及结果Table 1 Purification procedures and results of alkaline protease from strain NCB-01
由表1可知,发酵上清液在经过一级超滤、二级超滤和DEAE-阴离子交换层析后,比活力由最初的838.36 U/mg提高至2 320.85 U/mg,纯度提高了2.77倍,酶得率为24.46%,实现了有效的分离纯化。
2.3 碱性蛋白酶的最适作用温度及热稳定性
2.3.1 碱性蛋白酶的最适作用温度
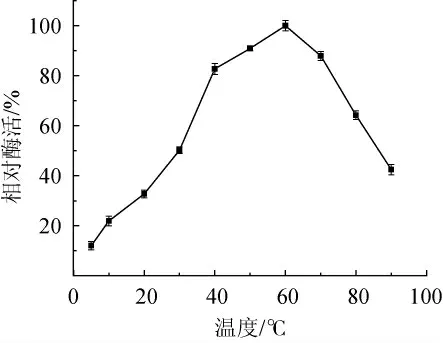
图2 温度对碱性蛋白酶活性的影响Fig. 2 Effect of temperature on alkaline protease activity
由图2可知,当温度低于60 ℃时,酶活力随着温度的升高而升高;在温度高于60 ℃后,酶活力则随温度的升高而下降。在60 ℃时酶活力最高,为该酶的最适作用温度。在40~70 ℃范围内,酶的活性都较强,相对酶活力都在80%以上。当温度低于40 ℃时,随着温度的降低,酶活力也下降显著,在20 ℃时已下降至30%左右,但在5 ℃条件下仍保持了12.0%的酶活力,这说明菌株NCB-01所产碱性蛋白酶对海洋低温环境有一定的适应性。
目前市场上常用的2709碱性蛋白酶其最适作用温度为50 ℃,在40 ℃条件下保温2 h后仍保持80%以上的酶活力[11-12]。这与本实验中菌株NCB-01所产碱性蛋白酶的性质相近,说明菌株NCB-01所产碱性蛋白酶也可进一步投入生产。
2.3.2 碱性蛋白酶的热稳定性
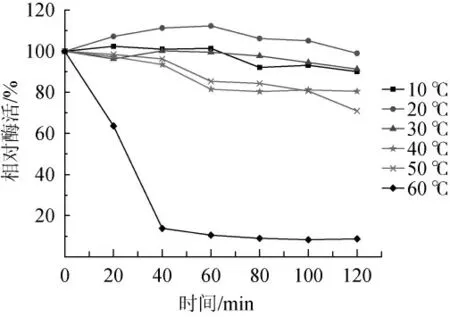
图3 碱性蛋白酶的热稳定性Fig. 3 Thermostability of alkaline protease
由图3可知,该碱性蛋白酶分别在10~40 ℃水浴条件下保温2 h,具有80%以上的酶活力,说明该酶在此温度范围内具有良好的热稳定性。尤其在10~30 ℃保温2 h,酶活力基本没有损耗,残余酶活达到95%及以上。在20 ℃时,随着在水浴中保温时间的增长,该碱性蛋白酶的酶活力没有下降反而有所上升,保温60 min后,酶活力提高了12.32%。可能是因为在该温度下,底物与酶的空间结构更加契合,促进了二者之间的反应,在一定程度上提高了该酶的酶活力。在50 ℃下该酶也具有较好的热稳定性,随着保温时间的增长,酶活力逐渐降低,2 h后残余酶活力为70.94%。而当温度达到60 ℃时,该酶的热稳定性很差,在20~30 min达到了半衰期,保温40 min后,残余酶活仅为13.84%。
由以上结果可知,虽然该碱性蛋白酶的最适反应温度为60 ℃左右,但其在低温下仍具有良好的热稳定性,这就使得该酶具备了低温蛋白酶的特性,说明菌株产蛋白酶的热稳定性与菌株生长的环境温度密切相关[13],这就为常温条件下或者低温条件下使用该酶创造了条件。
2.4 碱性蛋白酶的最适作用pH及稳定性
2.4.1 碱性蛋白酶的最适作用pH
由图4可知,当pH值<8.0时,酶活力随pH值的升高而升高;当pH>8.0时,酶活力随pH的升高而降低。当pH 8.0时,酶活力最高,因而该蛋白酶的最适作用pH值为8.0左右,属于碱性蛋白酶,这体现了其对海洋弱碱性生态环境的适应。且在pH 7.0~10.0范围内,酶活力较高,相对酶活力均在75%以上,说明该酶为具有较宽pH值范围的碱性蛋白酶,因而在洗涤、制革及丝绸等领域具有潜在的商业价值。在pH为12.0的强碱环境中,该酶仍保有一定酶活力,其残余酶活力为41.14%。而在pH值为5.0的弱酸性条件下,酶活力则较低,相对酶活仅为24.24%。
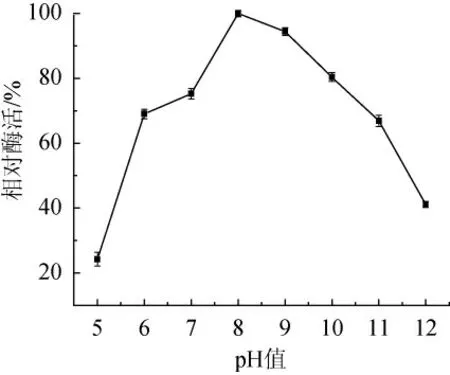
图4 pH值对碱性蛋白酶活性的影响Fig. 4 Effect of pH on alkaline protease activity
2.4.2 碱性蛋白酶的pH值稳定性
由图5可知,在pH值7.0~9.0范围内,该碱性蛋白酶具有良好的稳定性,其相对酶活性均在90%以上,酶活力损失很小。在pH值高于9.0后,酶稳定性随pH值的升高逐渐降低,但在极碱条件(pH 12.0)下,其残余酶活仍有62.88%。说明该碱性蛋白酶在碱性环境中较为稳定。而当pH值低于7.0时,酶的稳定性明显降低,在弱酸性条件(pH 5.0)中保温1 h后,其残余酶活仅为30.0%,说明该碱性蛋白酶在酸性条件下的稳定性较差。
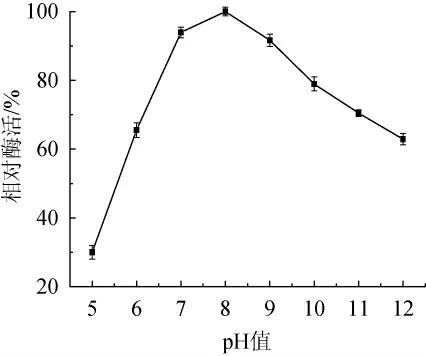
图5 pH值对碱性蛋白酶稳定性的影响Fig. 5 Effect of pH value on alkaline protease stability
2.5 金属离子对碱性蛋白酶活性的影响
由图6可知,不同的金属离子对该碱性蛋白酶的影响不同。在5 mmol/L的浓度下,Fe3+、Cu2+、Zn2+对酶活性均有抑制作用,且Zn2+的抑制作用最强,可以抑制70%的活性,Cu2+能抑制40%的活性,而Fe3+的抑制作用较弱,仅为12%。Fe2+、K+、Na+、Mn2+、Ca2+、Mg2+能够不同程度的促进酶活性,且Fe2+、K+、Mn2+、Ca2+的激活作用较明显,其中Ca2+的激活作用最强,可以使酶活性提高约40%,其他三种离子也能使酶活提高约13%~20%。由细菌产生的碱性蛋白酶在Ca2+、Mg2+或Mn2+存在时可以提高酶的活性和热稳定性,说明这些金属离子在高温下防止变性时具有一定作用,能够防止蛋白酶催化活性中心构象的改变[14]。Na+、Mg2+的促进作用不明显,对酶活性影响不大。
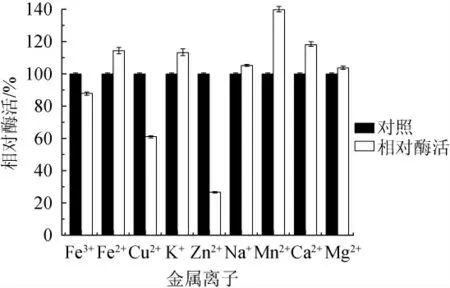
图6 不同金属离子对蛋白酶活性的影响Fig. 6 Effect of different metal ions on alkaline protease activity
2.6 蛋白酶抑制剂对酶活力的影响
两种抑制剂乙二胺四乙酸(EDTA)和苯甲基磺酰氟(PMSF)对酶活影响结果见表2。

表2 不同的蛋白酶抑制剂对碱性蛋白酶活力的影响Table 2 Effect of different protease inhibitors on alkaline protease activity
由表2可知,EDTA对酶活性的抑制作用较弱,当其浓度为5 mmol/L时,酶活力仍有88%,没有被完全抑制。说明金属离子对酶活力有一定的作用,但不是蛋白酶水解蛋白所必须的。该碱性蛋白酶中可能有共价的金属离子存在,这些金属离子被螯合剂剥夺从而导致酶活下降。这与2.5中结果只有部分金属离子激活酶活性一致。PMSF对该蛋白酶有强烈的抑制作用,当其浓度为5 mmol/L时,抑制率就达到了90%以上。PMSF对丝氨酸有专一性[15],说明该碱性蛋白酶的活性中心含有丝氨酸残基,因此该蛋白酶属于丝氨酸蛋白酶类。PMSF能有效抑制酶的活性,从而能够阻遏其断裂大分子蛋白质中的肽键,这也能证明蛋白酶大分子间的正确折叠与加工[16]。
2.7 表面活性剂对碱性蛋白酶活性的影响
由图7可知,非离子型表面活性剂Tween-20、Tween-80及TritonX-100对该碱性蛋白酶均有较强的抑制作用,且抑制作用强弱为TritonX-100>Tween-80>Tween-20。TritonX-100可能是对酶活性中心区域的疏水区产生了破坏作用,从而导致酶活力的下降[17]。Tween-20和Tween-80可能使蛋白质分子之间发生反应或吸附聚集而使酶活下降[18]。同样是非离子型表面活性剂,Span-80对酶几乎没有影响。阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)对酶活性的抑制作用较为明显,使酶活减小了近一半,可能是CTAB与酶聚合形成复合物从而使酶活下降。
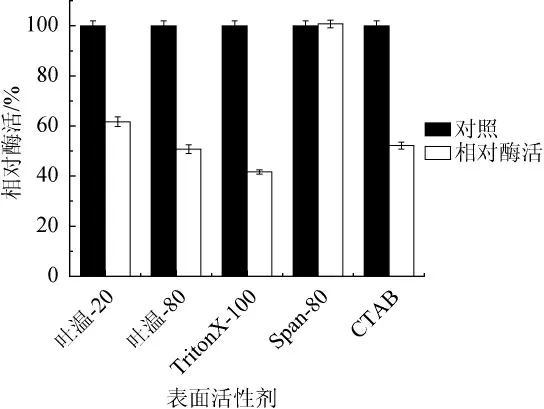
图7 表面活性剂对碱性蛋白酶活性的影响Fig. 7 Effect of surfactants on alkaline protease activity
2.8 盐浓度对蛋白酶活性的影响
因菌株NCB-01来源于渤海沉积物,因此该菌株所产蛋白酶的耐盐性值得研究。如图8所示,在NaCl质量浓度为0~100 mg/mL范围内,蛋白酶的活力随盐浓度的不断升高而逐渐降低,但仍保持了较高的酶活力。当盐浓度为100 mg/mL时,其残余酶活力仍有73.2%。说明该碱性蛋白酶具有良好的耐盐性,从而体现了菌株NCB-01对海洋环境的适应性。这与深海菌株Exiguobacteriumsp.SWJS2所产蛋白酶具有一定的耐盐性相一致[19]。
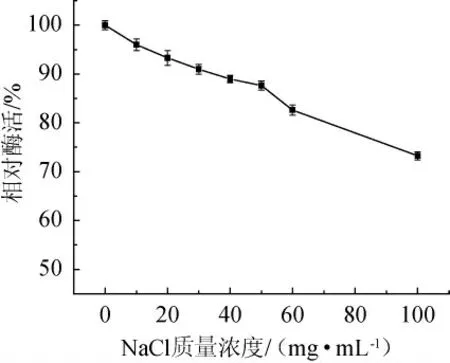
图8 NaCl质量浓度对碱性蛋白酶活性的影响Fig. 8 Effect of NaCl mass concentration on alkaline protease activity
2.9 碱性蛋白酶动力学常数的测定
米氏常数(Km)是常用的酶的反应动力学常数,它表示酶反应速率(V)为最大反应速率一半时的底物浓度,其大小只与酶的性质有关,而与酶的浓度无关,Km值越小,表示酶与底物的亲和力越大。如图9所示,采用Lineweaver-Burk法,以1/[S]为横坐标,以1/V为纵坐标作图,直线的斜率为Km/Vmax,截距为1/Vmax,由此可计算得出,当以酪蛋白为底物时,该碱性蛋白酶的米氏常数(Km)为1.11 mg/mL,最大反应速率(Vmax)为91.74 μg/(min·mL)。说明该碱性蛋白酶与酪蛋白的亲和力好,特异性强。
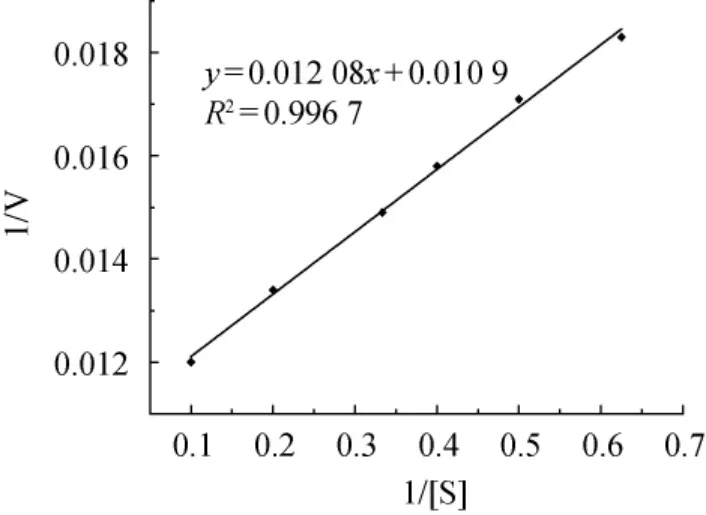
图9 碱性蛋白酶水解酪蛋白的Lineweaver-Burk图Fig. 9 Lineweaver-Burk plot of casein hydrolysis by alkaline protease
广泛应用于食品、洗涤及制革等行业的Alcalase2.4L碱性蛋白酶其米氏常数Km为2.437 mg/mL[20]。而菌株NCB-01所产碱性蛋白酶其Km为1.11 mg/mL,Km值相比Alcalase2.4L更小,说明当以酪蛋白为底物时,菌株NCB-01所产碱性蛋白酶比Alcalase2.4L碱性蛋白酶对蛋白的水解效果更好。
3 结论
该海洋菌株所产蛋白酶具有良好的耐盐性。虽然其最适温度为60 ℃,属于中温蛋白酶,但在10~40 ℃的低温条件下具有良好的热稳定性,最适pH值为8.0,在50 ℃以下的低温环境中该酶可以较好的保持酶活性,在pH值7.0~9.0的范围内也可以保持良好的酶稳定性。该酶具有较好的金属离子耐受能力,Fe2+、K+、Na+、Mn2+、Ca2+、Mg2+对酶活均有不同程度的激活作用。丝氨酸蛋白酶特异性抑制剂(PMSF)能强烈抑制该酶的酶活性,表明该蛋白酶为丝氨酸碱性蛋白酶。非离子型表面活性剂Tween-20、Tween-80及TritonX-100和阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)对酶活均有较强的抑制作用。该酶具有良好的耐盐性。其米氏常数(Km)为1.11 mg/mL,最大反应速率(Vmax)为91.74 μg/(min·mL),说明该碱性蛋白酶与酪蛋白的亲和力好,特异性强。这些优良特性使该蛋白酶在食品、洗涤剂等领域有着潜在应用价值。

