神经类固醇在阿普唑仑抗大鼠焦虑样行为效应中的作用研究
梁钰华 黎少英 陈淑华
(广州市番禺中心医院,广东 广州 511400)
焦虑症是一种社会性精神性障碍疾病。其发病影响着发病者的日常行为,目前,该疾病已成为全球关注和研究的精神性卫生难题。流行病学分析显示全球患者中约有20%的患者可能终身性患有焦虑症。焦虑症患者主要有以下症状,如神经失常和不安,机体方面可能有自主性肌肉紧张等。其发病给国家,家庭和个人都带来极大的负面影响[1-2]。据此,焦虑症的研究和治疗收到越来越多学者的关注。
目前尚未明确焦虑症的发病机制,研究显示焦虑症的发病涉及多种因素。其中传统研究的影响因素为脑区单胺功能和水平的紊乱。而在单胺递质系统中,去甲肾上腺素,多巴胺,5-羟色胺(serotonin,5-HT)等递质水平的异常是焦虑的发病机制重要影响因素[3]。根据焦虑症的发病机制,5-HT再摄取抑制剂是临床上常用的抗焦虑药物之一,具体代表药有舍曲林和帕罗西汀等[4]。该类药物的作用机制是通过作用于机体中5-HT受体,使5-HT水平正常化而产生抗焦虑作用。然而,5-HT再摄取抑制剂在临床上抗焦虑须慎用,这体现在其具有起效较慢,有效率不高,可导致服用者自杀倾向等不良反应[5]。根据以上该类药物在临床使用中的种种不足,挖掘强效低毒的抗焦虑药物对临床防治焦虑症具有重要意义。
研究显示神经类固醇与焦虑症的发病有关,其体现在焦虑症患者中,部分脑区(如前额平层和海马体)的神经类固醇(如四氢孕酮,孕酮和孕烯醇酮等)水平的紊乱可能导致焦虑症的发生[6]。而神经类固醇水平的正常化具有显著的抗精神性疾病的作用,如抗惊恐,抗应激,抗抑郁,抗焦虑等。其作用靶点是γ-氨基丁酸(γ-aminobutyric acid,GABA)受体。阿普唑仑是传统的抗焦虑药物,其起效途径是作用于GABAA受体,提高GABA能中神经传递和突触后抑制作用,使脑区多巴胺的释放降低。然而,阿普唑仑的作用途径是否与神经类固醇有联系还在研究。而本研究也尝试通过动物行为学实验,评价神经类固醇(如四氢孕酮,孕酮和孕烯醇酮)在阿普唑仑抗焦虑效应中所扮演的角色。
1 材料与方法
1.1 试验动物:大鼠(SD品属,雄性,体质量为180±20 g)饲养于动物房中。在饲养大鼠的过程中,动物可以自由摄食和饮水,同时给予每天12 h的光照。每组实验大鼠为10只,每5只一笼饲养适应环境。饲养的温度为18-24 ℃,湿度为54%-56%。
1.2 药物与试剂:阿普唑仑用0.9%的生理盐水进行处理。药物对大鼠的给药方式为腹腔给药,给药的容积为2 mL/kg。选用的剂量范围是根据前期文献中其抗焦虑和抗抑郁的剂量范围 (0.5,1,2 mg/kg)[7-8]。正常对照组大鼠则给予相应体积的溶媒(0.9%的生理盐水)。连续对大鼠给予阿普唑仑7 d后采用动物行为学实验检测其抗焦虑活性。在检测行为学效应前1 h给予药物。具体的实验流程如图1所示。
1.3 大鼠Vogel饮水冲突实验:在实验进行至第8日进行大鼠Vogel饮水冲突实验。该实验是具有评价抗焦虑药物药理效应的作用[9]。在大鼠Vogel饮水冲突实验中,动物首先禁止饮水48 h,然后单独置于带有电栅的实验笼中。当大鼠在实验笼中饮水每20次以后,电栅对大鼠进行1次足底电击,电击调条件为0.30 mA,持续2 s,记录在3 min内大鼠的舔水次数。
1.4 高架十字迷宫实验:在实验进行至第10日进行大鼠高架十字迷宫实验。该实验是具有评价抗焦虑药物药理效应的作用[10]。大鼠高架十字迷宫主要有以下的部件构成:两条长和宽分别为60 cm×12 cm的开臂以及两条长、宽、高分别为60 cm×12 cm×40 cm的闭臂组成。四臂交汇于一中央平台,面积为12 cm×12 cm。迷宫的底面与地面的距离为50 cm。实验开始时,实验者将动物放置于中央平台,头朝闭臂,观察和记录动物的5 min内的活动状况。记录指标如下:大鼠的总入臂次数和总入臂时间,开臂进入次数和开臂停留时间。通过以上指标,进一步计算出进入开臂次数的百分数和在开臂停留时间的百分数。
1.5 开场试验:在实验进行至第12日进行大鼠开场实验。本实验主要研究阿普唑仑对大鼠自发活动的影响。实验采用大鼠开场箱进行。大鼠开场箱的构造如下:仪器由长、宽、高分别为76 cm×76 cm×46 cm不透明的塑料板构造。在仪器的底面则等面积划分为16个方格。本试验评价阿普唑仑在抗焦虑样行为效应同时对大鼠动物自发活动的影响(第12天)。大鼠须在相对安静的环境下进行实验。实验者把大鼠单独置于仪器底面,观察和记录其5 min内的站立次数,跨格数和粪便颗粒数。以上指标综合评价大鼠的自发活动。
1.6 大鼠脑区神经类固醇(四氢孕酮,孕酮,孕烯醇酮)的含量检测:本部分实验属于机制探讨研究,主要研究神经类固醇,如四氢孕酮,孕酮,孕烯醇酮在阿普唑仑抗焦虑药理效应中的作用。在开场实验完成后的24 h以内,将动物进行断头处死。动物处死后取其海马体和前额皮层做后续检测。每100 mg的动物脑组织加入1 mL的组织裂解液(内含蛋白酶抑制剂),然后低温电动使组织匀浆。匀浆后把样品标号并转移至离心机中离心。离心条件为10000 r/min 4 ℃,离心时间为25 min。离心完后取少量上清液进行蛋白浓度的定量,通过稀释液稀释使蛋白浓度定量为4 μg/μL。样品定量以后将其放置于-80 ℃冰箱备测。实验前把四氢孕酮ELISA试剂盒,孕酮ELISA试剂盒,孕烯醇酮ELISA试剂盒放置于室温下平衡。实验过程中设置相关实验孔:空白对照孔,标准品孔,样品孔。其中,标准品孔加入标准品100 μL;样品孔先加入样品稀释液90 μL后再加入样品10 μL。然后,每孔加入50 μL的抗体试剂和50 μL的酶标试剂。采用保护膜把酶标板覆盖起来后,使用平板摇床在室温下摇晃,条件为3 h,600 rpm。摇晃处理后,用甩干的方法弃去液体,然后每孔加入300 μL的洗涤液,并静置5 min。时间点过后甩去洗涤液,并用吸水纸拍干,如此步骤重复3遍。接着每孔加入pNpp底物溶液并在室温下孵育1 h。最后每孔加入50 μL终止液结束样品处理过程。在加入终止液15 min以内用酶标仪在450 nm处读取吸光度,并根据标准曲线和吸光度计算样品的浓度。
1.7 数据统计:数据统计方面,实验结果使用Prism5.0软件进行统计和分析。数据呈现形式以平均值±标准差()表示。实验结果采用组间单因素方差分析(One-way ANOVA)进行统计。以P<0.05显示数据具有统计学上显著性差异。
2 结果
2.1 阿普唑仑抗大鼠焦虑样行为实验研究流程:见图1。大鼠在经过适应期以后,在第1日到第12日给予阿普唑仑(0.5,1,2 mg/kg)和相应的溶媒。并在第8日进行Vogel饮水冲突实验,在第10日进行高架十字迷宫实验和在第12日进行开场实验。行为学实验完毕后,提取海马体和前额皮层进行后续机制研究。
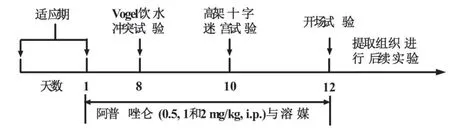
图1 阿普唑仑抗大鼠焦虑样行为实验研究流程
2.2 阿普唑仑在大鼠Vogel饮水冲突实验中的抗焦虑行为效应:见图2。在大鼠Vogel饮水冲突实验中,阿普唑仑对大鼠的抗焦虑样行为药理效应。通过One-way ANOVA统计分析显示,与正常对照组的舔水次数相比,阿普唑仑可增加大鼠的舔水次数(P<0.05),其有效剂量为1和2 mg/kg。实验结果提示在该实验中,阿普唑仑具有显著的抗焦虑样行为作用。
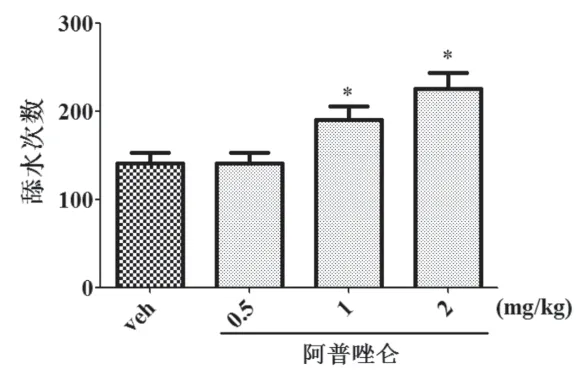
图2 显示阿普唑仑在大鼠Vogel饮水冲突实验中对焦虑样行为的改变。
2.3 阿普唑仑在大鼠高架十字迷宫实验中抗焦虑样行为药理效应:图3显示在大鼠高架十字迷宫试验中对大鼠的抗焦虑样行为药理效应。通过One-way ANOVA统计和分析显示结果如下:与正常对照组的指标相比,阿普唑仑可以增加大鼠进入开臂的次数(P<0.05;图3D)和停留时间(P<0.05;图3C),其有效剂量为1和2 mg/kg。然而,在该有效剂量下,大鼠的总入臂次数(P>0.05;图3B)和总入臂时间(P>0.05;图3A)均不受影响。高架十字迷宫实验的结果也提示阿普唑仑在剂量范围下对大鼠具有显著的抗焦虑样行为药理效应。

图3 显示阿普唑仑在大鼠高架十字迷宫实验中抗焦虑样行为效应。
2.4 阿普唑仑在开场实验中对大鼠自发活动的影响:图4显示在大鼠开场试验中,阿普唑仑对其自发活动的影响。通过One-way ANOVA的统计和分析显示如下:大鼠组与组之间在跨格数(P>0.05;图4A),站立次数(P>0.05;图4B) 和粪便颗粒数(P>0.05;图4C)这几项指标中均无显著性差异。这样的结果也提示阿普唑仑的处理不影响大鼠的自发活动。
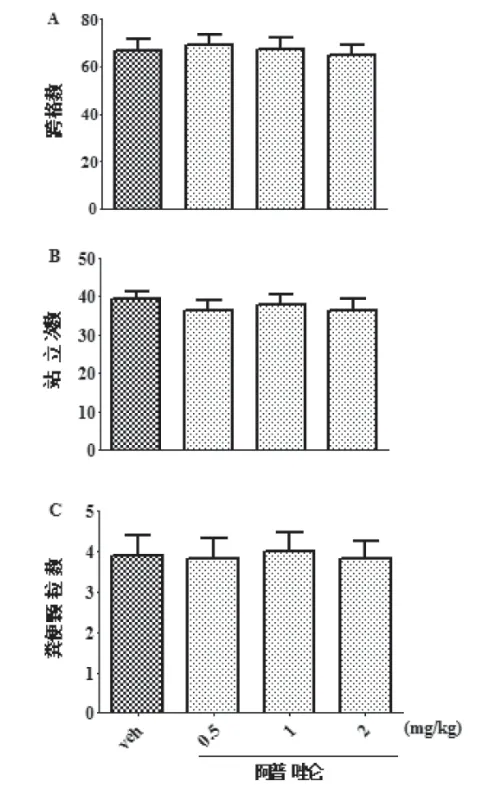
图4 显示在大鼠开场实验中,通过跨格数,站立次数和粪便颗粒数体现阿普唑仑对其自发活动的影响(n=10)。
2.5 阿普唑仑对大鼠前额皮层和海马体中孕烯醇酮,孕酮和四氢孕酮含量的改变:图5所显示,阿普唑仑对大鼠前额皮层和海马体中孕烯醇酮,孕酮和四氢孕酮含量的改变。通过One-way ANOVA的统计和分析显示如下:与正常对照组中孕酮和四氢孕酮指标对比,大鼠前额皮层(图5A)和海马体(图5B)中孕酮(P<0.05,前额皮层;P<0.05,海马体)和四氢孕酮 (P<0.05,前额皮层;P<0.05,海马体)可被阿普唑仑(2 mg/kg)剂量处理后显著提高。然而,这两个脑区中孕烯醇酮的水平却没有因为阿普唑仑的剂量处理而产生显著性变化(P>0.05,前额皮层;P>0.05,海马体)。这些实验结果也提示阿普唑仑的抗焦虑样行为药理效应与前额皮层和海马体中的孕酮和四氢孕酮水平的提高密切联系。

图5 阿普唑仑对大鼠前额皮层和海马体中孕烯醇酮,孕酮和四氢孕酮含量的改变。
3 讨 论
在本研究中,我们主要通过经典的行为学实验评价阿普唑仑的抗大鼠焦虑样行为效应。这些经典的行为学实验包括高架十字迷宫实验以及Vogel饮水冲突实验。Vogel饮水冲突实验属于条件性的反射性实验。这种实验的原理主要是根据大鼠在禁止饮水时所产生的烦渴心理以及舔水时所受到电击而产生的恐惧心理形成矛盾性行为冲突所开展的实验[6]。该实验对临床评价抗焦虑药的药理效应具有参考意义和应用较为广泛,主要是该实验可模拟人类的焦虑反应行为。为增强说服力,本研究中采用另一种评价焦虑行为的实验,该实验是高架十字迷宫实验。实验已被广泛适用于评价多种啮齿类动物的焦虑样行为,也是目前国际上所公认的评价抗焦虑药物药效的途径。
本实验采用长期给药的方式评价阿普唑仑对大鼠的抗焦虑样行为药理作用。在上述研究结果也显示在大鼠Vogel饮水冲突实验中,大鼠的舔水次数在阿普唑仑的处理后显著提高(图2)。不仅在大鼠Vogel饮水冲突实验,在高架十字迷宫实验中,大鼠的开臂进入次数(图3D)和停留时间(图3C)在阿普唑仑给药后显著增多。在两种评价抗焦虑药物药理效应的实验中,阿普唑仑均显示明显的抗焦虑样行为活性,而且两种实验中有效剂量范围相同。这结果也提示着阿普唑仑在1 mg/kg和2 mg/kg的剂量范围抗焦虑样行为作用。不局限于本研究的结果,也有文献报道阿普唑仑的抗焦虑和抗抑郁作用上的剂量范围于本研究的结果一致[7-8]。据此,也提示着阿普唑仑在这个剂量范围下药理效应的可靠性。
此外,在本实验研究中我们除了探索阿普唑仑的抗焦虑作用,还尝试探讨长期给予阿普作用是否影响大鼠的自发活动。据此,我们采用了经典的行为学实验开场实验来评价大鼠的自发活动变化。实验指标为粪便颗粒数,站立次数和跨格数。在实验中结果显示,在给药过程中,阿普唑仑不影响大鼠的跨格数(图4A),站立次数(图4B)和粪便颗粒数(图4C)这些指标。实验结果也提示阿普唑仑长期给药不影响动物的自发活动。与此一致的是,在上述高架十字迷宫实验中,阿普唑仑不影响大鼠总入臂次数(图3B)和时间(图3A)。两个实验均有指标提示其一致性。
进一步我们在动物行为学实验完结后提取前额皮层和海马体进行机制研究。主要检测这两个脑区中神经类固醇(如四氢孕酮,孕酮和孕烯醇酮)的水平,以进一步探讨阿普唑仑抗焦虑作用与这些神经类固醇水平的相关性。结果显示在海马体(图5B)和前额皮层(图5A)中四氢孕酮和孕酮的水平可被阿普唑仑剂量范围下提高。这个结果也提示阿普唑仑的抗焦虑样行为效应与这两个脑区中孕酮和四氢孕酮水平的提高有关。对照文献结果,有报道显示阿普唑仑的抗抑郁样行为效应与提高以上两个脑区中的四氢孕酮水平相关[8]。这个结果与本研究结果一致。结合文献和本研究结果,阿普唑仑的抗焦虑样行为效应可能与提高海马体和前额皮层两个脑区中四氢孕酮水平有关。前期研究显示焦虑症的发病与脑区中四氢孕酮和孕酮水平的下降有关[9]。如焦虑症患者脑髓液中四氢孕酮的水平较正常水平低,其原因可能与四氢孕酮合成关键酶5α还原酶水平下降有关。无独有偶,在相关的焦虑实验研究当中,四氢孕酮和孕酮水平的下降可能成为大鼠至焦虑的重要诱因,其严重程度与大脑前额皮层中的以上两种神经类固醇水平合成有关。综合本研究与前期研究的实验结果,阿普唑仑的抗焦虑样行为效应可能与四氢孕酮和孕酮水平的正常化有关。尤其是四氢孕酮,其作用在GABA受体上特异性亚基后可产生相应的药理作用,如抗抑郁,抗惊恐,抗焦虑等药理效应。综上所述,阿普唑仑具有显著的抗焦虑作用,而该作用可能与提高特异性脑区海马体和前额皮层中四氢孕酮和孕酮水平相关。然而,本研究中孕烯醇酮的水平则无显著性改变,这可能是因为孕烯醇酮作为以上两种神经类固醇的上游产物。在转化过程中对下游产物产生变化。更多和进一步的实验需要验证以上的推测。

