氢质子核磁波谱对儿童热性惊厥脑异常检出和预后评估的价值分析
曹建伟 刘美玲 李莹莹 郑铠军 杨昂 卢贤秀
热性惊厥(febrile seizures,FS)是小儿常见的急症,与多种原因使脑神经功能紊乱相关,约30%~40%的患儿日后发展为癫痫[1-3]。研究显示,MRI发现脑实质阳性病灶是FS预后不良的独立危险因素[4]。然而,MRI对FS患儿脑实质病灶的阳性检出率并不高,假阴性率较高[5]。核磁波谱分析(magnetic resonance spectroscopy,MRS)是一种检测体内化学成分、组织代谢产物的无创性检查方法,临床中以氢质子核磁波谱分析(hydrogen proton nuclear magnetic resonance spectroscopy,H1-MRS)最为常用[6-7]。文献指出,在颞叶癫痫患儿的头颅MRI检测海马异常的阳性率为75%,H1-MRS检查海马异常的阳性率90%,其有助于提高癫痫患者病灶的定位诊断率[8-10]。H1-MRS的一大特点是可以检测脑神经细胞代谢物质,包括氮-乙酰天门冬氨酸(N-acetyl aspartic acid,NAA)、肌酸(creatine,Cr)、磷酸肌酸(Creatine phosphate,Cho)等,这些代谢物质是反应神经细胞功能的重要指标之一。有研究发现,NAA/(Cr+Cho)、NAA/Cr和NAA/Cho值在癫痫病灶位置显著降低,且与癫痫患者的发病呈正相关[10]。但关于H1-MRS对FS患儿的脑异常检出效率、NAA/(Cr+Cho)、NAA/Cr以及NAA/Cho值在FS患儿中临床意义的报道罕见。本研究分析H1-MRS对儿童FS的脑实质异常的检测效率以及用于预测临床预后的价值,现将相关研究结果报道如下。
资料与方法
一、一般资料
选择自2017年3月至2018年5月中山市人民医院普通儿科收治的38例FB患儿为研究对象,其中男性21例,女性17例,年龄范围6.7个月~5.5岁,年龄(3.42±1.02)岁。入选标准:(1)年龄在6个月~6岁的FS患儿,诊断标准根据《热性惊厥诊断治疗与管理专家共识(2017实用版)》[11];(2)患儿家属知情同意。排除标准:(1)合并颅内占位性疾病;(2)合并中枢神经系统感染性疾病;(3)合并癫痫;(4)代谢性疾病、微量元素缺乏、电解质紊乱等因素导致的抽搐;(5)早产、产前明确的神经系统异常;(6)随访期间颅脑外伤等所致的不适合继续研究;(7)随访期间要求退出本研究。本项目经中山市人民医院医学伦理委员会审核通过,并批准进行(编号:20170205)。
二、颅脑MRI及H1-MRS检查
在FS发作后1周内完善颅脑3.0 T MRI(Philips Achieva 3.0T TX,飞利浦科技公司,荷兰)及H1-MRS(Philips Achieva 3.0T TX,飞利浦科技公司,荷兰)检查。常规MRI扫描完成后,H1-MRS扫描采用二维多体素化学位移成像、点分析波谱技术,感兴趣区定位于双侧基底节区、丘脑及部分额叶、颞叶,根据患儿头颅大小调整范围,自动匀场及水抑制后开始扫描。扫描结果经处理获得感兴趣区的波谱信息,然后转换为相应代谢物测定值,然后计算NAA/(Cr+Cho)、NAA/Cr和NAA/Cho值。
三、研究指标
比较MRI检查及H1-MRS检查对脑实质异常的检出率差异。对所有FS患儿进行跟踪随访2年,以2年内出现智力、语言以及癫痫等神经功能异常作为临床预后不良,将出现不良预后的患儿纳入有不良临床预后组,无不良预后的患儿为无不良临床预后组,比较2组患儿NAA/(Cr+Cho)、NAA/Cr和NAA/Cho值的差异,并将上述有差异性的指标作为患者预后不良的危险因素,绘制受试者工作特征曲线 (receiver operating characteristic curve,ROC曲线),分析上述指标对FS患儿预后的预测价值。
四、统计学分析
采用SPSS20.0软件进行统计分析,计量资料以均数±标准差(Mean±SD)表示,采用t检验;计数资料以率(%)表示,采用χ2检验;预测价值采用危险因素分析法,采用多因素Logistic回归,建立ROC曲线分析研究指标对临床预后的预测价值。以P<0.05作为差异具有统计学意义。
结果
一、MRI与H1-MRS对FS诊断效率差异比较
38例FS患儿中,MRI检出颅脑异常情况有23例,H1-MRS检出颅脑异常情况有32例,异常情况检出率差异有统计学意义(χ2=5.330,P=0.021)。有9例患儿MRI未见异常,但在H1-MRS检出异常(图1)。
二、有不良临床预后组和无不良临床预后组患儿代谢物的差异比较
38例FS患儿中,有不良临床预后组患儿有13例,无不良临床预后组患儿25例。2组患儿的性别、年龄差异无统计学意义(P>0.05)。有不良临床预后组患儿中复杂性FS的比率高于无不良临床预后组,差异有统计学意义(P<0.05)。有不良临床预后组患儿的NAA/(Cr+Cho)、NAA/Cr、NAA/Cho值均小于无不良临床预后组,差异有统计学意义(P<0.05)。具体信息见表1。
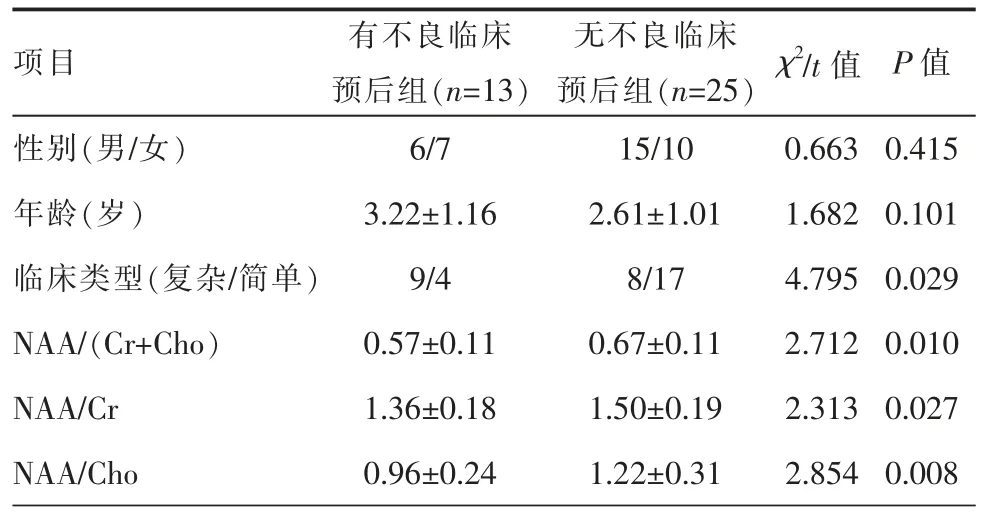
表1 患儿的基本情况及代谢物质比较
三、NAA/(Cr+Cho)、NAA/Cr、NAA/Cho值对预后的预测价值
绘制NAA/(Cr+Cho)、NAA/Cr、NAA/Cho值预测不良临床预后的ROC曲线,其相应的曲线下面积分别为0.848、0.774、0.797(表2,图2)。
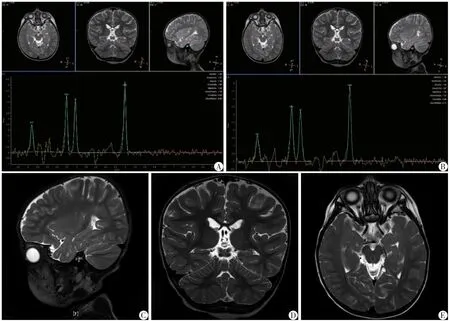
图1 MRI与H1-MRS对脑实质异常检出的差异示例
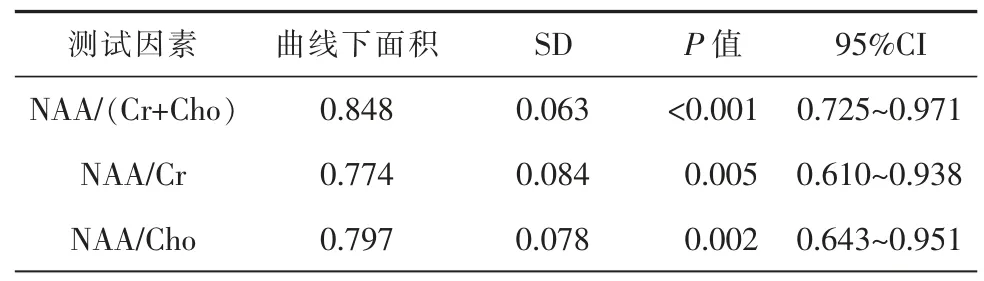
表2 NAA/(Cr+Cho)、NAA/Cr、NAA/Cho值对预后的预测价值
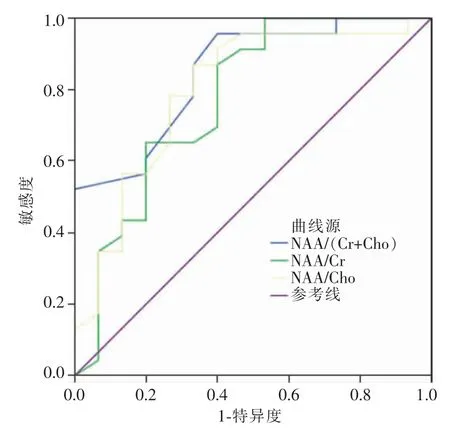
图2 NAA/(Cr+Cho)、NAA/Cr、NAA/Cho值对不良预后预测的ROC曲线
讨论
惊厥是导致儿童神经功能发育障碍的重要病因之一,给家庭和社会带来重大负担[12]。本研究分析了H1-MRS对FS患儿脑实质异常的检出率,及其结果用于预测临床预后的价值。目前,较多H1-MRS应用于癫痫的研究报道指出,H1-MRS可以通过检测神经细胞相关代谢物质来随访癫痫的治疗效果,其机制是H1-MRS可以获得各种细胞代谢物的水平数据,如γ-氨基丁酸(γ-aminobutyric acid,GABA)、NAA、Cr、Cho等。抑制性神经细胞损伤或死亡时,GABA含量会显著减少,导致神经网络的兴奋-抑制失衡,是癫痫发病的重要发病机制之一[13-14]。NAA主要分布在神经元及其前体细胞中,而在胶质细胞中极少,是神经元的标志物之一[15]。而且NAA是突触联系形成和稳定不可缺少的物质,因此,NAA水平能够侧面反映出区域性神经元数量及其功能状态,进而能反映神经信号网络的成熟程度[16]。而Cr、Cho是由胶质细胞产生,在神经元和神经胶质细胞中均有分布,但在胶质细胞中的含量远高于神经元[17]。因此,神经元和神经胶质细胞出现异常变化时,NAA/(Cr+Cho)、NAA/Cr、NAA/Cho水平也将相应变化。NAA/(Cr+Cho)、NAA/Cr、NAA/Cho水平变化及其在癫痫中的临床意义已有相关研究报道,但是在FS中报道少见[18-19]。
FS的一个重要疾病进展是出现癫痫发病[1-2,12]。其病理机制与FS发作时导致的神经细胞损伤、基因转录重编码、离子通道变化等相关,并能进一步引起神经细胞代谢物质变化,理论上H1-MRS能够检测到与癫痫类似的变化[20-22]。本研究结果显示,有不良临床预后的FS患儿脑实质病灶区的NAA/(Cr+Cho)、NAA/Cr、NAA/Cho值均显著小于无不良临床预后的患儿,提示FS患儿也出现了神经细胞的损伤和(或)胶质细胞的活化。同时,出现不良临床预后的FS患儿中,更多表现为复杂性发病,因此脑神经细胞损伤的程度更重。将这3个比值作为患者预后不良的危险因素,绘制ROC曲线分析发现,NAA/(Cr+Cho)对不良预后的预测效果较好,曲线下面积大于0.8,这一研究结果与NAA/(Cr+Cho)对癫痫预后预测效果的研究报道相似[10]。已有较多报道表明H1-MRS较MRI对脑实质异常的检出率更具优势,本研究对这一结论进一步拓展了其适用范围,H1-MRS对FS的脑实质异常检出率显著高于MRI,降低了假阴性率。
综上所述,H1-MRS检查在FS患儿中的临床价值是肯定的,提高了FS患儿脑实质异常的检出率,而且NAA/(Cr+Cho)值对患儿的预后具有较好的预测价值,有利于及早识别有危险因素的患儿,促使医患双方共同制定更为针对性的预防和治疗方案。

