约氏疟原虫丝/苏氨酸磷酸酶6免疫血清对原虫有性阶段发育抑制作用的研究*
于园超 洪明阳 周 丹 朱晓彤
(中国医科大学基础医学院免疫学教研室,辽宁沈阳 110122)
疟疾是由疟原虫引起的寄生原虫感染性疾病。近年来,全球疟疾防控使疟疾流行范围逐渐缩小,但死亡率仍居高不下且发病人数有所回升,疟疾消除工作停滞不前(闫妍等,2018)。实现消灭疟疾的一种潜在方法是使用传播阻断疫苗(Transmission Blocking Vaccines, TBVs)(Nunesetal.,2014)。TBVs可诱导宿主体内产生有性发育阶段特异性抗体,抗体随疟原虫感染血液被按蚊吸食入体内以阻止疟原虫在蚊胃内的进一步发育(Leetal.,2019)。传播阻断疫苗的靶位是有性发育阶段的疟原虫,其功能作用不受人体免疫系统的干扰(Schwartzetal.,2012)。目前研究发现的多个疟疾传播阻断疫苗候选抗原,如P25、P28、P48/45、P230和HAP2/GCS1虽具有显著的传播阻断效果,但均不能彻底阻断疟疾传播(Lennartzetal.,2018)。因此,开发新型疟疾传播阻断疫苗仍迫在眉睫。
疟原虫体内的可逆性磷酸化修饰在原虫生长发育中发挥重要作用(Govindasamyetal.,2019)。因此,参与此修饰过程的蛋白激酶和磷酸酶是潜在的抗疟药物和疫苗研发靶点(Strickeretal.,2006)。研究发现,疟原虫编码大约85个蛋白激酶和30个蛋白磷酸酶(Wardetal.,2004),且具有人类所有主要磷蛋白磷酸酶(PPP)亚科PP1-PP7的所有同源基因(Kutuzovetal.,2008)。PP6属于 PP2A家族,参与细胞周期的调控,如Polo样激酶1(Polo-like kinase 1,Plk1)和 PP6相互作用产生一个反馈回路,其可加强有丝分裂时Plk1和Aurora a的活动,并通过降解Plk1终止有丝分裂过程(Kettenbachetal.,2018)。在酵母中,PP6在染色体分离和纺锤体组装过程中发挥重要作用(Rusinetal.,2015)。氨基酸序列预测分析显示,恶性疟原虫PP6的催化结构域与 PPP 其他成员高度同源且保守(Dobsonetal.,2003),但PP6在疟原虫中的作用尚不明确。
本文采用生物信息学分析选取约氏疟原虫PP6(PlasmoDB ID: Py02284,PyPP6)优势抗原表位区域制备鼠源性多克隆抗体,并通过ELISA和Western blot检测抗-PyPP6抗体的效价及其特异性。间接免疫荧光检测PyPP6蛋白在约氏疟原虫各发育阶段的定位情况。通过体内外实验评估抗-PyPP6抗体的传播阻断效果。本研究旨在为探索疟原虫新型传播阻断疫苗提供理论基础。
1 材料与方法
1.1 实验材料
雌性6~8周龄BALB/c小鼠(北京实验动物研究所),Py17XL约氏疟原虫株(中国医科大学免疫学教研室)。限制性内切酶BamHI和NotI(ThermoFisher)、In-Fusion HD(Clontech)、快速质粒小提试剂盒(天根)、TaKaRa Agarose Gel DNA Extraction Kit v4.0(TaKaRa)、HisPurTMNi-NTA Magnetic Beads(ThermoFisher)、SuperSignal West Pico Chemiluminescent Substrate(ThermoFisher)、6×His Tag monoclonal antibody(ThermoFisher)、RPMI1640培养基(Gibco)、胎牛血清(Hyclone)、Tween-20(北京鼎国)、Alexa FluorTM488 goat anti-mouse IgG(H+L)(Invitrogen)、Goat anti-Mouse IgG(H+L)Secondary Antibody, HRP(Thermo Fisher)、Kod-Plus-Neo(TOYOBO)、LB(Solarbio)、DAPI(Invitrogen)、IPTG(Genview)、PVDF膜(Millipore)、4×LDS Sample Buffer(Invitrogen)。
1.2 目的基因合成及原核表达载体构建
以Py17XL原虫gDNA为模板,采用特异性引物通过PCR反应扩增PyPP6目的片段。将上述PCR产物进行琼脂糖凝胶电泳,切胶纯化后连接到pET32a(+)原核表达载体上,转化至大肠杆菌中。挑取阳性菌落进行质粒小提酶切鉴定及测序比对,筛选正确的pET32a(+)-PyPP6质粒。
1.3 重组蛋白的表达、纯化
选取pET32a(+)-PyPP6鉴定正确菌种,采用1 mmol/L IPTG诱导后20 ℃摇菌过夜。次日,收菌后超声裂解,采用HisPurTMNi-NTA Magnetic磁珠纯化PyPP6-his重组蛋白后,进行聚丙烯酰胺凝胶电泳。经考马斯亮蓝染色30 min后,甲醇—乙酸脱色检测重组蛋白提纯效果。采用重组蛋白与4×LDS Sample Buffer预混后,100 ℃水浴锅煮沸3 min,进行聚丙烯酰胺凝胶电泳。25 V半干法转膜30 min后,采用5%脱脂奶粉室温封闭PVDF膜1.5 h后,TBS-T漂洗3次,每次10 min。采用6×His Tag Monoclonal Antibody(1∶2 000)孵育,4 ℃过夜。TBS-T洗涤后,采用HRP标记的山羊抗小鼠IgG抗体(1∶20 000)室温孵育1 h,TBS-T漂洗3次,每次10 min后,采用ECL发光方法检测结果。
1.4 实验动物免疫
将20只雌性6~8周龄BALB/c小鼠随机分为2组。组1小鼠免疫PBS(PBS);组2为PyPP6重组蛋白免疫组(PyPP6)。初次免疫重组蛋白(50 μg/只)与完全弗氏佐剂1∶1充分混合皮下注射,二免和三免采用重组蛋白和不完全弗氏佐剂1∶1充分混合,每间隔14 d免疫1次,共免疫3次。3免后第10 d收集各免疫组小鼠血清,-80 ℃保存。
1.5 ELISA法检测免疫血清效价
采用10 μg PyPP6重组蛋白包被96孔酶标板,室温过夜。采用含1% BSA的磷酸盐缓冲液(PBS)封闭96孔板,37 ℃孵育l h。每孔加入100 μL倍比稀释后的待检测免疫血清,37 ℃孵育 2 h。PBS-T洗板5次后,每孔加入100 μL HRP标记的羊抗鼠IgG抗体(1∶5 000),37 ℃孵育l h。PBS-T洗板5次后,加入底物邻苯二胺和过氧化氢显色5 min,2 mol/L H2SO4终止反应。采用Bio-Rad酶标仪检测450 nm处OD值。
1.6 Western blot检测抗-PyPP6免疫血清特异性
纯化并收集环状体、滋养体、裂殖体、配子体和动合子期Py17XL原虫蛋白进行Western blot检测。采用抗-PyPP6免疫血清(1∶200)检测PyPP6蛋白在Py17XL原虫各发育阶段的表达情况。
1.7 IFA 进行PyPP6蛋白的亚细胞定位
分别收集Py17XL的环状体、裂殖体、雌/雄配子体、出丝、动合子期原虫于1.5 mL EP管中,采用4%多聚甲醛/0.0075%的戊二醛室温固定3 h后,0.1 mg/mL硼氢化钠室温中和10 min。5%脱脂奶粉室温封闭1 h,PBS洗涤3次后,采用anti-PyPP6血清(1∶200)室温孵育2 h。PBS洗涤5次后,采用Alexa FluorTM488 goat anti-mouse IgG(H+L)(1∶500)避光室温孵育1 h。1 μg/mL DAPI染核后封片,Nikon ECLIPSE 80i荧光显微镜检测PyPP6在原虫各发育阶段的定位情况。
1.8 抗-PyPP6免疫血清对疟原虫有性发育阶段抑制效果的观察
雌性6~8周龄BALB/c小鼠感染前2 d注射苯肼(200 μL/只;浓度:6 mg/mL),采用1×107个Py17XL腹腔注射感染BALB/c小鼠,待感染后第2 d喂磺胺,感染第3 d取10 μL小鼠尾血与40 μL动合子培养基(RPMI1640培养基+25%胎牛血清+青霉素+链霉素)并加入1∶5稀释的抗-PyPP6免疫血清混合,24 ℃,15 min孵育后取1 μL涂片,30 min内计数40倍视野下的雌/雄配子体数目、雌/雄配子数和雄配子出丝数目。动合子培养采取小鼠尾血与动合子培养基1∶9比例,19 ℃培养24 h后,取1 μL培养体系/孔制备荧光片,采用抗-Pys25抗体(1∶200)染色,在荧光显微镜下计数动合子数目并计算动合子转化率。
1.9 按蚊饲养和蚊饲实验
雌性按蚊采用常规方法在温度为25°C,湿度为50%~80%,昼夜节律12 h的条件下每天采用10 %(w/v)葡萄糖水喂养(Wangetal.,2013)。采用1×107个Py17XL腹腔感染BALB/c小鼠,感染后第3 d,随机分为PyPP6组和PBS组,每组2只小鼠。直接蚊饲实验前1 h,PyPP6组和PBS组小鼠分别尾静脉注射100 μL抗-PyPP6免疫血清和抗-PBS免疫血清,蚊饲2 h,7 d后解剖按蚊取胃并计数每只按蚊胃中卵囊数目。
2.0 数据处理
本研究中实验数据采用GraphPad Prism 6.01软件进行分析绘图和统计学分析。血清抗体滴度、配子体率、雌/雄配子体激活率、雄配子出丝、雄配子结合雌配子的能力、动合子数目和动合子转化率采用Student′sttest检验进行比较;卵囊数目采用 Mann-WhitneyUtest。P<0.05提示组间显著差异。
2 结果
2.1 PyPP6重组蛋白的表达及抗-PyPP6免疫血清抗体滴度检测
本研究中成功诱导PyPP6重组蛋白的表达,考马斯亮蓝染色结果图显示,PyPP6重组蛋白纯度>90%,蛋白大小约49.9 kDa(图1-A)。ELISA结果显示,抗-PyPP6免疫血清的抗体滴度为1∶128 000(图1-B)。
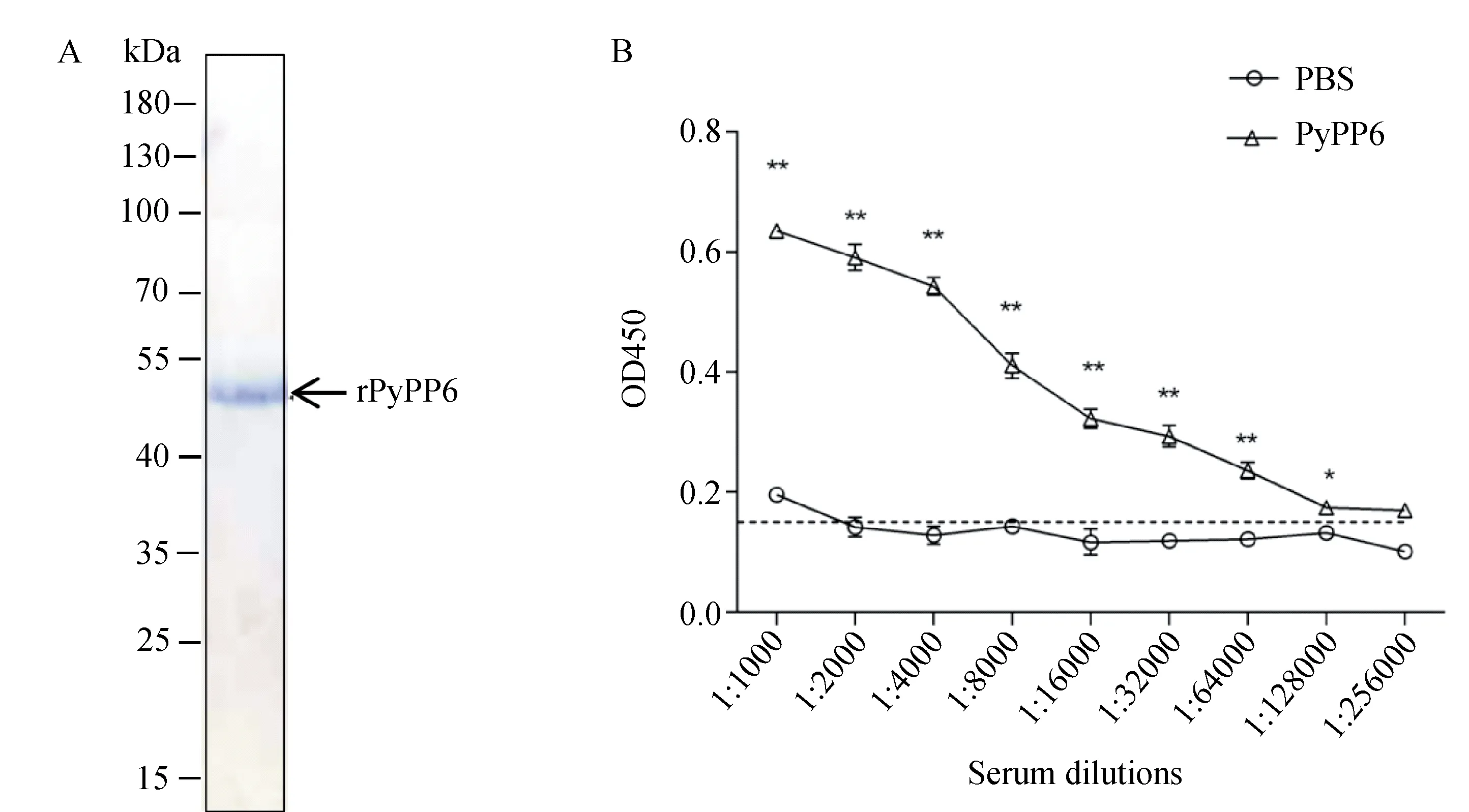
图1 PyPP6重组蛋白表达检测
2.2 Western blot检测PyPP6蛋白在约氏疟原虫各发育阶段的表达情况
Western blot实验结果显示,抗-PyPP6免疫血清具有良好的免疫反应性。研究发现PyPP6蛋白在约氏疟原虫的环状体、滋养体、裂殖体、配子体及动合子期均有表达,且蛋白大小符合预期大小,约为36 kDa。本实验采用Hsp70作为内参蛋白(图2)。
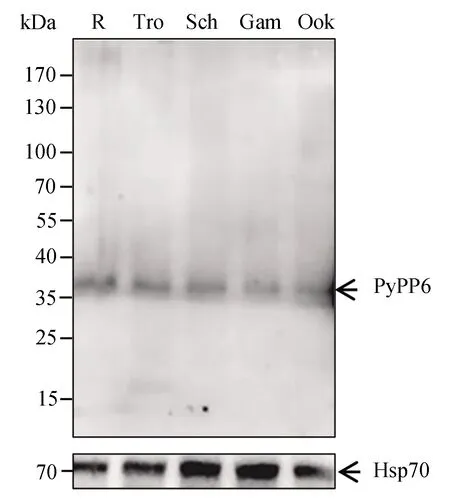
图2 PyPP6蛋白在原虫各发育阶段表达水平检测
2.3 IFA 检测PyPP6蛋白在疟原虫各发育阶段的亚细胞定位
本研究通过荧光显微镜观察发现,PP6蛋白在约氏疟原虫的环状体,裂殖体,雌/雄配子体和动合子阶段均有表达。其中,动合子期PyPP6荧光信号定位在原虫质膜,且0.1%Triton X-100未处理组(Ook Triton X-100(-))仍可检测到PyPP6荧光信号,并与约氏疟原虫表面抗原Pys25蛋白定位模式相似,提示PyPP6为动合子期原虫表面蛋白(图3)。
2.4 抗-PyPP6免疫血清对配子体率、配子活化和受精能力的影响
与PBS组相比,抗-PyPP6免疫血清(1∶5)对配子体率及雌/雄配子体活化能力均无明显影响(图4-A和4-B)。但与对照组相比,抗-PyPP6血清处理组,雄配子出丝减少了61.5%(P< 0.05,图4-C),雄配子粘附雌配子能力下降44.6%(P<0.0001,图4-D),提示抗-PyPP6免疫血清可影响雄配子受精功能。
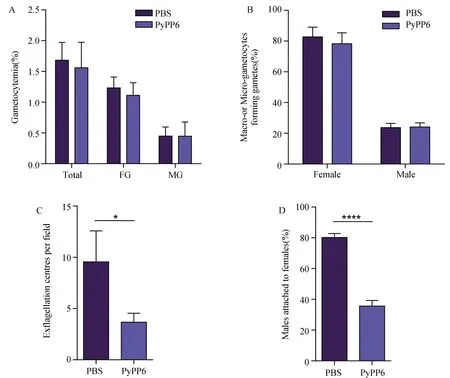
图4 抗-PyPP6免疫血清对配子体期原虫发育的影响
2.5 抗-PyPP6免疫血清对体外动合子期原虫发育的影响
从图5-A可以看出,1∶5稀释的抗-PyPP6免疫血清处理组(PyPP6)动合子的形成数量明显减少了75%(P< 0.01),且动合子转化率下降了19.7%(P< 0.01,图5-B)。上述结果提示:抗-PyPP6免疫血清对体外动合子的形成及发育具有显著的抑制作用。
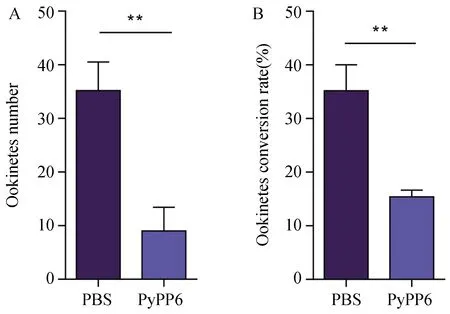
图5 抗-PyPP6免疫血清对动合子发育的影响
2.6 抗-PyPP6免疫血清对卵囊形成数量的影响
蚊饲实验观察显示,与对照组相比,吸食抗-PyPP6免疫血清被动转移组小鼠血液的按蚊胃内卵囊形成数目明显减少(P< 0.0001,图6)。与对照组相比,按蚊感染率下降1.5%,而蚊胃内卵囊密度减少35%(表1)。上述结果提示抗-PyPP6免疫血清可显著抑制蚊体内卵囊形成。
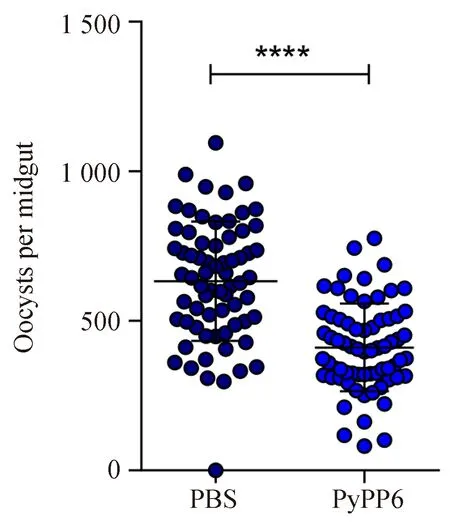
图6 抗-PyPP6免疫血清对卵囊形成的影响
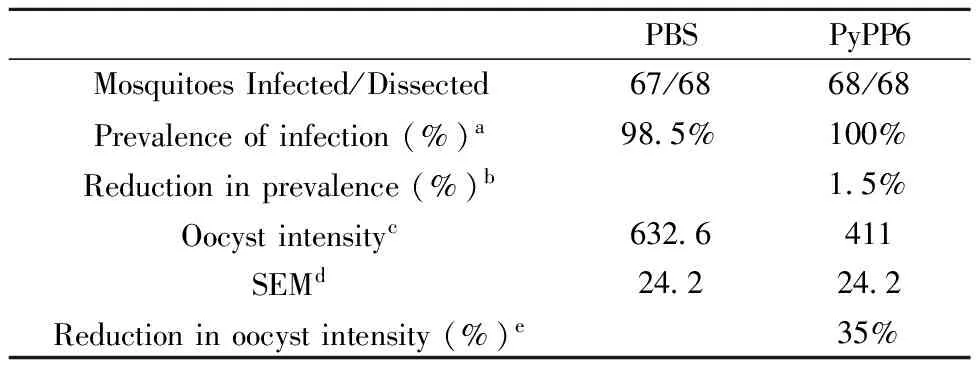
表1 抗-PyPP6免疫血清对约氏疟原虫有性阶段的影响
3 讨论
蛋白质的可逆性磷酸化修饰在疟原虫的生长、发育和致病等多个过程中发挥重要作用(Miliuetal.,2017)。蛋白激酶和磷酸酶参与蛋白磷酸化修饰的调控过程,蛋白激酶作为传统的抗疟治疗药物靶标已获得广泛关注和研究,而关于蛋白磷酸酶的研究尚处于起步阶段。有研究表明,30种磷酸酶中有16种是疟原虫有性阶段生长发育所必须,如PPM1及PPM2分别参与活化雄配子和雌配子分化及动合子转化,PPK1参与合子和动合子的发育,SHLP1可介导动合子滑动,PPM5和PP1参与卵囊形成(Gutteryetal.,2014; Hollinetal.,2019);而PP5蛋白参与雄配子形成和发育影响疟原虫有性阶段的生长(Zhuetal.,2019)。同时,前期研究中发现,伯氏疟原虫PP6蛋白(PbPP6)在动合子阶段定位于原虫质膜,其特异性免疫血清可显著抑制雄配子出丝、动合子形成、动合子转化和蚊胃内卵囊发育。上述结果提示PbPP6蛋白参与疟原虫有性发育阶段(孙林等,2019),可作为潜在的传播阻断疫苗靶位。本研究旨在通过探讨PbPP6在约氏疟原虫中同源蛋白PyPP6的定位和表达情况,同时分析其免疫血清的传播阻断效果,从而全面检测不同种属疟原虫中PP6蛋白作为传播阻断疫苗靶位的可行性。
ELISA检测发现,与对照组PBS相比,PyPP6蛋白具有良好的免疫原性。候选TBVs通常定位于有性发育阶段(配子、合子和动合子)原虫质膜表面(Sauerweinetal.,2015)。本研究中,通过IFA 检测,发现PyPP6定位于雄配子和雌配子原虫质膜表面,提示其可能参与雌/雄配子受精过程。同时,PyPP6蛋白表达在合子/动合子期原虫质膜表面,且抗-PyPP6免疫血清可显著抑制动合子形成和转化,提示PyPP6蛋白同时参与动合子的发育过程。综上,PyPP6蛋白可作为传播阻断疫苗候选抗原。
目前发现的TBVs包含表达于配子体和配子表面受精前疫苗候选抗原:P230、P48/45和HAP2等;表达于蚊体内的受精后疫苗候选抗原:P25和P28等(Zhengetal.,2019)。由于疟疾感染患者存在针对上述抗原的天然抗体,故受精前疫苗具有增强免疫的作用,而受精后疫苗可延长或者阻断疟原虫发育过程,所以两者均具有较好的传播阻断活性(Leeetal.,2020)。前期研究发现,Pfs230其传播阻断效果可达80%;HAP2免疫血清可使卵囊发育降低97%(Acquahetal.,2019)。虽然均有显著的传播阻断效果,但仍不能完全阻断疟疾传播。而本研究中的PyPP6蛋白在疟原虫受精前和受精后均有表达。受精前显示,抗-PyPP6免疫血清(1∶5)对配子体率和配子体激活无影响,但可显著抑制雄配子出丝和受精功能,提示PyPP6蛋白可能参与受精前的配子体出丝过程,因此可作为受精前疫苗的靶位。受精后,虽然抗-PyPP6免疫血清对蚊阶段发育的阻断效果不如抗-Pfs25(>90%)(Kapuluetal.,2015),但仍可显著抑制动合子形成及动合子转化率,提示PyPP6蛋白可能参与受精后的动合子发育过程,因此可作为受精后疫苗的靶位。体内蚊饲实验进一步证明PyPP6在受精后具有显著的传播阻断效果。本研究中获得的抗-PyPP6免疫血清的传播阻断效果与前期研究中获得的抗-PbPP6免疫血清的传播阻断效果相近(1∶5倍稀释的抗-PbPP6免疫血清可使配子体出丝数目减少62.5%;动合子数目显著下降65.3%;动合子转化率下降42.07%)。蛋白序列比对分析显示,PyPP6与PbPP6蛋白同源性为99.7%。高度相近的蛋白同源性,可能是两种免疫血清具有相近传播阻断效果的生物学基础,提示抗-PP6的免疫血清可能对不同种属的疟原虫感染具有交叉保护效果。
本实验对PyPP6在疟原虫各发育阶段的表达和定位以及抗-PyPP6免疫血清的传播阻断效应进行了综合评估。研究表明:PyPP6重组蛋白具有良好的免疫原性和免疫反应性。约氏疟原虫抗-PyPP6免疫血清具有一定的传播阻断效果。本研究为疟原虫传播阻断疫苗的研发提供了必要的前期基础。

