植物乳杆菌素M1-UVs301 阳离子交换法分离纯化的研究
安宇,王颖,2,易华西,张东杰
(1.黑龙江八一农垦大学,大庆163319;2.国家杂粮工程技术研究中心;3.中国海洋大学食品科学与工程学院)
乳酸链球菌素(Nisin)作为乳酸链球菌素时经核糖体合成机制产生的多肽或前体多肽[1],凭借其突出的抑菌活性以及易消化降解[2],使用无蓄积性毒害作用、遗传稳定性良好等[3-5]特点,逐步成为研究者和消费者的关注热点。近年来,学者对于乳酸菌细菌素的理化性质与代谢功能在现阶段的研究相对透彻,但由于乳酸菌发酵液中分离纯化细菌素难度较大,效果不理想,使得其因成本昂贵,操作烦琐等因素在工业化分离生产中备受限制[6]。
鉴于乳酸菌细菌素的分离纯化主要根据其自身性质和实验条件选择分离纯化方法。而课题组前期从传统肉肠制品中分离到三株可降解胆固醇的乳酸菌为植物乳杆菌。目前,关于植物乳杆菌素分离纯化的研究多选择离子交换色谱[7]、疏水层析[8-9]、凝胶过滤层析[10]等色谱柱分离方式。Song 等[11]依据不同种类蛋白质疏水性强弱不同的特性选用疏水柱层析分离纯化PlantaricinZJ5;Gong 等[12]则根据蛋白质分子量大小差异选择凝胶过滤层析法分离纯化plantaricin MG 植物乳杆菌素。鉴于植物乳杆菌素为带电荷的小分子肽,因此,实验选择阳离子交换层析柱纯化植物乳杆菌素M1-UVS300,经离子交换层析柱和小肽柱两步纯化,探究其精确分子量和纯度,并对样品氨基酸成分及含量进行,为植物乳杆菌素M1-UVs301 的结构及功能特性研究提供数据支持及理论基础。
1 材料和方法
1.1 实验菌株
植物乳杆菌M1-UVs300,为实验室前期诱导分离保藏菌种;指示菌:金黄色葡萄球菌、荧光假单胞杆菌,由黑龙江八一农垦大学食品微生物实验室提供。
1.2 主要试剂仪器
主要试剂:MRS 培养基,杭州百思生物技术有限公司;丙烯酰胺、Tris、冰乙酸、无水乙醇、乙腈、甲酸、丙酮(色谱纯),天津市大茂化学试剂厂;预染蛋白Marker,Thermo 公司。
主要仪器:DRP-9082 电热恒温培养箱,上海森信实验仪器有限公司;显微镜,上海精密仪器有限公司;BCN-1360 超净工作台,上海梅特勒-托利多仪器有限公司;LDZX-75KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;TD5A 台式多管架离心机,北京东联哈尔仪器制造有限公司;氨基酸分析仪,德国Sykam 公司。
1.3 实验方法
1.3.1 发酵液的制备
将贮藏于实验室的植物乳杆菌菌株活化后,接种到MRS 培养基中,菌种接种的量为2%。于37 ℃的条件下中培养发酵16 h 后取出,以8 000 r·min-1的转速进行离心,离心5 min 以除去菌体。以NaOH(浓度为5 mol·L-1)调节上清液的pH 至6.0(去除培养过程中中酸性物质对体系的影响),过微孔滤膜滤(0.22 μm)后于冷藏保存(4 ℃)。
1.3.2 阳离子交换层析纯化
离子交换层析即根据不同蛋白质带有的电荷与离子柱之间结合程度不同以达到分离纯化的目的。通过抑菌试验结果可知,荧光假单胞菌处理后的无细胞发酵液具备一定的抑菌能力。对其进行纯化[13],实验选用SP sepHarose Fast Flow 阳离子交换层析柱。
1.3.3 收集液浓缩
将收集液装至1 kDa 的透析袋中,加入透析液(5 mmol·L-1PBS)透析24 h 后取出,采用冷冻干燥方式将其浓缩后,通过双层牛津杯检验法,探究收集液浓缩后的抑菌活性。

表1 阳离子交换层析条件Table 1 The condition of SP SepHerose Fast Flow
1.3.4 Superdex Peptide 10/300 GL 凝胶过滤层析纯化
根据实验前期结果确定纯化的植物乳杆菌素分子量在3~10 kDa 之间,而Superdex Peptide 10/300 GL凝胶过滤层析柱对蛋白质的分离范围在0.1~7 kDa 之间,因此选择Superdex Peptide 10/300 GL 凝胶过滤层析柱进一步对待测样品纯化,纯化条件如表2 所示[14]。
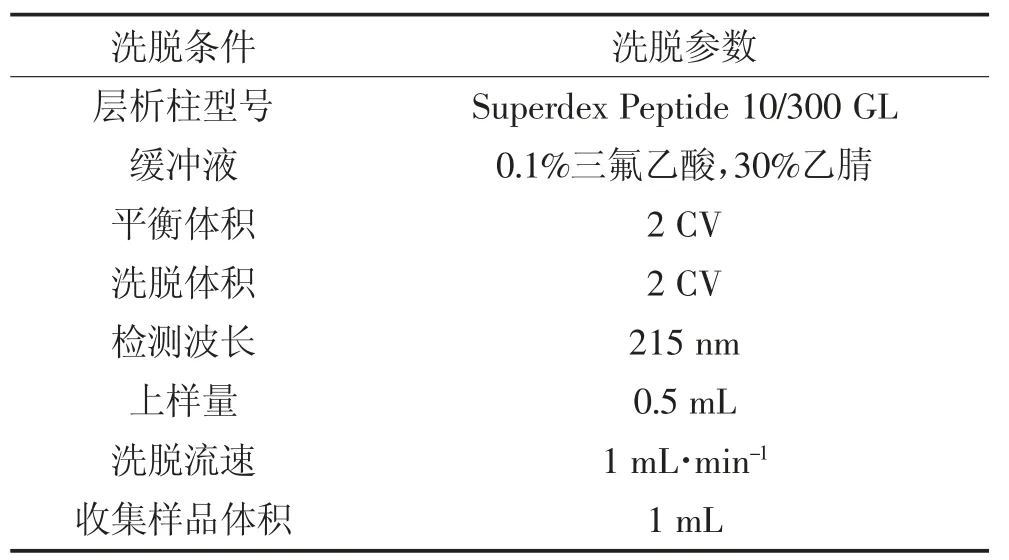
表2 凝胶过滤层析的纯化条件Table 2 The condition of Superdex Peptide
1.3.5 纯化后效价测定
采用相对抑菌效价法对菌株的抑菌活性进行检测[15]。相对效价值计算公式为:

x:每孔中待测细菌素的加样体积;
n:对指示菌出现抑菌圈状态的孔数[16]。
将104IU·mL-1的Nisin 标准液用0.02 mol·L-1HCl 依次稀释成等差梯度效价的标准溶液。图1 是细菌素效价标准曲线,R2等于0.994 2,线性较好,可用来计算植物乳杆菌素相对效价值[16]。
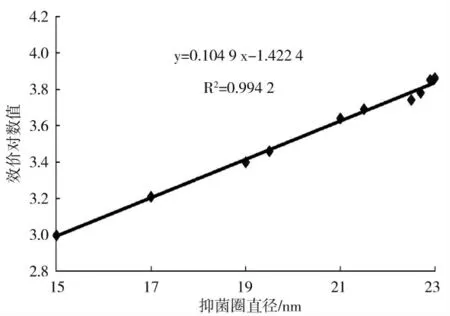
图1 Nisin 效价标准曲线Fig.1 The standard curve of Nisin
1.3.6 分子量的测定
采用双层琼脂扩散法,指示菌为金黄色葡萄球菌,对收集的各个组分分别进行抑菌性实验,冻干浓缩具有抑菌作用的样品液体,增大植物乳杆菌素样品液体浓度。冻干粉于适当蒸馏水稀释后,采用Tricine SDS-PAGE 凝胶电泳测定其分子量[17-19]。
1.3.7 HPLC 检测植物乳杆菌素的纯度
采用反相高效液相色谱(RP-HPLC)检测的植物乳杆菌素的纯度[20],色谱条件如表3 所示[21]:
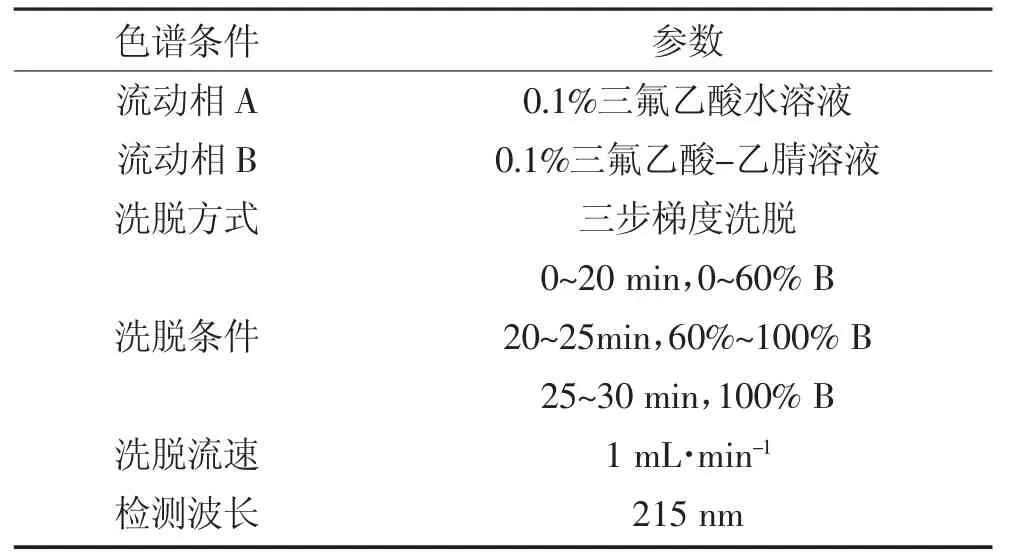
表3 RP-HPLC 的色谱条件Table 3 The condition of RP-HPLC
2 结果与分析
2.1 阳离子交换层析纯化植物乳杆菌素M1-UVs301
由图2 可见,经过SP Sepharose Fast Flow 层析柱的进一步纯化和分离,图谱上的蛋白吸收峰比较显著,说明在250~320 mL 收集的洗脱液活性突出,用牛津杯法处理收集的洗脱液验证抑菌功能。同时大量制备收集该谱段的活性组分,4 ℃保存,以备后续的分离纯化。
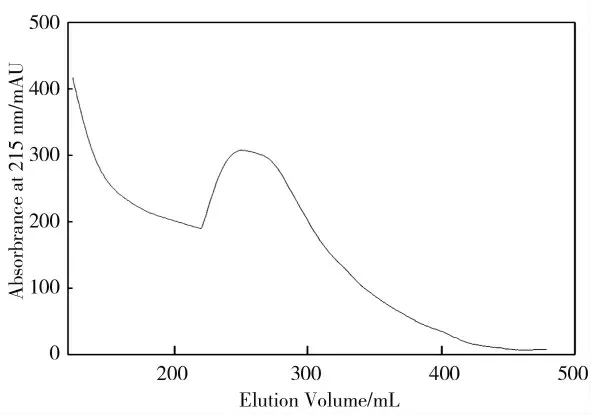
图2 SP Sepharose Flast Flow 纯化植物乳杆菌素M1-UVs301 的层析图谱Fig.2 The chromatogram of plantaricin purification on SP-Sepharose
2.2 Superdex Peptide 10/300 GL 纯化植物乳杆菌素
为提高植物乳杆菌素M1-UVs301 纯度,在经过初步纯化后,利用Superdex Peptide 10/300 GL 柱对其进行更高精度的纯化。由初期Tricne SDS-PAGE 结果可初步判定该细菌素的分子量在3.5~8.5 kDa 之间,而该凝胶肽柱可对分子量在0.1~7 kDa 之间的小肽进行纯化。由图3 可知,色谱图中出现两个蛋白吸收峰,一处在11~13 mL(较小),另一处在18~22 mL(较大),对收集的组分进行抑菌试验(牛津杯法),结果表明11~13 mL 之间收集的组分具有抑菌活性。将此区间内的蛋白超滤浓缩后,冷藏保存备用(4 ℃)。
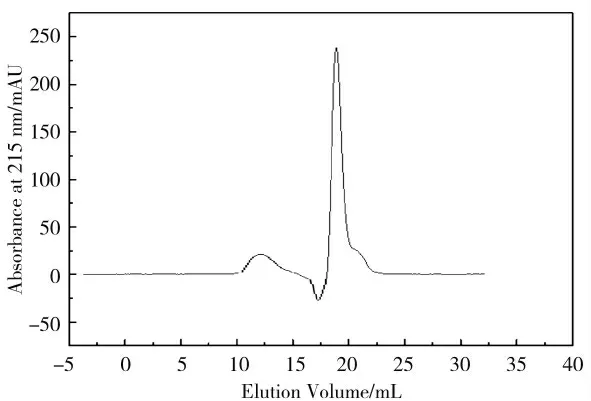
图3 Superdex Peptide 10/300 GL 纯化植物乳杆菌素M1-UVs301 色谱图Fig.3 The chromatogram of plantaricin purification on Superdex Peptide 10/300 GL
2.3 植物乳杆菌素M1-UVs301 纯化效价的测定
根据蛋白浓度曲线y=0.104 9 x+0.1.422 4(R2=0.994 2)可以得到原始样品和各部分纯化结果的蛋白含量,进而推测植物乳杆菌素M1-UVs301 在纯化过程中的变化如表4。经Superdex Peptide 10/300 GL柱纯化后植物乳杆菌素M1-UVs301 的比活力增加趋势显著[22],可高达26 122.4 AU·mg-1,证实了该种纯化方法比较适于植物乳杆菌素M1-UVs301 的纯化分析检测。但是纯化后的植物乳杆菌素M1-UVs301 产量上不高,下一步研究还需针对发酵条件参数的优化和影响发酵过程的条件的重新选择。
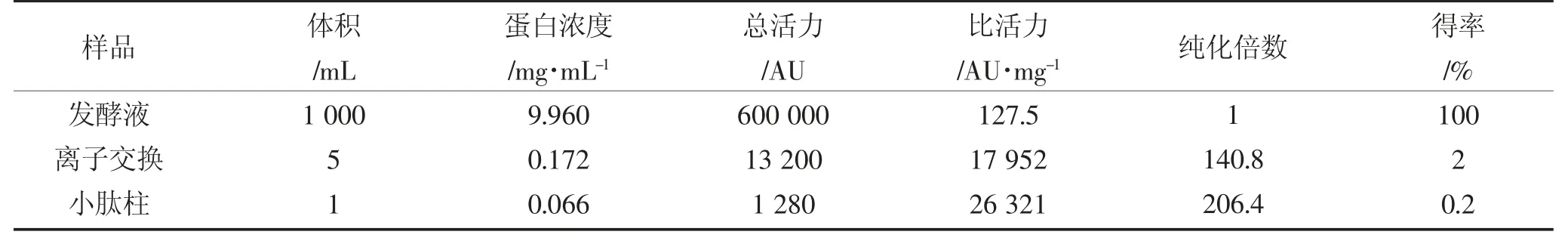
表4 植物乳杆菌素纯化表Table 4 Purification table of plantaricin
2.4 Tricine SDS-PAGE 检测植物乳杆菌素M1-UVs301 的蛋白分子量
采用Tricine SDS-PAGE 实验验证,经过多次纯化后得到的植物乳杆菌素M1-UVs301 的分子量及其纯度如图4,蛋白凝胶上的条带单一明显,并且在3.4 kDa 左右表现出明显的抑菌活性,表明所得样品纯度较好。
2.5 高效液相色谱检测植物乳杆菌素M1-UVs301的纯度
图5 为HPLC 色谱结果图。由图可知,样品出现蛋白吸收峰,最高峰出现在保留时间16.152 min 处,但仍可在最高峰附近观测到少许杂峰,这说明仍需对植物乳杆菌素M1-UVs301 进行更高精度的纯化,从而提高其纯度。大量研究也表明,纯化工艺中提取物纯度损失大,提取率低,仍是目前细菌素分离纯化的主要瓶颈。
2.6 植物乳杆菌素M1-UVs301 的氨基酸测定分析
氨基酸测定分析结果见表5。结果表明,植物乳杆菌素M1-UVs301 含有13 种氨基酸,其中缬氨酸(Val)、亮氨酸(Leu)、甘氨酸(Gly)等疏水性氨基酸占比较高,达到氨基酸总量的61.89%,证明植物乳杆菌素M1-UVs301 的疏水特性显著,与目前的相关研究结论保持一致。与此同时,疏水特性是维持和稳定蛋白质的高级结构直相关的特殊理化性质,还可以对其功能和性质产生直接的影响,所以也可推测细菌素的疏水特性和其抑菌机理息息相关。其余亲水性氨基酸占比为21.68%,且主要为在溶液中以正离子形式存在的碱性氨基酸,这也证实了植物乳杆菌素M1-UVs301 符合阳离子交换层析柱的纯化应用特性。还可看出在其氨基酸组成中还有其他未知种类氨基酸,这些均可对其抗菌特性造成影响。
2.7 植物乳杆菌素M1-UVs301 的二级结构测定分析
通过计算试验结果结合文献参考,酰胺I 带的谱峰指认研究存在程度较小的差异化。采用以下指认范围:α-螺旋出现于1 660 ~1 650 cm-1范围内;β-折叠出现于1 640~1 600 cm-1和1 670~1 690 cm-1范围内;β-转角出现于1 700~1 660 cm-1范围内;无序结构出现于1 650~1 640 cm-1范围内。其中去卷积二阶导数谱如图6 所示。植物乳杆菌素二级结构定量计算如表6 所示,其中β-折叠含量较高,说明分子间有较强的氢键作用。
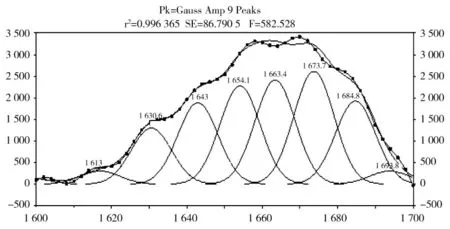
图6 酰胺Ι 带二阶导数谱和拟合计算谱Fig.6 Amide Ι with second derivative spectra and spectral fitting calculation

表6 植物乳杆菌素的二级蛋白结构定量计算Table 6 Quantitative calculation of the secondary structure of bacteriocins
3 结论
植物乳杆菌素M1-UVs301 阳离子交换层析柱分离纯化后,在250~320 mL 的收集液活性突出,精度纯化后在11~13 mL 的收集液具有显著抑菌活性。纯化后植物乳杆菌素M1-UVs301 比活力显著增加至26 321 AU·mg-1,蛋白凝胶上条带单一明显,在3.4 kDa 左右抑菌活性显著,表明阳离子交换层析柱对植物乳杆菌素的分离纯化效果显著。同时氨基酸及蛋白结构分析的结果表明,该植物乳杆菌素M1-UVs301 为一种疏水肽,二级结构中β-折叠含量较高,为该植物乳杆菌素的结构及功能特性研究提供数据支持及理论基础。

