鼠伤寒沙门菌伴侣蛋白Hfq 调控基因的筛选
潘 永,李 晨,杨 阳,刘丽娟,杨 琦,4*
(1.贵州大学 动物科学学院,贵州 贵阳 550025;2. 贵州省畜禽资源遗传管理站,贵州 贵阳 550025;3. 贵州大学 动物疫病研究所,贵州 贵阳 550025;4. 贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025;5. 都匀市农业农村局,贵州 都匀 558000)
鼠伤寒沙门菌(Salmonella typhimurium LT2,STM LT2)是肠道沙门菌中较为重要的一个血清型,因其感染宿主广泛且可引起人和动物严重的胃肠炎,长期以来给养殖业造成巨大经济损失。沙门菌的致病机制较复杂,如III 型分泌系统将超过30 种特化效应蛋白递送到宿主细胞中以破坏宿主细胞细胞骨架、信号转导途径、膜运输和促炎反应[1]。ABC 型超家族(ATP-binding cassette superfamily)转运蛋白包括寡肽转运蛋白(Oligopeptide permease,Opp)、二肽转运蛋白(Dipeptide permease,Dpp),它们行使功能需要在ATP 水解产生能量的情况下实现,在细菌生长、信号转导和趋化性上发挥重要作用。细菌的群体感应是细胞与细胞之间通信的过程,细菌通过产生、分泌和检测被称为自诱导物的细胞外信号分子来评估其种群密度,从而协调基因的表达。细菌ABC 转运通路以及群体感应通路与细菌的致病机制有着密切联系,而这种关系可能通过某些共表达基因联结[2-4]。
Hfq 是一种非编码小RNA 结合伴侣蛋白,在多种细菌中存在,并且在控制基因表达中起关键作用。Hfq 通过促进非编码小RNA 与其靶mRNA 的配对影响特定转录物的翻译和转换率来调控复杂的转录后网络。体内外实验证明hfq 基因的缺失导致鼠伤寒沙门菌的毒力、侵袭力、生长速度和运动力显著降低,Hfq 在多种细菌的致病机制、ABC 转运通路和群体感应的控制中扮演重要角色[5]。本实验室前期利用Hiseq 测序平台对鼠伤寒沙门菌LT2 hfq 缺失株进行转录组测序,结果发现对数期共516 个基因上调,539 个基因下调,稳定期共496 个基因上调,463 个基因下调[6]。由于基因数目较多且在对数期和稳定期转录水平的差异显著性相差较大,而细菌在不同的生长时期有着不同的调控活动,因此需对鼠伤寒沙门菌hfq基因敲除后不同时期转录水平差异表达的基因进行筛选。许多研究表明,依赖Hfq 发挥作用的sRNA 中,如主要调控细菌氨基酸摄取与合成相关基因表达的GcvB,当hfq基因敲除后,GcvB所调控的靶基因及Hfq 直接调控的靶基因在细菌不同生长期仍表现为相同趋势的差异表达[7-8],这为本研究筛选Hfq 调控的相关基因提供了理论前提。
本研究基于前期对指数生长期和稳定期的鼠伤寒沙门菌hfq 基因敲除株转录组测序的基础上,从筛选的差异表达基因中随机挑选6 个,利用荧光定量PCR 检测表达量,以此验证转录组数据可靠性,并在验证结果可靠的前提下分别将对数期和稳定期筛选为差异表达的基因注释到GO terms 细菌致病机制生物学过程以及Pathway 细菌ABC 转运通路和群体感应两大信号通路,以期筛选在对数期和稳定期均表现为差异上调或下调表达,疑似受sRNA 伴侣蛋白Hfq 所调控的基因。
1 材料与方法
1.1 主要实验材料野生型STM LT2 标准株(STM LT2 wild)由法国国家科学研究中心(CNRS)分子遗传学Bossi 实验室惠赠。STM LT2 hfq 基因缺失株(STM LT2 △hfq::cat)由 本 实 验 室 构 建。RNA 提 取 试 剂TRIzol、反转录试剂盒PrimeScriptTMII1st strand cDNA Synthesis Kit 以及荧光染料SYBR®Premix Ex TaqTMII(TliRNaseH Plus)均购自宝生物工程(大连)有限公司。
1.2 差异表达基因荧光定量PCR 检测将STM LT2 标准株和STM LT2 hfq 基因缺失株分别培养至对数 期(OD600nm≈0.4)和 稳 定 期(OD600nm≈2.0),利 用Trizol 试剂分别提取标准株和缺失株不同时期的总RNA,并将其反转录为cDNA,以其为模板,选择GAPDH 作为内参基因,参照文献[6]结果随机选取6个差异表达基因dppA、spaP、prgH、mgtC、eutH、invG,利用文献[6]中相应的6 对引物进行荧光定量PCR 扩增,反应条件为:95 ℃30 s;95 ℃5 s、60 ℃30 s,40 个循环。每个样本设3 个重复,样本数值按照2-ΔΔct法计算相关基因mRNA 转录水平,对比相应基因的转录组测序与荧光定量PCR 结果是否有一致性,若数据可靠则进行后续研究。引物均由上海英潍捷基公司合成。
1.3 GO 富集细菌致病机制生物学过程筛选Hfq 调控基因在转录组测序结果可靠的前提下,将前期分别在STM LT2 hfq 基因缺失株对数期和稳定期所筛选得到的差异表达基因通过注释GO terms 中的致病机制生物学过程(Pathogenesis,GO:0009405),筛选受Hfq 调控的基因,保留对数期和稳定期转录水平均差异上调或下调表达的基因数据。实验以STM LT2 标准株作为对照。
1.4 Pathway 富集细菌ABC 转运通路筛选Hfq 调控基因在转录组测序结果可靠的前提下,将前期分别在STM LT2 hfq 基因缺失株对数期和稳定期所筛选得到的差异表达基因通过KEGG 注释Pathway 富集细菌ABC 转 运 通 路(ABC transporters, Pathway ID:ko02010),筛选受Hfq 调控的基因。保留对数期和稳定期转录水平均差异上调或下调表达的基因数据。实验以STM LT2 标准株作为对照。
1.5 Pathway 富集细菌群体感应通路筛选Hfq 调控基因在转录组测序结果可靠的前提下,将前期分别在STM LT2 hfq 基因缺失株对数期和稳定期所筛选得到的转录水平差异表达基因通过KEGG 注释Pathway 富集细菌群体感应通路(Quorum sensing,Pathway ID:ko02024),筛选受Hfq 调控的基因。保留对数期和稳定期转录水平均差异上调或下调表达的基因数据。实验以STM LT2 标准株作为对照。
2 结 果
2.1 荧光定量PCR 验证结果从两组转录组数据中随机挑取6 个转录水平差异表达的基因dppA、spaP、prgH、mgtC、eutH、invG,用荧光定量PCR验证前期转录组数据的可靠性,结果显示,在STM LT2 hfq基因缺失株转录组测序结果中表现为对数期或稳定期转录水平表达上调或下调的基因,在荧光定量PCR结果中也出现相同趋势(表1)。表明前期的转录组测序数据可靠,可进行后续的实验研究。

表1 差异表达基因的荧光定量PCR 验证结果Table 1 Results of the real-time PCR for differentially expressed genes
2.2 GO 富集细菌致病机制生物学过程筛选Hfq 调控基因结果将分别在鼠伤寒hfq 基因缺失株对数期和稳定期所筛选得到的转录水平差异表达基因通过注释GO terms 中的致病机制生物学过程。结果显示,共筛选到28 个受hfq 基因缺失影响转录水平差异表达上调或下调的基因,差异表达倍数均在2 倍以上,占鼠伤寒沙门菌致病机制生物学过程相关基因的35%。除hfq 基因外,共筛选到13 个基因ydiV、STM1583、sifB、rpoE、hilA、spaS、spaP、invI、invB、invA、invG、invF 和mgtC 在对数期和稳定期转录水平均表达上调(图1),而稳定期转录水平普遍高于对数期。表明Hfq 调控鼠伤寒沙门菌的致病机制,13 个致病机制相关基因在鼠伤寒沙门菌对数期和稳定期均受Hfq 的负调控。
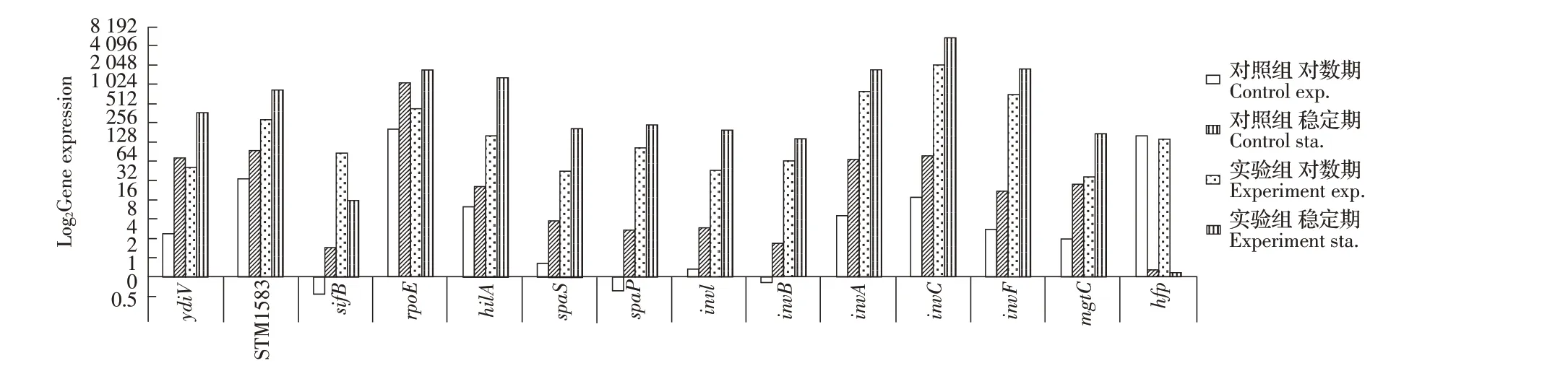
图1 细菌致病机制生物学过程相关基因的表达量Fig.1 Expression of genes related to bacterial pathogenesis
2.3 Pathway 富集细菌ABC 转运通路筛选Hfq 调控基因结果将分别在STM LT2 hfq 基因缺失株对数期和稳定期所筛选得到的转录水平差异表达的基因通过注释KEGG 数据库中的细菌ABC 转运通路。结果显示,总共筛选到95 个受hfq 基因缺失影响的转录水平差异表达上调或下调基因,差异表达倍数均在2 倍以上,占鼠伤寒沙门菌ABC 转运通路相关基因的52%,其中20 个基因STM1491、STM1492、STM1493、STM1494、STM1678、mppA、cbiO、cboQ、cbiM、ccmC、ccmB、ccmA、sitD、ugpB、pstC、pstS、malK、yabJ、potF 和ybjZ 在对数期和稳定期均受到不同程度的影响(图2)。其中在对数期和稳定期中转录水平差异表达趋势相同的基因,均上调的有yabJ、ybjZ、cbiO、cboQ、cbiM、ccmC、ccmB、sitD和ccmA 基因,均下调的有ugpB 和malK 基因。以上结果表明,Hfq 调控鼠伤寒沙门菌的ABC 转运系统,9 个ABC 转运通路相关基因在鼠伤寒沙门菌对数期和稳定期均受Hfq 的负调控,2 个ABC 转运通路相关基因在鼠伤寒沙门菌对数期和稳定期均受Hfq 的正调控。

图2 细菌ABC 转运通路相关基因的表达量Fig.2 Expression of genes related to bacterial ABC transport pathway
2.4 Pathway 富集细菌群体感应通路筛选Hfq 调控基因结果将分别在STM LT2 hfq 基因缺失株对数期和稳定期所筛选得到的转录水平差异表达基因通过注释KEGG 数据库中的细菌群体感应通路。结果显示,共筛选到31 个受hfq 基因缺失影响的转录水平差异表达上调或下调基因,差异表达倍数均在2 倍以上,占鼠伤寒沙门菌群体感应通路相关基因的46%,其中有5 个基因yjeM、STM1678、yaeL、hfq 和mppA 在对数期和稳定期均受到不同程度的影响(图3)。除hfq 基因转录水平表达均下调外,yjeM 和yaeL基因均上调。结果表明,Hfq 调控鼠伤寒沙门菌的群体感应通路,2 个群体感应通路相关基因在鼠伤寒沙门菌对数期和稳定期均受Hfq 的负调控。

图3 细菌群体感相关基因的表达量Fig.3 Expression of genes related to bacterial quorum sensing
3 讨 论
关于细菌RNA 结合蛋白在转录后调控基因表达的研究正变得越来越重要。由于Hfq 普遍存在于各种细菌中,调控机理复杂且尚未研究透彻,筛选可能性最大的靶基因对后续鉴定成功率具有助推意义。本研究通过荧光定量PCR 对随机挑选的6 个差异表达基因进行表达量的检测,检测结果与RNA-seq 结果相比,在表达量上存在一定差别,但这种差别是整体性的降低或升高,表明荧光定量PCR 检测更加灵敏,产生这种现象的原因可能是由于转录组测序仪器的敏感性较低所致,而qRT-PCR检测结果中各差异表达基因间的相对上调或下调趋势与RNA-seq 结果完全相同,证明本次转录组数据可靠,可用于进一步的分析。
本研究分别从3 个方面筛选到除Hfq 外在两个时期均出现差异表达的基因共37 个,细菌致病机制生物学过程中除Hfq 表达下调外,其它13 个基因ydiV、STM1583、sifB、rpoE、hilA、spaS、spaP、invI、invB、invA、invG、invF 和mgtC 呈现上调趋势,其中有一半以上基因参与沙门菌III 型分泌系统(T3SS)核心结构-针状复合体装置蛋白和效应蛋白的形成,主要由SPI-1 和SPI-2 基因编码,负责调节病原菌中的毒力蛋白输出,由此推测Hfq 在正常情况下可能对STM LT2 III 型分泌系统(T3SS)相关毒力基因的表达活动进行负调控,并且稳定期表达量普遍高于对数期,这种情况不排除细菌处于对数生长期时优越的环境及营养条件信号促使细菌抑制致病机制生物学活动。也可能归因于Hfq 在稳定期细菌受外界环境压力时受到抑制作用并且激发应对外来干扰的机制[9]。ABC 转运通路中共筛选到20 个基因,其中有11个基因在两个时期均表现为统一上调或下调,均表达上调的有yabJ、ybjZ、cbiO、cboQ、cbiM、ccmC、ccmB、sitD 和ccmA 基因,其中值得关注的是参与细菌I 型细胞色素成熟系统(CCM)的基因ccmA、ccmB 和ccmC,它们执行一种或多种对细菌生理学和生长至关重要的功能,包括铁载体产生和利用,以及铜敏感性和锰氧化的改变等[10],它们可能受到Hfq 的抑制作用,均下调的有ugpB 和malK基因,ugpB 在结核分枝杆菌中发现其介导周质空间中sn-甘油-3-磷酸(G3P)或甘油磷酸胆碱(GPC)分子的隔离,属于ABC 转运超家族成员[11],malK 在鼠伤寒沙门菌中编码麦芽糖ABC 转运蛋白参与ATP 水解的亚基,Hfq 可能参与它们表达的正向调控。其余9 个 基 因potF、STM1491、STM1492、STM1493、STM1494、pstC 和pstS 先 上 调 后 下 调,STM1678 和mppA 基因先下调后上调,这种差异的产生怀疑受调控的因子不仅仅局限于Hfq 蛋白,Hfq 可能仅参与间接作用或不参与调控,这些基因可能在细菌响应外界环境胁迫信号后通过其它机制进行调节[12]。群体感应通路中,筛选到4 个共表达基因,其中yjeM 和yaeL 基因均表现为上调,yjeM 是推定的APC 家族氨基酸转运蛋白,目前对其研究较少,在霍乱弧菌中发现yaeL 编码的蛋白酶能够降解毒力激活剂TcpP 蛋白从而影响细菌毒力[12]。
此前有相关研究应用高通量焦磷酸测序技术(HTPS)对STM LT2 hfq 基因缺失株进行转录组测序分析,结果发现,Hfq 是一种影响近五分之一沙门菌基因表达的全局调节因子,缺失造成279 个基因上调,455 个基因下调[13]。与之对比,本研究筛选到的26 个可疑基因中有11 个基因ydiV、STM1583、mgtC、 cbiO、 cboQ、 cbiM、 ccmC、 ccmB、 ccmA、malK 和yjeM 未见其报道,产生这种差异的原因可能与测序平台的选择或筛选方式等其它因素有关[14]。11 个可疑基因中有5 个基因目前未见与Hfq 相关研究,包括编码细菌细胞质蛋白为沙门菌在小鼠脾脏定植所需的STM1583 基因,存在于沙门菌SPI-2 毒力岛;沙门菌在镁缺乏培养基和巨噬细胞中存活起关键作用编码Mg2+转运蛋白的mgtC 基因,由沙门菌SPI-3 毒力岛携带[15];与钴转运蛋白相关的cbiO 和cboQ 基因以及编码推定的APC 家族氨基酸转运蛋白的yjeM 基因,5 个基因均参与沙门菌的毒力及生长活动。
本研究对敲除hfq 基因的STM LT2 对数期和稳定期转录组测序结果进行再分析,从众多差异表达基因中筛选到与细菌致病机制生物学过程以及ABC 转运通路和群体感应相关差异表达基因26 个,它们分别在细菌对数期和稳定期表现同一趋势的上调或下调,并预测其受sRNA 伴侣蛋白Hfq 调控,为后期验证试验以及sRNA 伴侣蛋白Hfq 对鼠伤寒沙门菌调控机理的下游研究奠定基础,并提供了参考数据。

