肠激安方对IBS-D模型大鼠脾虚泄泻及miRNA-29a表达的影响
祝赫 石玉莹 吴映秀 肖茜 唐洪梅
腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D)是一种慢性肠病,属于中医“泄泻”“腹痛”“郁证”范畴,主要症状为反复发作的腹胀、腹痛、腹泻。“脑-肠”轴异常、“神经-内分泌-免疫”系统紊乱是主要的发病机制,发病因素涉及饮食、心理、肠道菌群等。中医理论认为,肠易激综合征的病位在肠,以脾虚为本,症候属脾胃。以中医“健脾止泻”思想组方的肠激安方为广州中医药大学第一附属医院名老中医长期用于治疗IBS-D的临床验方,由四君子汤、痛泻要方加减化裁而来,具有益气健脾、止痛止泻之功效,治疗IBS-D临床疗效确切。
MicroRNAs (miRNAs)是长度为18~25个核苷酸的一类内源性的非编码的小分子RNA,对疾病的发生发展具有“多途径”“多靶点”作用特点,与中医理论整体观有一定的趋同性,现代研究证实miRNA可以作为中药发挥作用的介导因子,中药可能选择性地通过作用于多个miRNA及其转录因子-靶基因,调控细胞功能改变和疾病治疗网络,从而发挥复杂的生物学作用。近期有研究发现miRNA-29a作为肠道通透性的关键调控基因,可以通过靶基因调节肠道上皮屏障功能的完整性[1]。
IBS-D发病机制复杂多样,课题组前期采用三因素结合的方法,成功制备了病证结合的IBS-D大鼠模型。本研究拟基于miRNA-29a,探讨肠激安方对IBS-D模型大鼠的干预途径和作用机制,为肠激安方的临床使用提供理论依据。
1 材料与方法
1.1 实验动物
SPF级新生SD大鼠,由广州中医药大学实验动物中心提供[许可证号SCXK(粤):2013-0034]。哺乳期母鼠和乳鼠同窝饲养于高压灭菌木屑垫料的大鼠专用饲养笼中。保持昼夜明暗交替12 h/12 h,噪音≤60 dB,饲养环境温度20~25℃,相对湿度控制在50%~70%,实验动物自由进食进水,实验动物饮用水为高压灭菌纯净水。动物实验地点:广州中医药大学第一附属医院实验动物中心[SYXK(粤):2013-0092]。按3R原则对实验动物给予人道关怀。
1.2 主要药物与试剂
肠激安方中药饮片由康美药业生产,购自广州中医药大学第一附属医院,经广州中医药大学第一附属医院药检室鉴定。肠激安方药物组成:茯苓20 g、甘草6 g、陈皮5 g、石榴皮30 g、黄连5 g、白芍15 g、土白术15 g、枳壳10 g、延胡索10 g、乌梅15 g、防风15 g、柴胡10 g、黄芪15 g。匹维溴铵(规格:50 mg,法国Abbott Healthcare SAS, 批号:6400156)。苏木素(ZLI-9615)购自于北京中杉金桥公司;miRcute miRNA提取分离试剂盒(离心柱型)(DP501)、MiniBEST Universal RNA Extraction Kit(9767)、miRcute miRNA cDNA第一链合成试剂盒(KR201)、miRcute miRNA荧光定量检测试剂盒(FP401)均购于日本Takara公司;大鼠二胺氧化酶(diamine oxidase,DAO)酶联免疫试剂盒(AE90824Ra)、大鼠D-乳酸(D-LA)酶联免疫试剂盒(AE91431Ra)购于上海AMEKO公司。
1.3 主要仪器
各规格微量移液器(美国Thermo);多功能酶标仪(美国Thermo,1510);PCR逆转录仪(美国Bio-rad,型号:T100);荧光定量PCR仪(美国Bio-rad,CFX96);37℃恒温箱(上海一恒科技,DHP-9162);TGrinder电动组织研磨器(北京TIANGEN,OSE-Y40);MagNA Lyser Green Beads(美国Roche,03358941001)
1.4 肠激安水煎液制备
按处方称取药材,4倍量水浸泡30分钟,大火煎煮40分钟,滤过,药液备用,再加3倍量水煎沸后小火煎煮30分钟,滤过后合并两次滤液,60℃,浓缩至生药含量为1.67 g/mL。按照用药时给药剂量配成高、低两个浓度。
1.5 动物模型的制备
采用三因素(母婴分离+醋酸刺激+束缚)结合的方法,复制大鼠IBS-D模型。取新生SD大鼠,从出生第2~14天,将乳鼠和母鼠分开,每日3小时,每日一次。第15~27天,将润滑后的导尿管(内径1mm)经肛门插入2 cm,注入0.087 mol/L的醋酸,醋酸起始用量为0.2 mL,每两天增加0.1 mL,从第21天开始保持醋酸用量为0.5 mL,每天对大鼠进行醋酸直肠刺激一次。在直肠刺激结束后,立即用扎线带将大鼠上肢束缚1小时,不限制大鼠活动,但限制上肢搔抓面部。从第27天起,正常饲养2周,不进行任何干预性操作。
1.6 IBS-D模型的评价
造模结束后,通过粪便含水量以及腹部回缩反射(abdominal withdrawal reflex,AWR)评分进行模型评价。参照文献方法[2],AWR评分进行模型评价。将8F双腔导尿管表面均匀涂抹医用螯合剂,插入大鼠肛门深约8 cm处,用医用胶带固定,不限制大鼠的自由活动。当大鼠适应环境后,用一次性注射器向导尿管腔内注入1.5 mL空气,观察大鼠的5分钟内的活动情况,记录AWR评分。实验重复3次。评分≥2分可视为模型复制成功。
1.7 分组给药及糖水偏好值检测
将造模成功的大鼠按随机数字表法分为4组,每组8只,按人和大鼠间体表面积折算的等效剂量比值换算临床等效剂量,分别为IBS-D模型组、肠激安方低剂量组(16.74 g生药/kg)、肠激安方高剂量组(33.48 g生药/kg)、阳性药(匹维溴铵)组(18 mg/kg)。另设空白组8只。每天灌胃1次,连续14天。参考文献方法测定大鼠的糖水偏好值,给药结束后,各组大鼠禁水禁食24小时,每组分别给予1%的蔗糖水和纯水各200 mL,24小时后使用量筒分别测量蔗糖水和纯水的消耗体积。糖水偏好值=糖水摄取量/(糖水摄取量+纯水取量)×100%。
1.8 样品处理及指标检测
各组大鼠给药结束后,异氟烷麻醉。使用EDTA采血管从腹主动脉取血,静置1小时后,2000 rpm离心10分钟,用移液枪吸取上层血浆分装,放置于-20℃冰箱备用;使用医用手术刀快速截取远端结肠6 cm,使用预冷的生理盐水清洗至无异物,迅速将结肠分为等长的3段,一段浸泡于4%多聚甲醛溶液中,用于病理检测;另两段结肠组织分别置于冻存管中,液氮速冻,再转移至-80℃超低温冰箱保存,用于基因和蛋白的检测。
1.8.1 ELISA法测定大鼠血浆中DAO和D-LA的含量 实验结束前1天,大鼠禁食12小时,不禁水,次日用异氟烷麻醉,腹主动脉取血,室温静置约1小时,2000 rpm离心10分钟,分离制备血浆,采用移液器将血浆分离并分装于离心管中,放置于-20℃冰箱保存备检测用。采用ELISA法检测血浆中DAO和D-LA含量。测定方法和步骤按试剂盒的说明书要求进行。根据标准品的浓度对应的OD值,在Excel中计算出标准曲线直线回归方程,再根据样品的OD值通过直线回归方程计算对应的样品的浓度。
1.8.2 病理检测 (1)制作组织蜡块:将结肠组织在4%多聚甲醛中固定48小时,依次在70%乙醇、80%乙醇、85%乙醇、90%乙醇、95%乙醇、100%乙醇、低熔点石蜡、高熔点石蜡中各1小时。按程序在自动包埋机中包埋,室温保存待用。(2)石蜡组织切片:将组织蜡块固定于切片机固定槽内,以20 μm厚度修片,然后调整切片机厚度为4 μm。以毛笔卷起蜡片,放置于50℃温水中展片,待蜡片完全展开后,用防脱载玻片迅速捞出,并将其放置于37℃过夜,第二天取出置于65℃烘箱中烤片1小时,用于病理观察和免疫检测。(3)HE染色:石蜡组织切片依次置于二甲苯、无水乙醇中各20分钟,95%乙醇、85%乙醇各10分钟,1×PBS洗3次,每次5分钟。苏木精染色3分钟。PBS洗3次,每次5分钟。伊红染色1分钟。最后自来水冲洗2小时,取出,常规脱水,透明,封片,最后置于镜下观察,图像采集分析。
1.8.3 RT-qPCR法检测结肠组织中miRNA-29a相对含量 miRNA-29a引物序列由上海生工生物采用加尾法设计合成Forward: gcgTAGCACCATCTGAAATCGGTTA。从-80℃冰箱中取出结肠黏膜标本,在冰上解冻后,将其放置于一次性灭菌塑料培养皿上,按照说明书操作,加入RNA裂解液,使用组织匀浆器,将组织在冰上充分研磨,按说明书步骤提取结肠黏膜总RNA,取1 μL样本进行RNA纯度检测,A260/A280在1.7~2.0方可进入逆转录过程。用逆转录所得的cDNA做模板,进行RT-PCR扩增,采用 Comparative Delta-delta CT法。逆转录反应条件:PCR仪37℃反应60分钟。合成的cDNA置于-20℃保存。PCR扩增条件:起始模版变性:94℃ 2分钟;PCR循环中模板变性94℃ 20秒,退火,延伸:60℃ 34秒,共40个循环。扩增结果用CT值表示,以U6作为内参基因,通过2-△△CT法计算基因的相对表达。
1.9 统计学处理
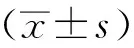
2 结果
2.1 各组IBS-D大鼠一般行为情况比较
空白组大鼠的毛色洁白光泽,活泼好动,精神状态良好。模型组大鼠精神萎靡,肛门周围污秽,第7日起开始出现腹泻,呈黄色稀便样。造模结束后,各造模组大鼠精神萎靡不振,毛发散乱无光泽、扎堆在角落、静卧少动,体重减轻。给药2周后,匹维溴铵组、肠激安方高剂量组、肠激安方低剂量组大鼠的上述症状得到不同程度的改善。与空白组比较,模型组大鼠的体重明显降低(P<0.05);与模型组比较,匹维溴铵组、肠激安高剂量组、肠激安低剂量组的体重升高(P<0.05)。如表1所示。

表1 各组IBS-D大鼠体重比较
2.2 各组IBS-D大鼠内脏敏感性AWR评分比较
与空白组比较,模型组AWR内脏敏感性评分显著升高(P<0.05);与模型组比较,匹维溴铵组、肠激安方高剂量组、肠激安方低剂量组AWR评分降低(P<0.05)。如表2所示。

表2 各组IBS-D大鼠内脏敏感性AWR评分比较
2.3 各组IBS-D大鼠糖水偏好值和粪便含水量比较
与空白组比较,模型组大鼠的糖水偏好值显著降低(P<0.05);与模型组比较,匹维溴铵组、肠激安方高剂量组、肠激安方低剂量组大鼠的糖水偏好值升高(P<0.05)。与空白组比较,模型组大鼠的粪便含水量显著升高(P<0.05);与模型组比较,匹维溴铵组、肠激安方高剂量组、肠激安方低剂量组大鼠的粪便含水量显著降低(P<0.05)。如表3所示。

表3 各组IBS-D大鼠糖水偏好值与粪便含水量比较
2.4 各组IBS-D大鼠结肠组织病理学观察
在光学显微镜观察下,各组大鼠的结肠黏膜上皮呈单层柱状,固有层为黏膜肌层,结肠黏膜腺体形态及大小正常,结肠黏膜间质内无炎性细胞浸润,浆膜层未见水肿及糜烂或溃疡,结肠组织形态学无明显病理变化,提示模型组大鼠结肠黏膜处未有明显的器质性病变。如图1所示。
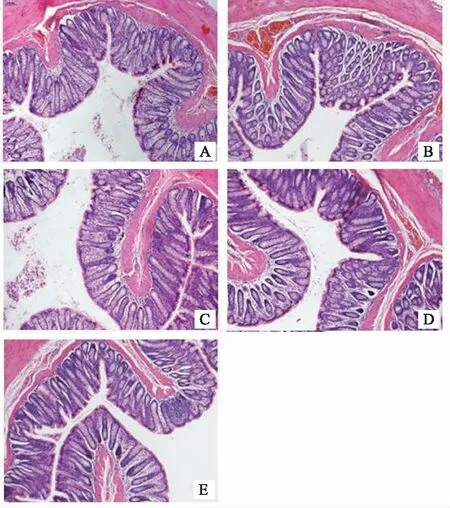
注:A正常组; B模型组; C匹维溴铵组; D肠激安方高剂量;E肠激安方低剂量组。
2.5 各组IBS-D大鼠血浆中D-LA和DAO的含量比校
与空白组比较,模型组血浆中D-LA和DAO的含量升高(P<0.05);与模型组比较,匹维溴铵组、肠激安方高剂量组、肠激安低剂量组血浆中D-LA、DAO含量明显降低(P<0.05)。如表4所示。

表4 各组IBS-D大鼠血浆中D-LA和DAO的含量比较
2.6 各组IBS-D大鼠结肠组织中miRNA-29a的相对含量比较
与空白组比较,模型组大鼠结肠组织中miRNA-29a的相对含量升高(P<0.05);与模型组比较,匹维溴铵组、肠激安方高剂量、肠激安方低剂量组大鼠结肠组织中miRNA-29a的相对含量降低(P<0.05)。如表5所示。
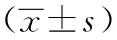
表5 各组IBS-D大鼠结肠组织中miRNA-29a的相对含量比较
3 讨论
IBS-D属于中医“泄泻”“腹痛”“郁证”范畴,《素问·脏气法时论篇》言:“脾病者,虚则腹痛、肠鸣、飧泄、食不化。”《景岳全书·泄泻》亦言:“泄泻之本,无不由于脾胃。”湿邪困厄脾阳,脾运化功能失常,湿热内蕴,导致泄泻,久泻则脾虚;脾胃为后天之本,脾之运化失常而寒湿停滞,湿阻气滞引为腹痛;素体虚弱,或长期饮食不节,或情志失调,或久泻伤正,以致脾胃亏虚,升运无权,则发生泄泻[3]。脾失健运,则不能制水,湿注肠道,造成脾虚泄泻,是肠道通透性增加的内在病因,因此对IBS-D当健脾化湿,涩肠止泻。
课题组前期研究发现,肠激安方可调节IBS-D大鼠的神经递质、胃肠激素的功能,可显著改善IBS-D肠道敏感性水平。匹维溴铵是对胃肠道具有高度选择性解痉作用的拮抗剂,临床上主要用于治疗与肠道功能紊乱有关的疼痛、排便异常、肠道不适及胆道功能紊乱有关的疼痛,其能改善IBS内脏高敏感模型大鼠抬腹阈值、P物质、局部肠组织中降钙素基因相关肽和促肾上腺皮质激素释放因子等受体的表达,其疗效和作用机理与本实验研究方向相符,故选用匹维溴铵作为阳性对照药[4]。
IBS-D目前被认为属于功能性肠病,因其病因和病机尚未完全阐明,所以IBS-D动物模型的复制存在一定的局限性,目前IBS的模型复制思路主要包括模拟IBS的病因和IBS的某一病理生理机制,故多根据一个因素或一种机制建立[5-6],主要分为以下几类:精神应激:束缚应激模型、游泳致疲劳模型、慢性激怒模型;炎症:病原体炎症、化学炎症动物模型;神经-内分泌失调;早期生活事件;结、直肠刺激。课题组基于IBS-D复杂的病理机制和发病因素,从中医病证结合的角度,成功利用了母子分离+醋酸灌肠+束缚应激三因素法复制IBS-D大鼠模型[7]。
IBS-D内脏敏感性评估结果显示,模型组大鼠AWR评分明显高于正常组,表明模型组大鼠的内脏敏感性与正常组比较明显升高,结合粪便含水量结果,表明IBS-D模型复制成功。通过药物干预后,肠激安方高剂量、肠激安方低剂量组大鼠AWR评分降低,提示肠激安方具有降低IBS-D大鼠内脏敏感性的作用。
血液中DAO和D-LA的含量是评价肠道屏障功能的标志物。DAO主要位于肠道黏膜绒毛中,正常生理状态下血浆中DAO含量较低,当肠黏膜屏障功能受损、通透性增加时,DAO从破损的细胞中释放出来,导致血液中DAO含量升高[8]。D-LA是肠道菌群代谢产物,正常生理状态下血液中D-LA含量较低,当肠黏膜损伤、通透性增加后,D-LA通过受损的肠上皮细胞和紧密连接进入血液,导致血液中D-LA的含量升高[9]。本研究结果表明,IBS-D模型大鼠的血浆中DAO和D-LA的含量均显著升高,提示IBS-D大鼠屏障功能受损,肠道通透性增加。当给予肠激安方干预后,各组大鼠血浆中DAO和D-LA的含量都有所下降,提示肠激安方可改善IBS-D大鼠肠道屏障功能。另有文献报道[10],肠道通透性和内脏高敏之间存在着正向调控的关系,并且共同参与了IBS-D的病理机制,但通过对本研究结果的统计分析,并没有发现二者明显的关联性,其原因可能与AWR评分主观性较大和样本量不足有关,后续研究将采用肌电图等相对更为准确的评价方案来评估肠道敏感性的变化情况,以分析三因素法IBS-D模型大鼠肠道敏感性和屏障功能受损后肠道通透性增加之间的关系。
miRNA在各种疾病中扮演着重要的角色,不同miRNA在不同疾病组织的表达水平有显著差异,在肿瘤[11]、心血管疾病[12]、神经疾病[13]及自身免疫性疾病[14]中通过调控靶基因的表达,参与疾病的生理病理过程。近期研究表明中药复方可通过对miRNA的调控,进而影响疾病的关键基因,如肿瘤、肾病、消化道疾病等。中药复方或中药的活性成分可以特异性作用于单个或多个miRNA,特定的miRNA也可能同时调控疾病相关基因,这种复杂的调节关系符合中医对疾病的认识,可以更加精确地对中药复方的作用机制进行拓展和深化。
miRNA-29包括miRNA-29a、miRNA-29b和miRNA-29c三种成熟序列,在小肠、结肠黏膜、血液微泡均有稳定高表达,并已初步证明miRNA-29a可以通过干预位于谷氨酰胺合成酶基因3’端的序列结合位点,从而调节肠道上皮屏障功能的完整性[1]。有研究发现,miRNA-29可抑制紧密连接蛋白-1和核转录抑制因子的表达,从而增加肠道的通透性[15]。本实验结果表明,IBS-D模型大鼠结肠黏膜屏障功能损伤,AWR评分、肠道通透性升高,结肠组织中miRNA-29a的表达水平降低;肠激安方高、低剂量干预后,结肠黏膜的屏障损伤情况在一定程度上有所改善,AWR评分、肠道通透性降低,miRNA-29a表达水平升高。结果提示,IBS-D肠道通透性升高和内脏高敏感性的病理机制可能与miRNA-29a的调控有关,肠激安方可能通过对miRNA-29a的调控从而减轻IBS-D大鼠肠道高通透性和内脏高敏感性的病理状态,改善IBS-D症状。本实验是对miRNA-29a与IBS-D关系的初步研究,miRNA的生物学功能复杂,肠激安方对miRNA-29a及靶基因的调控作用及其靶基因与IBS-D病理机制的关系还需要进一步探讨。

