清热解毒扶正颗粒对PI3K/Akt/NF-κB信号通路的影响
韦衮政 韦莽 万启南 李琼锋 祁燕 李帅 崔彧
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是一种严重危害人类健康的常见病、多发病,是一种以持续气流受限为特征的气道与肺部疾病,与气道和肺组织对烟草烟雾等有害气体或有害颗粒的慢性炎症反应增强有关,以肺实质的破坏和气道炎症为主要病理特征[1]。蛋白激酶B(protein kinase B,Akt)是磷脂酰肌醇-3-激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)信号通路中的关键信号转导分子。当PI3K被氧化应激、生长因子等细胞表面受体激活后,并最终导致Akt的活化[2-4],从而激活或抑制其下游靶蛋白如转录核因子κB(nuclear factor-κB,NF-κB)等,导致炎症的级联反应[5]。PI3K/Akt信号通路可通过调控炎性介质释放、炎症细胞活化及气道重构等参与COPD气道炎症反应过程。清热扶正颗粒是在中医的整体观念指导下,从整体上把握疾病“证”的变化,制定出以扶正祛邪为治疗原则,以清热解毒、凉血化瘀、益气养阴为治法的复方中药制剂,对炎症性疾病有较好的疗效[6-7]。本实验从PI3K/Akt/NF-κB信号通路探讨清热扶正颗粒对COPD的部分作用机理。
1 材料与方法
1.1 实验动物
两月龄Wistar大鼠90只,体重(200±20) g,购自成都达硕实验动物有限公司。动物生产许可证号:SYXK(滇)K2013-007。
1.2 动物分组与造模
用随机数字表法将90只大鼠随机分为6组,即正常对照组、模型组、清热解毒扶正颗粒低剂量组、清热解毒扶正颗粒中剂量组、清热解毒扶正颗粒高剂量组、阿奇霉素组。
除正常对照组外,其他各组大鼠置于1 m×1 m×1 m的烟室中,香烟(焦油量约为12 mg,烟气烟碱量约为1.1 mg,约烧50支香烟)烟熏,每日30分钟(气管内注射当日停止烟熏)。第1和14天将其仰卧位固定在老鼠板上,固定四肢、头部,用开鼻器撬开动物口,将舌轻轻拉出,压迫舌腹,暴露喉头,在电子支气管镜注视下,趁动物吸气的瞬间,迅速将与1 mL注射器相连的针头9号腰穿针插入气管,约达气管分叉处,缓慢注入脂多糖内毒素(lipopolysaccharide,LPS)200 μg/200 μL,正常对照组气管内用药当日注入等量的生理盐水(200 μL)。烟熏连续28天。
1.3 供试药品
清热解毒扶正颗粒成人处方:翼首草30 g、荷叶顶15 g、连翘15 g、鱼腥草30 g、 柴胡10 g、 葛根15 g、芦根15 g、太子参30 g、麦冬10 g、生地30 g、知母15 g、牡丹皮15 g、薏苡仁30 g、甘草10 g组成。由云南省中医医院制剂中心按方案配制成颗粒。阿奇霉素片由上海天龙药业有限公司提供。
1.4 动物给药
清热解毒扶正颗粒低、中、高剂量组,分别给予清热解毒扶正颗粒(相当于生药量)1.87 g/mL、3.74 g/mL、7.48 g/mL;阿奇霉素组给予3.4 mg/mL;模型对照组及正常对照组给予生理盐水,用量均按1 mL/100g鼠重灌胃,每天2次,连续28天。
1.5 实验试剂
TNF-α ELISA 试剂盒(批号:20190318A)、MMP-9 ELISA 试剂盒(批号:20180318B)、TIMP-1 ELISA 试剂盒(批号:20180318C)由江苏卡尔文生物科技有限公司提供。Phospho-Akt抗体(货号:4060)、Phospho-NF-κB-1抗体(货号:4806)由美国CST公司提供,Phospho-PI3K抗体(货号:ab182651)由abcam公司提供。
1.6 实验仪器
ABI 7900 Real-time PCR仪(美国ABI公司),BIORAD 电泳仪(美国BIO-RAD公司),超微量核酸蛋白检测仪(北京众力挽生物科技有限公司),美国EPOCH酶标仪。
1.7 Elisa检测
设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔先加待测样本10 μL再加样本稀释液40 μL;除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37℃水浴恒温箱温育60分钟。弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1分钟,重复洗板5次。每孔加入底物A、B各50 μL,37℃避光孵育15分钟。加入终止液50 μL,15分钟内,在450 nm波长处测定各孔的OD值。依据曲线方程计算各样本浓度值。
1.8 Western Blot检测
各组取20 μL蛋白样品及对照蛋白,10%SDS-PAGE电泳(60V~120V);90V转膜1.5小时,将分离胶上的蛋白样品转移至硝酸纤维素薄膜上,剪下目的蛋白条带,放入封闭液(5%脱脂奶粉)中室温封闭1小时;加入对应一抗,于脱色摇床上4℃摇摆过夜;TBST溶液反复洗膜5次,每次5分钟,然后加入二抗孵育,脱色摇床上室温轻摇60分钟;TBST溶液反复洗膜5次,每次5分钟。最后于Odyssey CLx红外荧光扫描成像系统检测蛋白表达。
1.9 统计学方法
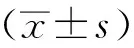
2 结果
2.1 血清TNF-α、MMP-9、TIMP-1水平
通过ELISA检测,造模后大鼠血清的TNF-α、TIMP-1、MMP-9均不同程度的升高,与空白对照组相比较,TNF-α、MMP-9升高有显著性差异(P<0.05),TIMP-1升高无显著性差异(P>0.05)。经清热解毒扶正颗粒灌胃治疗后,大鼠血清的TNF-α、TIMP-1、MMP-9均不同程度的降低,与模型组相比较,清热解毒扶正颗粒低、中、高剂量组显著降低TNF-α水平(P<0.01);清热解毒扶正颗粒中剂量组显著降低TIMP-1水平(P<0.01),清热解毒扶正颗粒高剂量组显著降低TIMP-1水平(P<0.05),清热解毒扶正颗粒低剂量组降低TIMP-1水平不显著(P>0.05);清热解毒扶正颗粒低、中、高剂量组降低MMP-9水平不显著(P>0.05)。见表1。

表1 各组大鼠血清TNF-α、MMP-9、TIMP-1水平比较
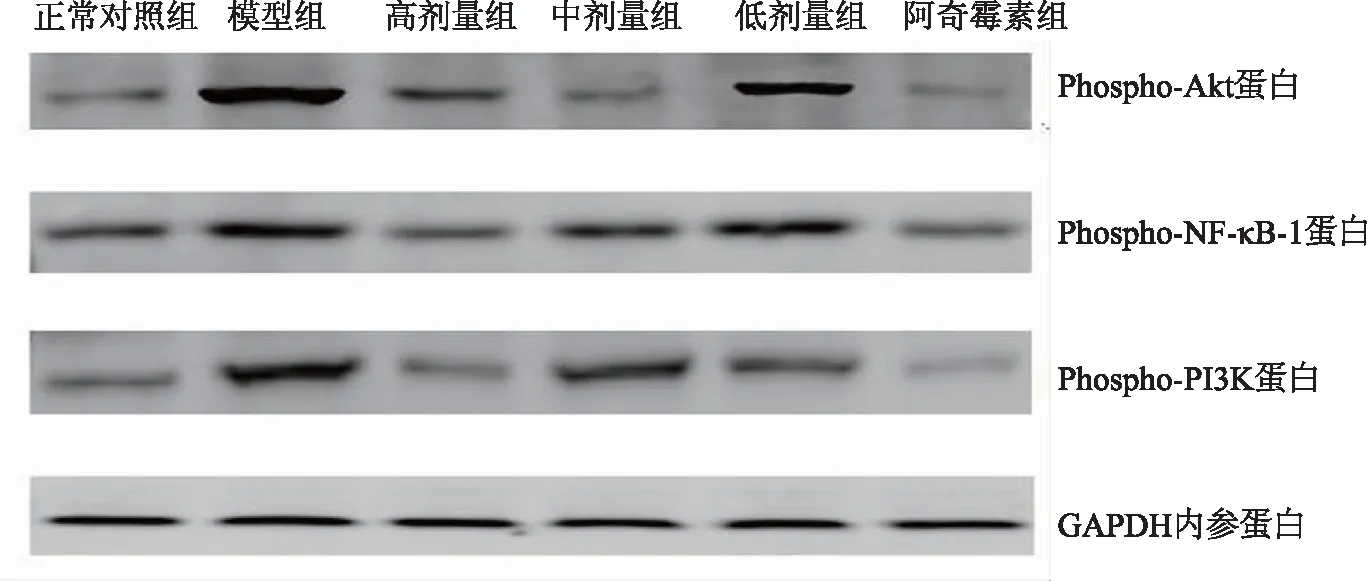
图1 磷酸化Akt、NF-κB-1、PI3K蛋白免疫印迹条带图
2.2 肺组织磷酸化Akt、NF-κB-1、PI3K蛋白表达
通过Western Blot检测,造模后磷酸化Akt、NF-κB-1、PI3K蛋白表达不同程度地增高,与正常对照比较,模型组增高有显著性差异(P<0.05)。经清热解毒扶正颗粒灌胃治疗后,与模型组相比较,清热解毒扶正颗粒高剂量组显著降低磷酸化Akt、NF-κB-1、PI3K蛋白表达水平(P<0.05);清热解毒扶正颗粒中剂量组显著降低磷酸化Akt蛋白表达水平(P<0.05),清热解毒扶正颗粒低剂量组对磷酸化Akt作用不显著(P>0.05);清热解毒扶正颗粒中剂量组、低剂量组对磷酸化NF-κB-1、PI3K蛋白表达作用不显著(P>0.05)。见表2、图1。
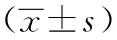
表2 各组大鼠肺组织磷酸化Akt、NF-κB-1、PI3K蛋白表达比较
3 讨论
PI3K是催化磷酸肌醇3-OH端磷酸化的一类蛋白质家族,当PI3K被氧化应激、生长因子等细胞表面受体激活后,在质膜上产生第二信使磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4, 5-triphosphate,PIP3),PIP3与细胞内含有PH结构域的信号蛋白Akt和磷脂酰激酶依赖激酶1(phosphatidykinase dependent kinase 1,PDK1)结合,促使PDK1磷酸化Akt蛋白,并最终导致Akt的活化[8]。活化的Akt可通过磷酸化作用激活或抑制其下游靶蛋白,促使核因子NF-κB发生核转位,使NF-κB的P65亚基磷酸化,增加其转录活性[9-10]。NF-κB是一种转录调节因子,可调控多种炎症因子基因的转录,细胞内NF-κB信号通路参与炎症反应、免疫反应、病毒复制、细胞凋亡和增殖的多种基因的表达调控,在调节炎症反应的基因中起关键作用。相关研究表明,转录因子NF-кB参与COPD多种炎症介质的调控,其中包括白细胞介素(interleulein,IL)-1、IL-6、IL-8、IL-12、TNF-α、LTB4、MIP、ICAM-1、NOS-2等细胞因子,NF-кB通过引导这些炎症介质的表达,参与肺部炎症的免疫反应[11]。系列炎症过程中同时产生弹性蛋白酶、基质金属蛋白酶(extracellular matrix,MMPs)等多种酶破坏降解气道及肺泡细胞外基质(extracellular matrix,ECM)。而基质金属蛋白酶(matrix metalloproteinases,MMPs)和金属蛋白酶组织抑制因子(matrix metalloproteinases,TIMPs)是调节肺泡ECM降解与合成的主要酶类。TIMPs是一组能够抑制MMPs活性的糖蛋白,可由巨噬细胞、内皮细胞、成纤维细胞及肿瘤细胞合成分泌,并以可溶性的形式分泌到ECM中,通过阻碍MMPs的酶原自我激活及特异性地与MMP-9催化活性中心的锌离子结合形成稳定的复合体抑制其活性。一般认为,MMP-9/TIMP-1比值升高表明气道以炎症为主,将导致组织破坏,形成肺气肿;MMP-9/TIMP-1比值下降表明气道以修复为主,将导致ECM过度沉积,气道发生重构[12-13]。PI3K/Akt/NF-кB信号通路可通过调控炎性介质释放、炎症细胞活化及气道重构等在气道慢性炎性疾病中起着重要作用。
清热解毒扶正颗粒以扶正祛邪为治疗原则,以清热解毒、凉血化瘀、益气养阴为治法的验方。实验研究表明,清热解毒扶正颗粒有明显降低内毒素致高热家兔的C-反应蛋白、IL-1β、IL-12的水平[6,14-15],抑制内毒素大鼠肺肾组织NF-κB p65蛋白表达水平[16]。临床研究表明,清热解毒扶正颗粒能明显降低老年肺炎患者升高的体液免疫指标;降低升高的血白细胞、血清降钙素原、C反应蛋白水平,有显著的抗感染作用[6,17]。能降低慢性阻塞性肺疾病患者的二氧化碳分压,提高其氧分压,对外感高热、肺炎、慢性阻塞性肺疾病等具有较好的疗效。
本研究表明,清热解毒扶正颗粒显著降低大鼠血清的TNF-α水平;显著降低血清TIMP-1水平,剂量依赖性;对血清MMP-9水平无显著影响,但能提高MMP-9/TIMP-1比值,显著降低肺组织磷酸化Akt、NF-κB-1、PI3K蛋白表达水平,有剂量依赖性。清热解毒扶正颗粒对抑制TIMP-1的作用强于抑制MMP-9,其作用机制倾向于促进病变组织ECM的降解,减少ECM沉积,减少肺泡壁、气道的损害,有利于肺组织、气道损伤的修复。基于扶正祛邪理论立法的清热解毒扶正颗粒能有效降低炎性因子水平,抑制炎性激活的Akt、NF-κB-1、PI3K蛋白表达水平,抑制炎症反应,其抗炎机制对PI3K/Akt/NF-κB信号通路有一定的调理作用,其作用位点是复合的多靶位的,具体靶向调控机制有待进一步研究。

