伐地那非增加EGCG-β-乳球蛋白纳米粒对肝癌细胞的抑制作用
陈春晓,楼文雨,丁镇建,李卓烨,杨媛媛,金鹏,杜琪珍
伐地那非增加EGCG--乳球蛋白纳米粒对肝癌细胞的抑制作用
陈春晓,楼文雨,丁镇建,李卓烨,杨媛媛,金鹏,杜琪珍*
浙江农林大学农业与食品科学学院,浙江 杭州 311300
较高浓度的EGCG才能抑制癌细胞的增殖,通过纳米化和EGCG与其他药物的联合使用是提高EGCG生物活性的重要策略。本研究将EGCG和伐地那非(VD)同时包埋于-乳球蛋白(-Lg)纳米载体中,制备出EGCG-VD--Lg纳米粒(EV-NPs),体外试验证实,EV-NPs能提高人肝癌细胞(HepG2细胞)中Caspase-3活性,使HepG2细胞在S期产生明显的阻滞,诱发细胞核分裂,从而导致HepG2细胞凋亡。研究结果表明,将EGCG与微量的VD联合使用,并通过纳米化包埋可以显著提高EGCG的抗癌活性。这一方法在EGCG抗癌制品的开发方面具有潜在的价值。
表没食子儿茶素没食子酸酯;伐地那非;-乳球蛋白;纳米粒;增殖抑制
绿茶中主要活性成分为表没食子儿茶素没食子酸酯(EGCG),EGCG含有较多的酚羟基,具有抗氧化性,对炎症、癌症、心血管疾病的防治具有积极的意义[1]。但由于EGCG对光、热和弱碱性环境敏感,在体液环境易降解和聚合,其在体内的生物利用率较低。
-乳球蛋白(-Lg)属于一种高度结构化的蛋白质,是一种廉价的、性能优良的包埋材料[2]。用-Lg包埋白藜芦醇、姜黄素和-3多不饱和脂肪酸可以改善这些功能性成分的生物利用率[3-5]。课题组前期研究表明,用-乳球蛋白包埋EGCG-维生素C可以使EGCG对肿瘤细胞的增殖抑制率提高20%~30%,但增效作用幅度相对不高[6]。已有研究表明,EGCG与伐地那非(Vardenafil,VD)联合使用(EGCG-VD)对抑制癌细胞有一定的协同作用[7]。因此,本研究采用-Lg包埋EGCG-VD,以期进一步提高EGCG对肿瘤细胞增殖的抑制率。
1 材料与方法
1.1 材料与仪器
人肝癌细胞(HepG2细胞,中国生命科学院细胞库);表没食子儿茶素没食子酸酯(EGCG)、盐酸伐地那非(VD)、-乳球蛋白(-Lg):西格玛奥德里奇(上海)贸易有限公司;4′,6-二脒基-2-苯基吲哚(DAPI)染液:江苏凯基生物技术股份有限公司;细胞凋亡检测试剂盒、细胞周期检测试剂盒:BD Pharmingen公司;活性Caspase-3检测试剂盒:BioVision公司。
全自动手持式细胞计数器:美国Millipore公司;荧光显微镜DM 2500:德国徕卡公司;酶标仪MD SpectraMax M4:美国Molecular Devices(MD)公司;流式细胞仪BD FACSCalibur:美国BD Biosciences;Nano-ZS 90型激光粒度仪:英国马尔文公司。
1.2 试验方法
1.2.1 纳米粒的制备
参照EGCG--Lg纳米粒(E-NPs)的制备方法[8-9],并根据实际情况进行方法上的改进。即用0.01 mol·L-1的磷酸盐缓冲溶液(pH 6.5)溶解-Lg,配置配制成8 mg·mL-1的-Lg溶液;用纯净水配制EGCG浓度1 mg·mL-1的系列EGCG-VD溶液:(EGCG)∶(VD)分别为(1∶0)、(3∶1)、(4∶1)、(5∶1)、(10∶1)、(15∶1)、(20∶1)、(25∶1);然后将2.5 mL-Lg溶液分别与2.5 mL系列EGCG-VD溶液混合,再超声处理6 min即得到系列EGCG-VD--Lg纳米粒(EV-NPs)。
1.2.2 粒径、电位测定
各纳米粒的粒径和电位采用英国马尔文公司Nano-ZS 90型激光粒度仪测定。测试温度为25℃,扫描波长633 nm,散射角为173°。
1.2.3 细胞活力测定
参照文献[10-11],采用MTT(四甲基偶氮唑盐比色法)试验测定细胞活力。培养细胞(37℃、5% CO2)至贴壁70%时,倒出培养基,用胰酶进行消化。消化完毕后用移液枪轻轻吹打混匀,用培养基稀释至预定浓度。将稀释好的细胞以每孔200 μL(约5 500个细胞)分别接种于96孔板中,在37℃、5% CO2的培养箱中培养至细胞完全贴壁(约24 h)。更换新鲜细胞培养基(180 μL),加入20 μL受试药物(受试组)或生理盐水(对照组)继续培养,培养24 h或48 h后进行细胞活性测定。将培养液弃置后用PBS缓冲液洗涤细胞2次,然后在每孔中加入完全培养基200 μL和MTT溶液50 μL,孵育4 h后将培养液移去,再加入二甲基亚砜(DMSO)150 μL,以300 r·min-1的低速摇床振荡10 min,用酶标仪在492 nm测定吸光值。受试药物对肿瘤细胞的抑制率按下式计算:
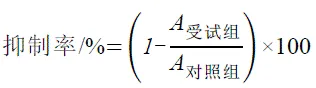
对照组、受试组分别代表对照组和受试组的平均吸光值。
1.2.4 细胞形态观察
将HepG2细胞用相应受试药物处理48 h,然后用倒置显微镜观察肿瘤细胞的形态。
1.2.5 细胞凋亡可视化观察
采用DAPI染色对样品处理后的HepG2细胞的凋亡情况进行可视化观察。将HepG2细胞接种于培养皿中,常规培养24 h后加入受试药物,给药处理48 h后移去原培养基,并用PBS缓冲液洗涤细胞,然后在避光条件下加入DAPI染色液,染色处理15 min后移去染色液,PBS缓冲液漂洗细胞后用荧光显微镜观察。
1.2.6 细胞凋亡率和坏死率测定
HepG2细胞被样品处理后的凋亡率和坏死率通过Annexin-FITC/PI双染色-流式细胞仪进行测定。首先将HepG2细胞接种于培养皿中培养至80%~85%的融合状态,然后加入相应浓度的EV-NPs(EGCG浓度设为60 μg·mL-1)、EGCG(60 μg·mL-1)和VD(12 μg·mL-1)。给药后培养48 h,移去培养基,用PBS缓冲液洗涤细胞,用胰酶进行消化后离心收集细胞。然后按照细胞凋亡试剂盒使用说明书对细胞进行处理,处理完毕后用流式细胞仪进行测定。
1.2.7 细胞周期阻滞测定
采用PI染色法对细胞周期阻滞进行测定。测定步骤按周期阻滞试剂盒说明书进行。首先收集已用供试药品处理好的细胞,然后用冰乙醇进行冷冻处理(过夜),离心移去乙醇后用PBS缓冲液洗涤处理后的细胞,再加入适量的PI染色液,充分染色后用流式细胞仪测定细胞周期阻滞。
1.2.8 细胞中Caspase-3活性测定
细胞中Caspase-3活性通过Caspase-3活性检测试剂盒进行测定。给药处理后的细胞,先用PBS缓冲液洗涤,然后将细胞转移至培养皿中,用胰酶进行消化,再加入培养基(含10%胎牛血清和1%双抗)分散细胞。细胞悬液转移至离心管后离心去除培养基,用PBS缓冲液清洗细胞,再用50 μL预冷的细胞裂解缓冲液(Cell lysis buffer)对细胞进行裂解,通过BCA检测法调节裂解液中的蛋白质浓度至3~4 μg·μL-1。取45 μL稀释裂解液于96孔板中,加入50 µL含有二硫苏糖醇(DTT)的反应缓冲液(含10 mmol·L-1DTT)和Caspase-3活性显色底物(终浓度为200 μmol·L-1),在细胞培养箱中培养1.5 h;培养结束后用酶标仪在405 nm测定吸光度。吸光度高低即表明细胞的活性Caspase-3含量的高低。
1.3 统计学方法
试验进行3次重复,使用SPSS 19.0软件对获得的试验数据进行统计分析,试验数值表示为:平均值±标准差。
2 结果与分析
2.1 EGCG与VD的质量比对纳米体系的影响
可以通过电位来判断纳米粒的稳定性,通常认为电位的绝对值在30 mV以上时纳米体系稳定[12]。本研究制备的纳米体系的粒径、电位和多分散指数(PDI)如表1所示。由于-Lg的等电点为pH 5.1,当(EGCG)∶(VD)为1∶1时,呈酸性的VD使得体系的pH为5.8,接近-Lg的等电点,导致-Lg溶解度降低而出现浑浊现象[13];(EGCG)∶(VD)在(3∶1)~(25∶1)的几种纳米体系均澄清,测得的平均粒径为71 nm左右,电位均小于–35.1 mV,纳米体系稳定。同时,较小的PDI值表明,纳米颗粒大小较一致。(EGCG)∶(VD)为5︰1制备的纳米粒的透射电镜图(图1)表明,EGCG-VD--乳球蛋白制备的纳米粒(EV-NPs)呈球形,粒径度大小与激光粒度仪测定结果(表1)一致。
2.2 EVβ-NPs对HepG2细胞增殖抑制作用
细胞液EGCG终浓度为60 μg·mL-1时,不同EGCG与VD的质量比的EV-NPs与E-NPs(不添加VD)对HepG2细胞增殖抑制率如表2。

表1 EGCG与VD质量比对纳米粒的粒径、ζ电位和PDI的影响

图1 EVβ-NPs [m(EGCG)∶m(VD)=5∶1]透射电镜照片
可以看出,添加VD制备的纳米粒(EV-NPs)在24 h和48 h比E-NPs对HepG2细胞的抑制效果更好。当(EGCG)∶(VD)为5∶1时,EV-NPs处理24 h和48 h对HepG2细胞的抑制比不添加VD的E-NPs [(EGCG)∶(VD)=1∶0]分别提高69%和75%。(EGCG)∶(VD)=3∶1的EV-NPs(178 nm)的抑制效果不及(EGCG)∶(VD)=5∶1的EV-NPs(73 nm),可能是因为(EGCG)∶(VD)=3∶1的EV-NPs的粒径过大。据文献报道[14],当纳米粒的粒径在50~75 nm时,细胞易内吞纳米粒,而(EGCG)∶(VD)=5∶1的EV-NPs的粒径更适合于细胞的内吞。当VD的添加量减少到(EGCG)∶(VD)到10∶1和15∶1后,EV-NPs的粒径无明显变化(表1),但它们的肿瘤细胞抑制活性显著降低,可能是由于VD的添加量过少所致。
2.3 EVβ-NPs对HepG2细胞形态的影响
通过对比正常细胞组、VD组、不添加VD的E-NPs组和EV-NPs组细胞的形态(图2)可以看出,EV-NPs组细胞变形严重,大多数细胞呈球形(图2-D),而正常细胞呈条形(图2-A)。相对而言,E-NPs组细胞只有轻度的细胞变形,而VD组细胞形态与正常组细胞基本一致。由此看来,纳米形式的样品对细胞产生了一定的毒性,而含有VD的EV-NPs对HepG2细胞的毒性比E-NPs进一步提高。
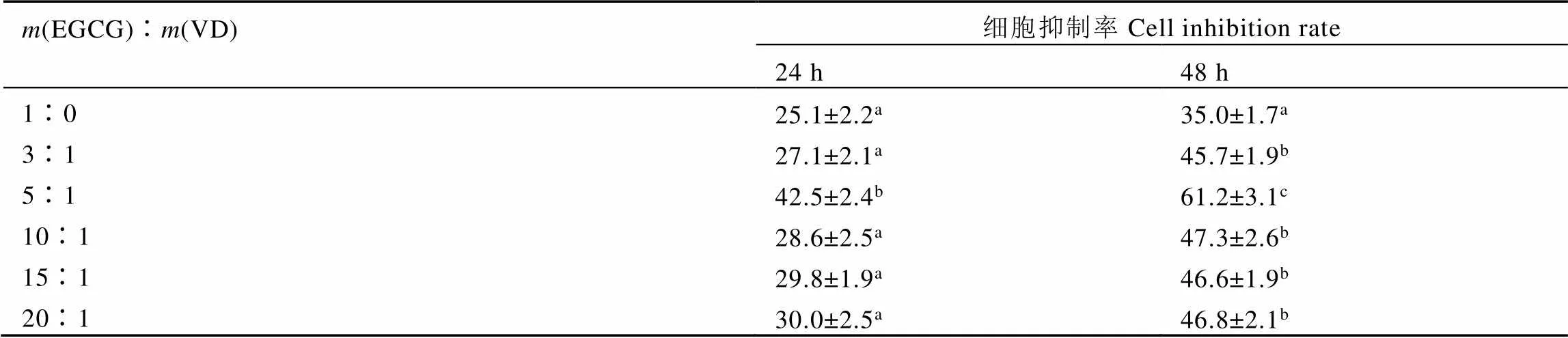
表2 不同纳米粒对HepG2细胞增殖的抑制率
注:不同处理间不同上标字母表示有显著性差异(< 0.05)
Note: Significant differences (< 0.05) were indicated by different uppercase letters in each column
2.4 EVβ-NPs导致的HepG2细胞凋亡作用
对照组和VD处理的HepG2细胞中正常细胞的细胞核蓝色荧光弥散均匀(图3-A和图3-B),而E-NPs和EV-NPs处理的细胞细胞核均出现了典型的细胞凋亡形态,即染色质边缘化、细胞核固缩、形成凋亡小体(红色箭头所示)。但EV-NPs处理的细胞的细胞核裂解比E-NPs更严重,凋亡小体进一步裂解成碎块(图3-D)。结果表明,EV-NPs诱导HepG2细胞凋亡的作用效果比EGCG--NPs进一步提高。
2.5 EVβ-NPs导致的HepG2细胞凋亡和坏死
EV-NPs与不同受试样品作用于HepG2细胞产生的细胞凋亡率与细胞坏死率存在明显差异(图4)。结果表明,E-NPs和EV-NPs处理的HepG2细胞的凋亡率显著高于坏死率,且细胞坏死率和凋亡率显著高于对照组和VD处理组(<0.01)。此结果印证了上述DAPI染色显示的细胞凋亡结果(图3)。增加样品浓度,EV-NPs导致HepG2细胞的凋亡率和坏死率亦逐渐提高(图4-B),且具有明显的剂量加性效应。

图2 不同样品处理的HepG2细胞形态

图3 不同样品处理HepG2细胞后经DAPI染色显示的细胞核形态差异
2.6 EVβ-NPs对HepG2细胞周期的影响
用EV-NPs处理的HepG2细胞呈现出S期细胞占比率大幅升高的现象(图5),表明EV-NPs可使细胞S期产生阻滞,从而诱导细胞凋亡。但E-NPs和VD处理的细胞,S期细胞占比率相较于正常对照组细胞有明显下降。EV-NPs与E-NPs的显著差别是纳米颗粒的大小,EV-NPs平均粒径为73 nm,而E-NPs的平均粒径只有31 nm。有研究报道,最适合于细胞内吞的纳米直径为50~75 nm[14],而EV-NPs大多数处于这一范围。由此推测EV-NPs对细胞S期产生的阻滞可能与其粒径尺寸有关。
2.7 EVβ-NPs对HepG2细胞凋亡蛋白表达的影响
不同样品处理的HepG2细胞的Caspase-3活性存在显著差异(图6),EV-NPs处理组细胞Caspase-3活性最高,其次为E-NPs组处理细胞,而VD处理组的Caspase-3活性与正常细胞组无差异。可见,EGCG与VD联用显著提高了凋亡蛋白的表达,说明EV-NPs主要通过调控Caspase-3信号通路诱导细胞凋亡。
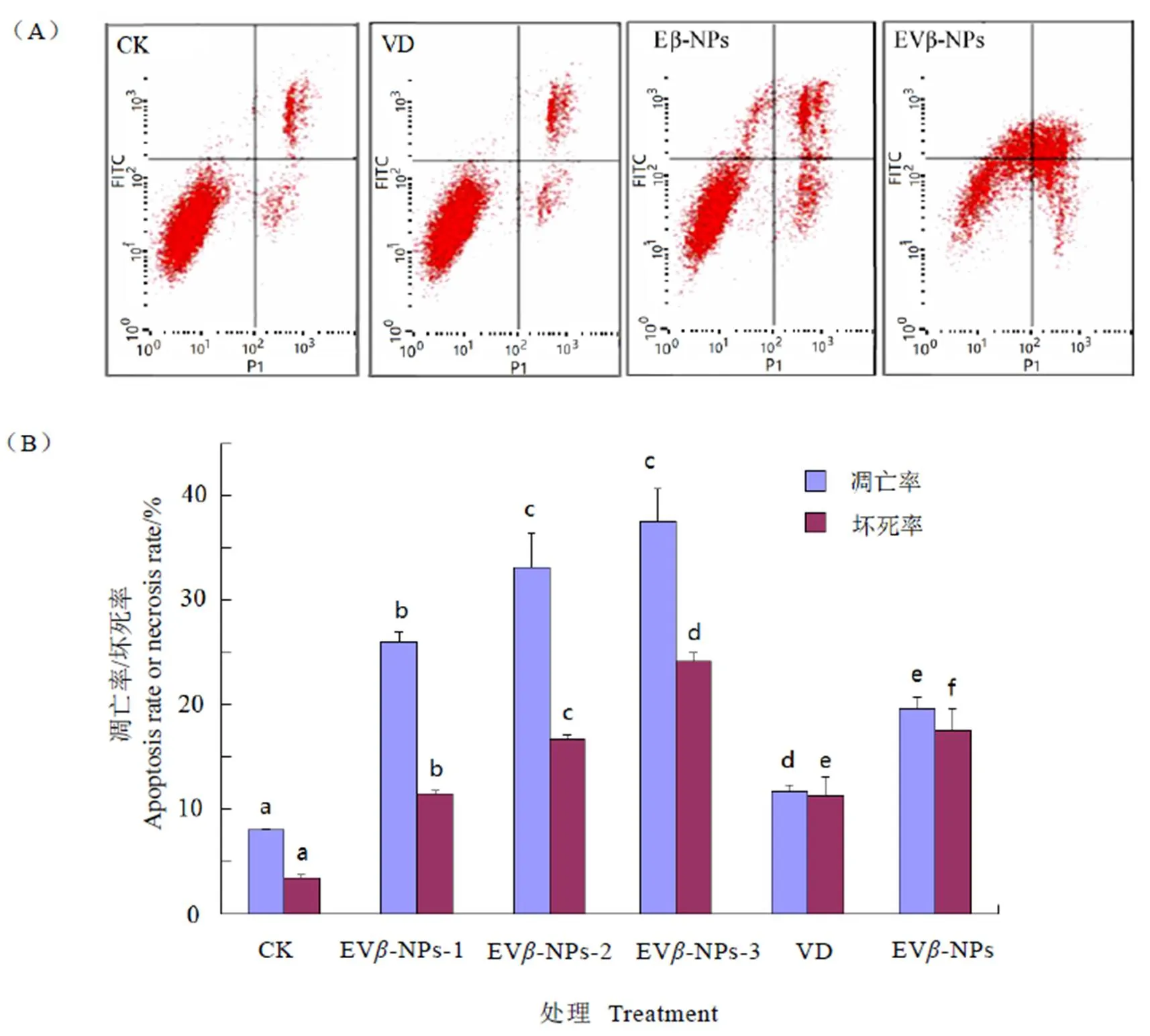
注:EVβ-NPs设置3个浓度,EVβ-NPs-1的EGCG浓度为30 µg mL-1;EVβ-NPs-2的EGCG浓度为60 µg mL-1;EVβ-NPs-3的EGCG浓度为90 µg mL-1。不同处理间不同字母表示有显著性差异(P<0.05)
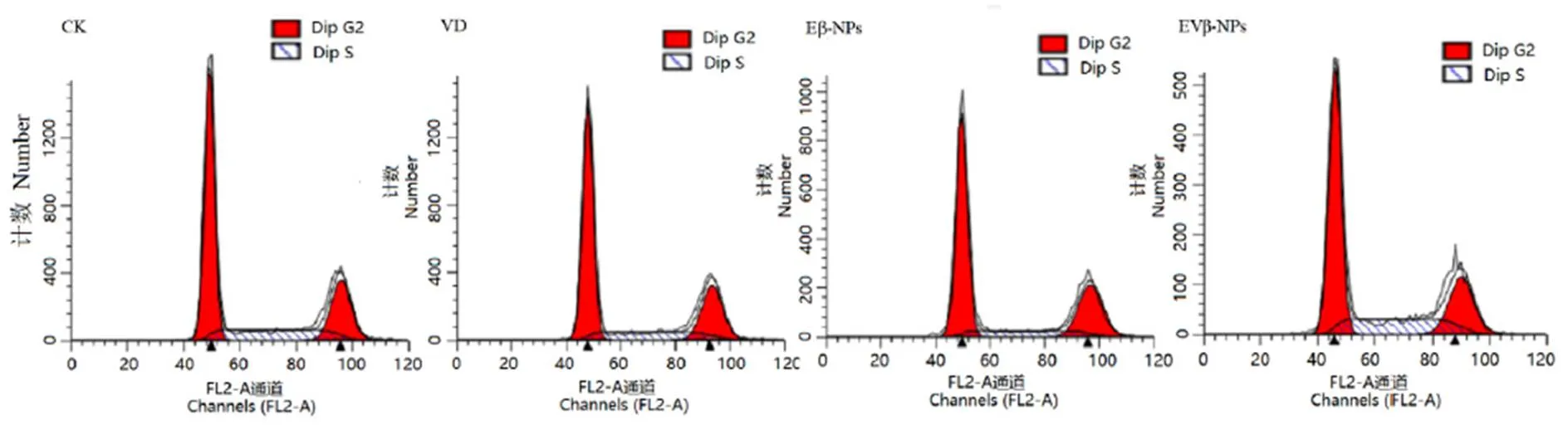
图5 不同样品处理的HepG2细胞的细胞周期分布
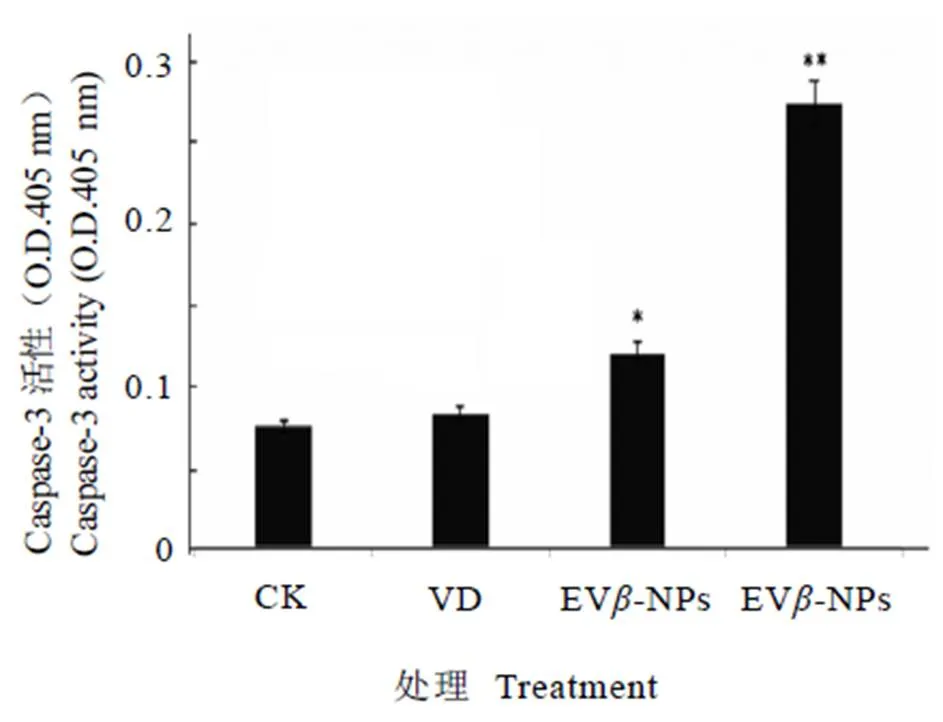
注:*与CK(正常生长细胞)组比较有显著性差异(P<0.05),**与CK组比较有极显著性差异(P <0.01)
3 讨论与结论
3.1 讨论
EGCG有一定的抗肿瘤作用,但其稳定性较差,抗肿瘤效果离临床应用还有较大的差距[15]。-Lg包埋EGCG可阻碍EGCG与氧气的接触从而相对提高了EGCG的稳定性,这种简单的包埋可以一定程度提高EGCG的抗癌活性[16]。将EGCG与抗氧化剂绿原酸、3-巯基己醇、没食子酸甲酯等联合包埋于-Lg中,可以进一步提高EGCG的稳定性,EGCG的抗癌活性可以进一步提高[17-19]。然而,仅仅提高EGCG的稳定性,其抗癌活性依然难以达到临床应用要求。本研究结果表明,将EGCG与伐地那非联合包埋于-Lg中制备成纳米粒,其体外抗肿瘤活性进一步增强,是一种有别于通过提高EGCG稳定性来提高其抗癌活性的策略。
伐地那非(VD)是一种PDE5抑制剂,研究表明,PDE5抑制剂可能通过增加细胞对药物的摄取来提高抗癌药物的疗效[20-21]。因此,本研究中,EV-NPs表现出比E-NPs更好的肿瘤细胞抑制效果,极可能是得益于VD增加了细胞对EGCG的摄取。类似于VD的PDE5抑制剂还有多种,如西地那非、他达那非、双嘧达莫等。研究将这些PDE5抑制剂与EGCG联用,并采取纳米化包埋,有可能进一步提高EGCG的抗癌活性。其次,本研究仅进行了EV-NPs体外抑制肿瘤细胞增殖的作用效果,有必要通过动物试验和人体试验进一步确认其在抗癌上的应用前景。
3.2 结论
EGCG与伐地那非联合包埋于-Lg中制备成纳米粒(EV-NPs),能提高Caspase-3的活性,使HepG2细胞在S期产生明显的阻滞,促进细胞核分裂,从而加速肿瘤细胞的凋亡。因此,将EGCG与微量的VD联合使用,并通过纳米化包埋,在EGCG抗癌制品的开发方面具有潜在的价值。
[1] 刘超, 陈若芸. 儿茶素及其类似物的化学和生物活性研究进展[J]. 中国中药杂志, 2004, 29(10): 1017-1021. Liu C, Chen R Y. Advance of chemistry and bioactivities of catechin and its analogues [J]. China Journal of Chinese Materia Medica, 2004, 29(10): 1017-1021.
[2] Ponniah K, Loo T S, Edwards P J, et al. The production of soluble and correctly folded recombinant bovine-lactoglobulin variants A and B in Escherichia coli for NMR studies [J]. Protein Expr Purifi, 2010, 70(2): 283-289.
[3] Liang L, Tajmir-Riahi H A, Subirade M. Interaction of-lactoglobulin with resveratrol and its biological implications [J]. Biomacromolecules, 2008, 9: 50-56.
[4] Sneharani A H, Karakkat J V, Singly S A. Interaction of curcumin with-lactoglobulin stability, spectroscopic analysis, and molecular modeling of the complex [J]. Journal of Agricultural and Food Chemistry, 2010, 58: 11130-11139.
[5] Zimet P, Livney Y D. Beta-lactoglobulin and its nanocomplexes with pectin as vehicles for ω-3 polyunsaturated fatty acids [J]. Food Hydrocoll, 2009, 23: 1120-1126.
[6] Kumazoe M, Sugihara K,Tsukamoto S, et al. 67-kDa laminin receptor increases cGMP to induce cancer-selective apoptosis [J]. J Clin Invest, 2013, 123(2):787-99.
[7] 黄美蓉, 应浩, 江用文, 等. EGCG纳米粒的制备及其抗肿瘤活性研究[J]. 茶叶科学, 2015, 35 (6): 605-612.
Huang M R, Ying H, Jiang Y W, et al. Research on preparation and antitumor activity of EGCG naonparticles [J]. Journal of Tea Science, 2015, 35 (6): 605-612.
[8] Shpigelman A, Israeli G, Livney Y D. Thermally-induced protein-polyphenol co-assemblies: beta lactoglobulin-based nanocomplexes as protective nanovehicles for EGCG [J]. Food Hydrocoll, 2010, 24(8): 735-743.
[9] Li B, Du W, Jin J, et al. Preservation of (-)-epigallocatechin-3-gallate antioxidant properties loaded in heat treated-lactoglobulin nanoparticles [J]. J Agriculture Food Chemistry, 2012, 60: 3477-3484.
[10] 成惠林. 检测细胞活性的MTT方法[J]. 江苏医药, 1996, 22(5): 330-331. Cheng H L. MTT method for the detection of cell activity [J]. Jinagsu Med J, 1996, 22(5): 330-331.
[11] 周建军, 乐秀芳, 韩家娴, 等. 影响MTT方法测定结果的一些因素[J]. 肿瘤, 1994, 14(2): 93-94. Zhou J J, Le X F, Han J X, et al. The factors influencing the results of MTT [J]. Tumor, 1994, 14(2): 93-94.
[12] Müller R H, Jacobs C, Kayser O. Nanosuspensions as particulate drug formulations in therapy rationale for development and what we can expect for the future [J]. Adv Drug Delivery Rev, 2001(47): 3-19.
[13] Timasheff S N, Townend R. Molecular interactions in-lactoglobulin. I. The association of the genetic species of-lactoglobulin below the isoelectric point [J]. J Am Chem Soc, 1961, 83(2): 464-469.
[14] Chithrani B D, Ghazani A A, Chan W C W. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells [J]. Nano Lett, 2006, 6: 662-668.
[15] Yang C S, Wang X, Lu G, et al. Cancer prevention by tea: animal studies, molecular mechanisms and human relevance [J]. Nat Rev Cancer 2009, 9: 429-439.
[16] Wu M, Jin J, Jin P, et al. Epigallocatechin gallate-β-lactoglobulin nanoparticles improve the antitumor activity of EGCG for inducing cancer cell apoptosis [J]. J Funct Food, 2017, 39: 257-263.
[17] Fan Y, Zhang Y, Yokoyama W, et al. β-Lactoglobulin–chlorogenic acid conjugate-based nanoparticles for delivery of (-)-epigallocatechin-3-gallate [J]. RSC Adv, 2017, 7(35): 21366-21374.
[18] Yang Y, Jin P, Zhang X, et al. New epigallocatechin gallate (EGCG) nanocomplexes co-assembled with 3-mercapto-1-Hexanol and-lactoglobulin for improvement of antitumor activity [J]. J Biomedi Nanotechnol, 2017, 13(7): 805-814.
[19] Zhang L, Sahu I D, Xu M, et al. Effect of metal ions on the binding reaction of (-)-epigallocatechin gallate to-lactoglobulin [J]. Food Chemistry, 2017, 221: 1923-1929.
[20] Corbin J D, Beasley A, Blount M A, et al. Vardenafil: structural basis for higher potency over sildenafil in inhibiting cGMP specific phosphodiesterase-5 (PDE5) [J]. Neurochem Int, 2004, 45: 859-863.
[21] Li Q, Shu Y. Pharmacological modulation of cytotoxicity and cellular uptake of anti-cancer drugs by PDE5 Inhibitors in lung cancer cells [J]. Pharma Res, 2014, 31: 86-96.
Vardenafil Improves the Proliferative Inhibition of EGCG--lactoglobulin Nanoparticles Against Liver Cancer Cells
CHEN Chunxiao, LOU Wenyu, DING Zhenjian, LI Zhuoye, YANG Yuanyuan, JIN Peng, DU Qizhen*
School of Agricultural and Food Science, Zhejiang Agriculture and Forestry University, Hangzhou 311300, China
The combination of nano and other drugs is an important strategy to improve the biological activity of EGCG, since a high EGCG concentration is essential for the inhibition of the proliferation of cancer cells. In this study, EGCG-vardenafil (VD)--lactoglobulin (-Lg)-nanoparticles (EV-NPs) was prepared by encapsulating EGCG and VD in-Lg nano-carriers.experimental results show that EV-NPs could upgrade the activity of caspase-3 in HepG2 cells compared to the native EGCG, which caused cell cycle arrest in the S phase of HepG2 cells to induce cell nuclear division, and finally lead to HepG2 cell apoptosis. The results demonstrate that the encapsulation of EGCG-VD can significantly improve the anticancer activity of EGCG, and possesses potential value in the development of EGCG anticancer products.
EGCG, vardenafil,-lactoglobulin, nanoparticles, proliferative inhibition
S571.1;Q946.84+1
A
1000-369X(2020)04-528-08
2019-10-09
2020-04-11
浙江省重点研发(2019C02072)、浙江农林大学大学生创新(113-2013200135、115-2013200021)
陈春晓,女,硕士研究生,主要从事天然活性物质方面的研究。
qizhendu@163.com
投稿平台:http://cykk.cbpt.cnki.net

