草甘膦及其代谢物氨甲基膦酸在茶树体中的分布研究
郭永春,陈金发,赵峰,王淑燕,王鹏杰,周鹏,欧阳立群,金珊,叶乃兴*
草甘膦及其代谢物氨甲基膦酸在茶树体中的分布研究
郭永春1,陈金发2,赵峰3*,王淑燕1,王鹏杰1,周鹏4,欧阳立群4,金珊1,叶乃兴1*
1. 福建农林大学园艺学院/茶学福建省高校重点实验室,福建 福州 350002;2. 国家茶叶质量安全工程技术研究中心,福建 安溪 362400;3. 福建中医药大学药学院,福建 福州 350122;4. 福建省产品质量检验研究院,福建 福州 350002
为了研究草甘膦在茶树中的转运和代谢,通过向幼龄茶树和成年茶树定量喷施不同剂量的草甘膦(幼龄:0.9 g·m-2;成年:1.5、4.5 g·m-2和15 g·m-2),并在喷施后的1、4、7、15 d和40 d取样,测定茶树各部位草甘膦及其主要代谢物氨甲基膦酸的含量,以探究草甘膦及其主要代谢物在茶树中的分布规律。结果表明,茶树根部喷施草甘膦后,茶树中的草甘膦含量由高至低依次为根、叶和茎;而氨甲基膦酸主要积累于茶树根部,幼龄茶树茎和叶中也可检测到氨甲基膦酸(0~0.33 mg·kg-1),成年茶树茎和叶未检测到氨甲基膦酸。施药40 d后,幼龄茶树在0.9 g·m-2施药剂量下,根、茎和叶中未检测到草甘膦和氨甲基膦酸;成年茶树在1.5~15 g·m-2施药剂量下,根中仍检测到草甘膦和氨甲基膦酸残留,分别为2.26~26.73 mg·kg-1和0.21~2.59 mg·kg-1,茎和叶中草甘膦残留量较低,为0~0.29 mg·kg-1。通过田间模拟试验,初步探明了草甘膦被茶树内吸后在不同部位的转运、代谢和富集规律,可为茶园草甘膦的科学管控及风险评价提供参考。
茶树;草甘膦;氨甲基膦酸;残留;分布
草甘膦(Glyphosate,PMG)属内吸传导型除草剂,可与植物组织器官接触后被吸收并传导至植物全株[1]。因价格低廉、杀草谱广、除草性优良等特点,草甘膦被广泛运用于茶园、果园和农田等农业领域,是世界上产量最大的化学除草剂[2]。其除草机理是通过抑制莽草酸生物合成途径中的关键酶,阻止芳香氨基酸的生物合成,从而杀死杂草[3]。草甘膦可以从杂草嫩梢传导至其根部,代谢为氨甲基膦酸(Aminomethylphosphonic acid,AMPA)[4]。AMPA作为草甘膦的主要降解产物,是一种植物毒素[5],相关研究表明,AMPA对水生生物和哺乳动物具有长期的毒性作用[6-7]。此外,草甘膦能够在环境和生物体内不断富集,威胁作物生长和人类健康[8-9]。草甘膦的安全性争议不断,世界上已有多个国家已禁止或限制草甘膦的施用,我国现行的国家食品安全标准GB 2763—2019规定茶叶中草甘膦的最大残留限量(Maximum residue limits,MRLs)为1.0 mg·kg-1[10]。
茶叶是我国重要的优势经济作物,其绿色健康的产品属性,使其所制饮品——茶成为世界上最受欢迎的非酒精饮料之一[11]。现阶段,我国的福建、贵州等部分省份通过地方法规限制茶园使用草甘膦。然而,有关市售茶叶的农残抽检仍可检出一定比例的的草甘膦残留[12];田间不合理用药造成的茶叶草甘膦残留量超标问题时有报道[8],说明生产实践中茶园草甘膦的污染问题仍然存在。因此,充分地探究草甘膦在茶树体中的代谢和富集规律显得尤为重要。Tong等[13]通过水培体系研究草甘膦在茶苗的转运和代谢规律发现,草甘膦经茶苗根部吸收并转运到叶部,可能是茶叶中草甘膦残留的主要来源。但草甘膦在田间栽培茶树中的转运和代谢规律未见研究报道。此外,草甘膦及其代谢物在幼龄茶树和成年茶树中的代谢和分布差异也尚待比较。
本研究采用超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法,通过对施用不同时间的幼龄和成年茶树根、茎、叶中的草甘膦及其主要代谢物AMPA进行定量,从而探究草甘膦从土壤中被茶树根部内吸后在植株内的转运、分布和代谢情况。相关试验结果将有助于人们更好地了解草甘膦在茶树体内的代谢,为茶园草甘膦的安全管控提供指导。
1 材料与方法
1.1 材料处理
1.1.1 幼龄茶苗盆栽试验
试验在福建农林大学茶学田间实验室进行,选取1年生金观音茶苗植于盆口表面积约0.1 m2的盆钵中,将泥炭土和珍珠岩按照1∶1(体积比)混匀后作栽培基质,静置15 d,期间实施一致的水肥管理措施。幼苗长出新梢后,选取长势基本一致的幼苗,将草甘膦异丙胺盐定量喷洒于土壤基质表面。草甘膦施用剂量为0.9 g·m-2[0.3 g·L-1(低于推荐施用浓度)的草甘膦在土壤基质上定量喷洒0.3 L,喷洒面积约0.1 m2]。分别于0(喷施前)、1、4、7、15 d和40 d采集茶树的根、茎和叶。取样部位见图1-A,根取整个根部;茎取茎上部10 cm左右;叶取新梢一至三叶。
1.1.2 成年茶树田间试验
试验在福建农林大学南山茶园进行,试验材料选取长势基本一致的20年生黄旦成年茶树,将草甘膦异丙胺盐定量喷洒于茶树根部。试验中的草甘膦施用剂量分别为1.5、4.5 g·m-2和15 g·m-2[0.3、0.9 g·L-1(低于推荐施用浓度)和3 g·L-1(推荐施用浓度)的草甘膦在土壤上定量喷洒5 L,喷洒面积约1 m2]。分别于0(喷施前)、1、4、7、15 d和40 d采集茶树的根、茎、嫩叶和成熟叶。取样部位见图1-B,根取侧根;茎取茎上部20 cm左右;嫩叶取新梢一至三叶,成熟叶取新梢下四至六叶。
1.2 分析方法
1.2.1 分析试剂
草甘膦异丙胺盐(有效成分30%)购自山东三农生物科技有限公司;氨甲基膦酸标准品、草甘膦标准品和草甘膦内标(1,2-13C15N草甘膦)购自上海安谱有限公司;乙酸铵(色谱级)、甲酸(色谱级)、36%盐酸(色谱纯)、十水四硼酸钠(分析纯)和磷酸二氢钾(分析纯)均购自西陇科学股份有限公司;乙腈(色谱级)和甲醇(色谱级)购自山东禹王和天下新材料有限公司;氯甲酸-9-芴基甲酯(FMOC-Cl,分析纯,纯度≥99.0%)购自上海源叶生物科技有限公司。60 mg/3 mL阳离子交换柱(PCX)购自博纳艾杰尔科技公司。
1.2.2 样品前处理
采集后的样品立即放入液氮速冻,使用冷冻干燥机充分干燥。然后将干燥后的样品放入研钵磨碎成粉,制得待测样品。参考叶美君等[14]的方法,并改进如下:称取0.25 g待测样品(3次重复),加入4 mL超纯水,涡旋混匀,超声提取30 min,10 000 r·min-1离心3 min,取1 mL上层澄清液至离心管中,再向离心管加入50 μL草甘膦内标(介质:10%甲醇;浓度:1 mg·L-1)和100 μL酸度调节剂(水∶甲酸∶盐酸=60∶40∶13.4),涡旋10 s,16 000 r·min-1离心3 min。分别移取2.0 mL甲醇和2.0 mL 0.5%(∶)甲酸水溶液依次活化PCX柱,弃去废液,待用。取离心后的上层澄清液过PCX柱,然后加入700 μL 0.5%(∶)的甲酸洗脱。过柱收集的溶液加入20 mL 50%(∶)NaOH调节流出液至中性,并加超纯水定容至3 mL,吸取600 μL,加入200 μL 5%硼砂溶液和200 μL 25 g·L-1FMOC-Cl乙腈溶液,涡旋振荡混匀后,室温避光放置30 min衍生。最后,16 000 r·min-1离心3 min,将上清液过0.22 μm有机相滤膜,滤液用于UPLC-MS/MS检测。
1.2.3 草甘膦和氨甲基膦酸的定量分析方法
采用UPLC 1290 Infinity色谱串联6490 Triple Quad质谱(Agilent公司,美国)测定样品中草甘膦和氨甲基膦酸含量。检测条件参照叶美君等[14]方法。参照食品安全国家标准GB 5009.3—2016测定待测样品中的水分含量,草甘膦和氨甲基膦酸的定量结果以干基计。
1.2.4 统计分析
2 结果与分析
2.1 方法验证
选取5个空白茶叶样品,分别添加0.05、0.1 mg·kg-1和0.5 mg·kg-1的草甘膦和氨甲基膦酸混合标准溶液,按照1.2.2章节和1.2.3章节中的方法进行提取、净化、衍生和检测。由表1可知,草甘膦和氨甲基磷酸在低、中、高3个加标水平均具有较好的准确度与精密度,方法的定量限(LOQ)为0.05 mg·kg-1。
2.2 茶树药害观察
在田间试验中,成年茶树生长正常,未有药害表现。不同剂量的草甘膦处理40 d,茶树叶片与未施药(0 d)相比并未出现叶片脱落和黑褐色斑点等不正常生长现象。
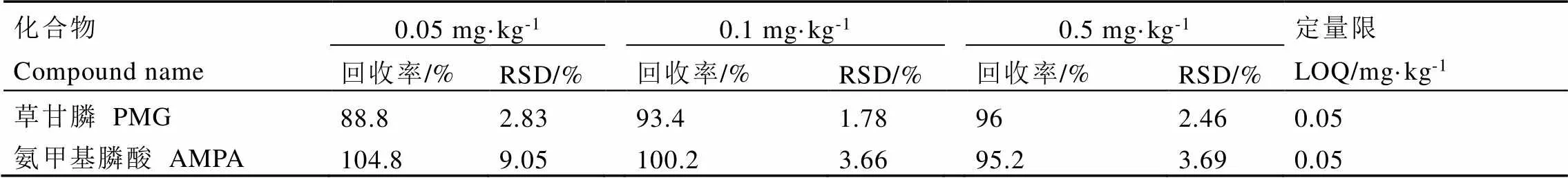
表1 草甘膦和氨甲基膦酸在空白茶叶样品中的添加回收率、相对标准偏差和定量限(n=5)
2.3 草甘膦和氨甲基膦酸在幼龄茶树体中的分布动态
幼龄茶树根、茎、叶中的草甘膦定量结果如图2-A所示。根在0 d未检测出草甘膦残留,随着施药时间的延长,根中的草甘膦含量呈现先增加后降低的趋势,处理4 d后,根中草甘膦的积累水平最高,达5.92 mg·kg-1。草甘膦被根系吸收后,茎中的草甘膦含量在处理1 d后达到0.66 mg·kg-1,15 d后达到0.8 mg·kg-1。叶片中草甘膦的残留量在处理1 d后低于定量限,4 d后增加到1.49 mg·kg-1,7 d时残留量最高,为1.57 mg·kg-1,大于MRLs。在处理4、7、15 d时,茶树叶片中的草甘膦残留量均高于茎,表明草甘膦从根被吸收向茎叶转运的过程,在茎中的积累量较少。40 d后,幼龄茶树各部位中的草甘膦残留量均低于定量限。
幼龄茶树根、茎和叶中的氨甲基膦酸(AMPA)的定量结果如图2-B所示。根在0 d未检测出AMPA残留,在4 d积累量最高,为2.03 mg·kg-1,4 d后积累量逐渐下降。草甘膦处理后4、15 d和40 d,茶树茎和叶中的AMPA残留量均低于定量限;草甘膦处理后1 d,茎和叶片中AMPA的残留量较低,7 d残留量最高,分别为0.33 mg·kg-1和0.13 mg·kg-1。40 d后,幼龄茶树各部位的AMPA残留量均低于定量限。
通过双因素方差分析结果可知(表2),处理后不同天数的茶树残留的草甘膦和AMPA含量差异达到极显著水平(<0.01),茶树体内不同部位间残留的草甘膦和AMPA含量差异达到极显著水平(<0.01),并且不同部位与天数间的交互作用亦达到极显著水平(<0.01),说明不同天数、部位之间的草甘膦和AMPA含量有显著差异。

注:草甘膦施药剂量为0.9 g·m-2,n=3
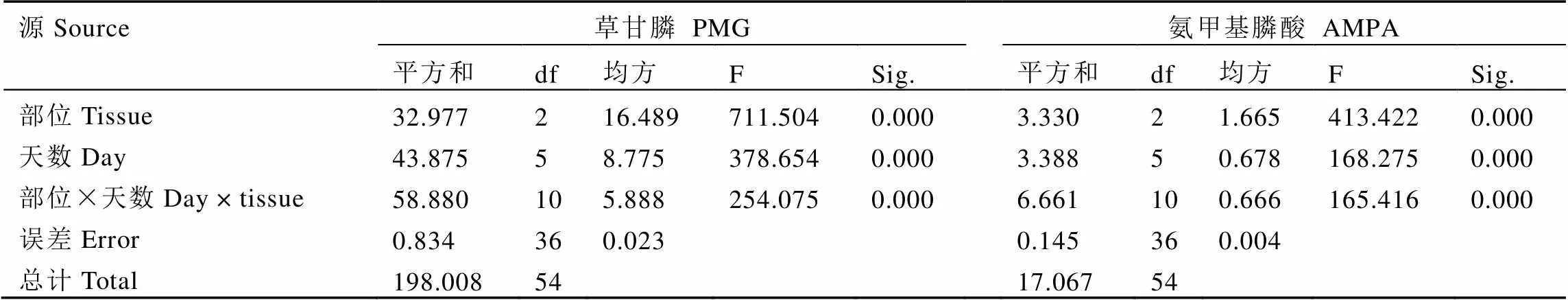
表2 不同天数茶树不同部位草甘膦和氨甲基膦酸含量的双因素方差分析(n=3)
2.4 草甘膦和氨甲基膦酸在成年茶树中的分布动态
2.4.1 草甘膦和氨甲基膦酸在根部的分布动态
比较1.5、4.5 g·m-2和15 g·m-2施药剂量下成年茶树根中草甘膦和氨甲基膦酸(AMPA)的含量变化,结果见表3。在不同施药剂量下,与15 d相比,草甘膦含量在40 d后均有所减少。低施药量下根部草甘膦在15 d至40 d的降解率最高,达到64.97%,表明低施药量下草甘膦不易形成持久性残留。根中的AMPA含量较低,仅为草甘膦含量的3.23%~9.70%。1.5 g·m-2和4.5 g·m-2施药量下,40 d后AMPA的含量减少,而在15 g·m-2施药量下,40 d后AMPA的含量增高。
2.4.2 草甘膦在茎部的分布动态
在不同施药量下,成年茶树茎中均未定量到氨甲基膦酸残留。1.5 g·m-2施药量下,成年茶树茎中未定量到草甘膦残留。茎中草甘膦含量的变化动态如图3所示,4.5 g·m-2和15 g·m-2施药量下,草甘膦在茎中的积累量较少,不同时间茎中的草甘膦含量存在显著差异。4.5 g·m-2施药量下,茎中草甘膦残留量在4 d最高,为0.22 mg·kg-1,15 d后茎中未检出草甘膦残留。15 g·m-2施药量下,茎中的草甘膦残留量在15 d最高,为0.43 mg·kg-1,40 d后茶树茎中仍检出草甘膦0.29 mg·kg-1(低于MRLs)。
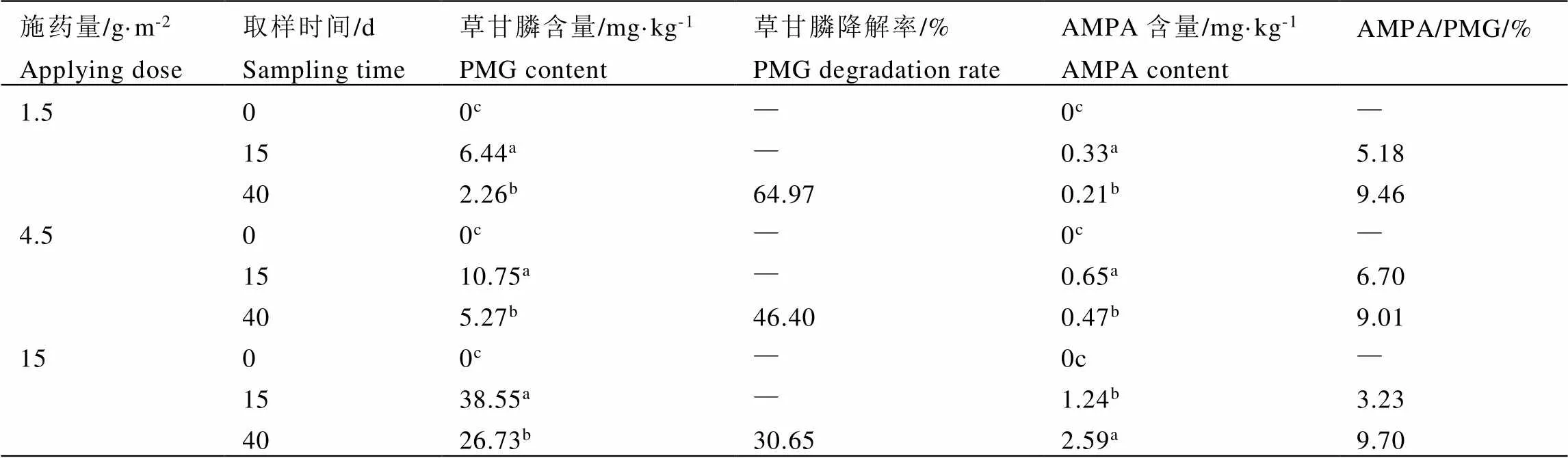
表3 不同时间茶树根中草甘膦及氨甲基膦酸的含量(n=3)
注:同一列不同上标字母表示不同样品中草甘膦或氨甲基膦酸含量的显著性差异水平,其中<0.05
Note: Different superscript letters in the same column indicate significant differences in PMG or AMPA content in different samples,<0.05
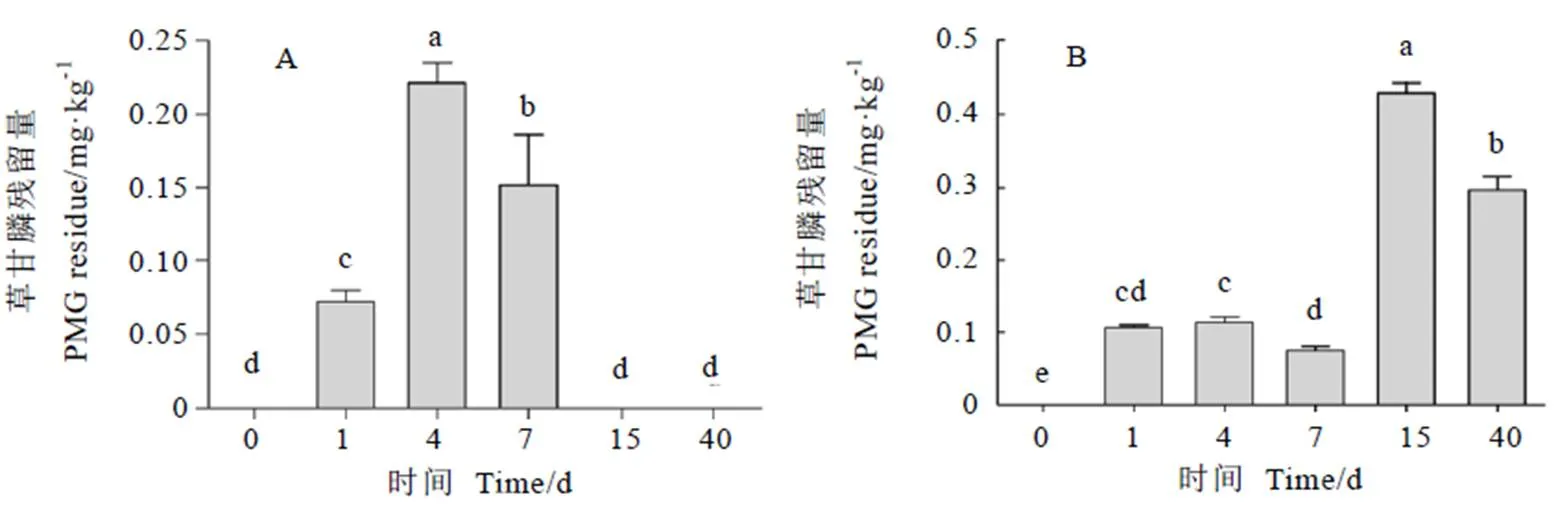
注:A施药量为4.5 g·m-2;B施药量为15 g·m-2。n=3
2.4.3 草甘膦在嫩叶和成叶中的分布动态
在不同施药量下,成年茶树嫩叶和成叶中均未定量到氨甲基膦酸残留。由图4可知,不同时间嫩叶和成叶中的草甘膦含量存在显著差异。在1.5 g·m-2施药量下,嫩叶和成叶中的草甘膦在7 d积累量最多;在4.5 g·m-2施药量下,嫩叶和成叶中的草甘膦在4 d积累量最多;在15 g·m-2施药量下,嫩叶中的草甘膦含量在4 d达到最高,成叶中的草甘膦含量在15 d达到最高。在1.5 g·m-2和4.5 g·m-2施药量下,成叶中的草甘膦含量在不同时间均高于嫩叶,嫩叶和成叶中的草甘膦分别在15 d和40 d完全降解;在15 g·m-2施药量下,成叶中的草甘膦含量除4 d外均高于嫩叶,嫩叶中的草甘膦在40 d完全降解,而成叶中的草甘膦在40 d仍未完全降解,表明成叶中草甘膦的降解期比嫩叶长,积累量总体上高于嫩叶。40 d后,嫩叶在不同施药量下草甘膦的残留量均小于定量限,成叶在高施药量下检出草甘膦0.20 mg·kg-1(低于MRLs)。
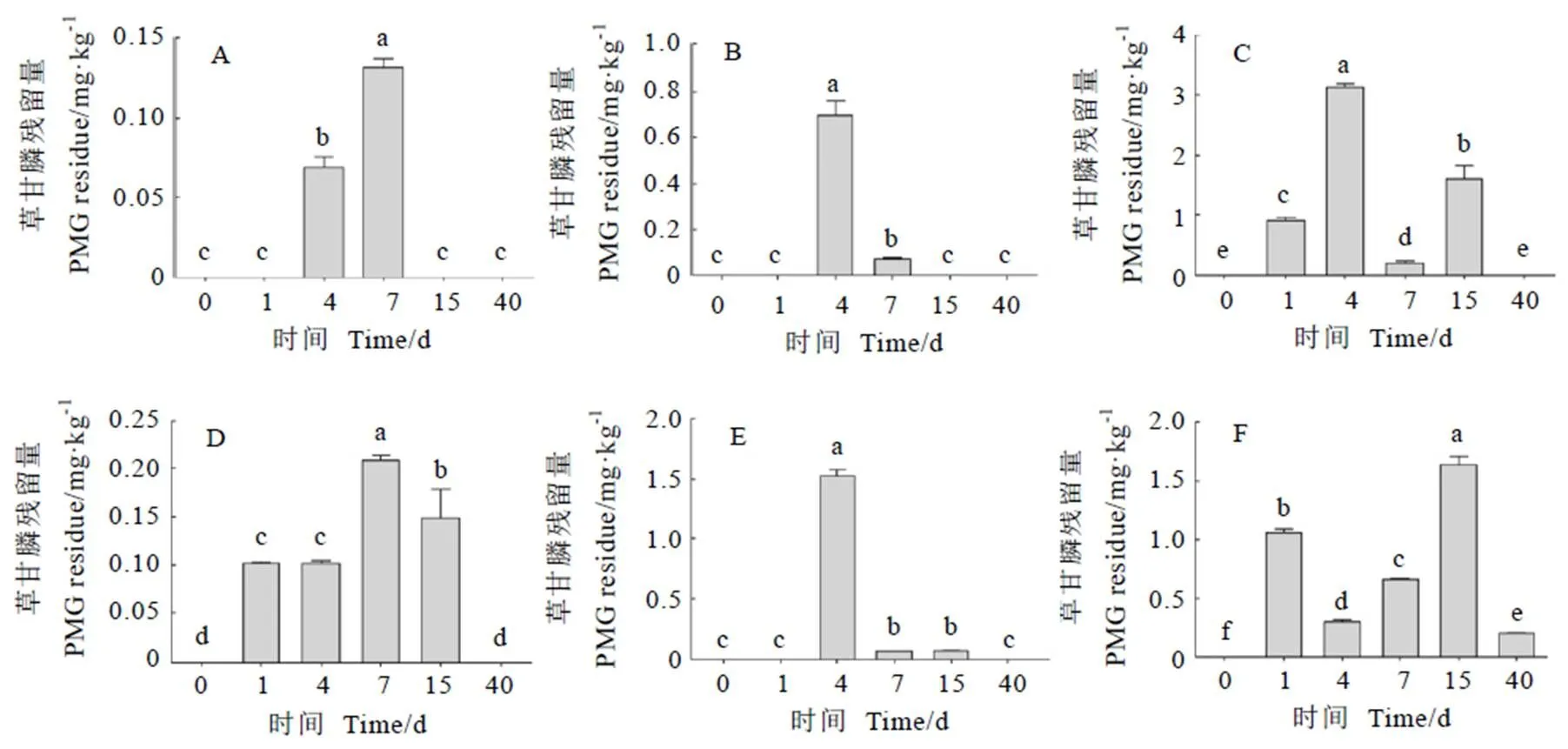
注:A—C为嫩叶,D—F为成熟叶。A和D施药量为1.5 g·m-2;B和E施药量为4.5 g·m-2;C和F为施药量15 g·m-2。n=3
3 讨论
草甘膦具有广谱性,农田喷洒草甘膦杀死杂草的同时,还会通过雨水、风等方式扩散,危害作物的正常生长[15]。目前,已有研究表明毛桃[16-17]、花生[18]和橡胶树[19]等植物在草甘膦除草剂胁迫下会产生药害。Tong等[13]研究发现,水培茶苗营养液中草甘膦浓度达到200 mg·L-1时,茶苗叶片会出现黑褐色斑点,最终脱落。而高万君等[20]通过田间试验发现,向田间施用常用剂量的草甘膦后,茶树地上部的生长并未产生药害。本试验与后者研究结果相似,在1.5~15 g·m-2施药剂量下,黄旦成年茶树的地上部未观察到药害产生,说明在田间栽培中草甘膦的使用并不易使茶树地上部产生药害作用。Smedbol等[21]研究认为,根中AMPA的积累,可能是大豆中观察到植物毒性的主要原因。本试验中,尽管在较高施药量下,根中AMPA的积累量仍较低(表3),这可能是茶树地上部未产生药害的原因之一。
草甘膦污染对人体产生潜在及长期的毒性[6],研究草甘膦在茶树体中转运和富集规律十分重要。在幼龄茶树的土壤基质定量喷洒0.9 g·m-2的草甘膦后,发现幼龄茶树的根、茎和叶均可检测到草甘膦和其主要代谢产物AMPA,说明喷洒到土壤中的草甘膦也可以被茶树根部吸收并代谢成AMPA,根系中的草甘膦和AMPA经茶树茎部运输到叶。与Tong等[13]研究草甘膦在水栽培茶苗的转运规律不同,本研究在幼龄茶树叶片中可检测到AMPA残留,表明其对人类健康具有潜在的影响。为了进一步验证草甘膦和AMPA在田间栽培成年茶树体中的转运和富集规律,向成年茶树定量喷洒1.5、4.5 g·m-2和15 g·m-2的草甘膦。研究结果与Tong等[13]研究草甘膦在水培茶苗的转运规律相似,而在较高施药量下,成年茶树的嫩叶和成叶均未检出AMPA残留。因此,与成年茶树相比,幼龄茶树喷施草甘膦后的安全性更低,生产中应严格控制幼龄茶园草甘膦除草剂的使用。在不同施药剂量下,成年茶树根中的草甘膦含量均明显高于嫩叶、成叶和茎上部,表明草甘膦经成年茶树根部转运至嫩叶、成叶和茎上部的含量较低。成年茶树成叶中草甘膦的降解期比嫩叶长,积累量总体上高于嫩叶,与Tong等[13]的研究结果相似,成年茶树嫩叶制备的茶叶比成叶更为安全。此外,Tong等[13]研究草甘膦在水培茶苗根、茎和叶中的分布规律发现,草甘膦在水培茶苗根部的含量最高,茎部次之,叶片的含量最低。而本研究中幼龄和成年茶树叶片中草甘膦的含量均比茎高。Smedbol等[21]研究草甘膦在大豆植物中的分布规律表明,大豆叶片中草甘膦的含量高于茎。说明相比水培茶苗,草甘膦的施用对田间茶叶的安全性威胁可能更大。
本研究对茶园喷洒草甘膦后的茶树进行研究,发现草甘膦在田间种植中不易使茶树产生药害,但能够被茶树根部吸收和代谢并转运到地上部。相较于成年茶树,草甘膦的施用对幼龄茶树具有较大的安全隐患;此外,相较于嫩叶,成年茶树的成叶制备茶叶的安全隐患较大。本研究结果可为草甘膦的茶树药害研究及其在茶叶生产质量安全管控方面提供参考。
[1] Schrübbers L C, Valverde B E, Strobel B W, et al. Glyphosate accumulation, translocation, and biological effects inafter single and multiple exposures [J]. European Journal of Agronomy, 2016, 74: 133-143.
[2] 唐杏燕, 邵增琅, 杨路成, 等. 茶园中草甘膦在靶标杂草和非靶标茶树中的吸收、转运、分布和代谢[J]. 食品安全质量检测学报, 2018, 9(18): 4900-4905. Tang X Y, Shao Z L, Yang L C, et al. Uptake, translocation, distribution and metabolism of glyphosate in target weeds and non-target tea trees in tea garden [J]. Journal of Food Safety and Quality, 2018, 9(18): 4900-4905.
[3] Chen J, Huang H, Wei S, et al. Investigating the mechanisms of glyphosate resistance in goosegrass ((L.) Gaertn.) by RNAsequencing technology [J]. Plant Journal for Cell & Molecular Biology, 2016, 89(2): 407-415.
[4] Zhan H, Feng Y, Fan X, et al. Recent advances in glyphosate biodegradation [J]. Applied Microbiology and Biotechnology, 2018, 102(12): 5033-5043.
[5] Manas F, Peralta L, Raviolo J, et al. Genotoxicity of AMPA, the environmental metabolite of glyphosate, assessed by the Comet assay and cytogenetic tests [J]. Ecotoxicology and Environmental Safety, 2009, 72(3): 834-837.
[6] 王飞翔, 李燕虹, 樊振江, 等. 草甘膦的动物毒性及其检测研究进展[J]. 现代牧业, 2017, 1(2): 42-46. Wang F X, Li Y H, Fan Z J, et al. Research advances in glyphosate animal toxicity and its detection methods [J]. Modern Animal Husbandry, 2017, 1(2): 42-46.
[7] Guilherme S, Santos M A, Gaivão I, et al. DNA and chromosomal damage induced in fish (L.) by aminomethylphosphonic acid (AMPA)—the major environmental breakdown product of glyphosate [J]. Environmental Science and Pollution Research, 2014, 21(14): 8730-8739.
[8] 杨亚琴, 冯书惠, 胡永建, 等. 气相色谱-质谱法测定绿茶中草甘膦和氨甲基膦酸残留量[J]. 茶叶科学, 2020, 40(1): 125-132. Yang Y Q, Feng S H, Hu Y J, et al. Determination of glyphosate and aminomethylphosphonic acid residue in green tea by gas chromatography-mass spectrometry [J]. Journal of Tea Science, 2020, 40(1): 125-132.
[9] Kanissery R, Gairhe B, Kadyampakeni D, et al. Glyphosate: its environmental persistence and impact on crop health and nutrition [J]. Plants (Basel, Switzerland), 2019, 8(11): 499. doi: 10.20944/preprints201909.0301.v1.
[10] 杨梅, 孙思, 刘文锋, 等. 超高效液相色谱-串联质谱法测定茶叶中草甘膦和草铵膦的残留量[J]. 食品科学, 2019, 40(10): 337-343. Yang M, Sun S, Liu W F, et al. Determination of glyphosate and glufosinate-ammonium residues in tea by UPLC-MS/MS [J]. Food Science, 2019, 40(10): 337-343.
[11] 王鹏杰, 郑玉成, 林浥, 等. 茶树基因家族的全基因组鉴定及表达分析[J]. 西北植物学报, 2019, 39(3): 38-46. Wang P J, Zheng Y C, Lin Y, et al. Genome-wide identification and expression analysis ofgene family in[J]. Acta Botanica Boreali-Occidentalia Sinica, 2019, 39(3): 38-46.
[12] 陈磊. HPLC-MS/MS同时检测乌龙茶中草铵膦、草甘膦和氨甲基膦酸残留[J]. 茶叶科学技术, 2014(1): 25-31. Chen L. Simultaneous detection of glufosinate, glyphosate and aminomethylphosphonic acid residues in oolong tea by HPLC-MS/MS [J]. Tea Science and Technology, 2014(1): 25-31.
[13] Tong M, Gao W, Jiao W, et al. Uptake, translocation, metabolism, and distribution of glyphosate in nontarget tea plant ((L.) O.Kuntze) [J]. Journal of Agricultural and Food Chemistry, 2017, 65(35): 7638-7646.
[14] 叶美君, 陆小磊, 刘相真, 等. 柱前衍生-超高效液相色谱-串联质谱测定茶叶中草甘膦、草铵膦及主要代谢物氨甲基膦酸残留[J]. 色谱, 2018, 36(9): 873-879. Ye M J, Lu X L, Liu X Z, et al. Pre-column derivatization-ultra high performance liquid chromatography-tandem mass spectrometry for determination of glyphosate and glyphosate in tea leaves and residues of aminomethylphosphonic acid, the main metabolite [J]. Chinese Journal of Chromatography, 2018, 36(9): 873-879.
[15] Gomes M P, Smedbol E, Chalifour A, et al. Alteration of plant physiology by glyphosate and its by-product aminomethylphosphonic acid: an overview [J]. Journal of Experimental Botany, 2014, 65(17): 4691-4703.
[16] 宋宏峰, 郭磊, 张斌斌, 等. 除草剂对毛桃幼苗生长与光合的影响[J]. 园艺学报, 2014, 41(11): 2208-2214. Song H F, Guo L, Zhang B B, et al. Effects of herbicides on growth and photosynthesis ofSeedlings [J]. Acta Horticulturae Sinica, 2014, 41(11): 2208-2214.
[17] 郭磊, 张斌斌, 沈江海, 等. 草甘膦和百草枯对毛桃幼苗根系及地上部生长的影响[J]. 应用生态学报, 2020, 31(2): 524-532. Guo L, Zhang B B, Shen J H, et al. Effects of glyphosate and paraquat on the growth of root and aboveground part ofseedlings [J]. Chinese Journal of Applied Ecology, 2020, 31(2): 524-532.
[18] 陈英杰, 何美敬, 杨鑫雷, 等. 不同植物学类型花生资源对草甘膦耐受性研究[J]. 核农学报, 2018, 32(5): 978-985. Chen Y J, He M J, Yang X L, et al. Tolerance of peanut resources to glyphosate in different botanical types [J]. Journal of Nuclear Agricultural Sciences, 2018, 32(5): 978-985.
[19] 潘敏, 王萌, 李晓娜, 等. 草甘膦对巴西橡胶树芽接苗叶片形态和生理指标的影响[J]. 热带作物学报, 2016, 37(1): 59-64. Pan M, Wang M, Li X N, et al. Effects of glyphosate on leaf morphology and physiological indexes of grafted seeding ofMüll. Arg [J]. Journal of Tropical Crops, 2016, 37(1): 59-64
[20] 高万君, 张永志, 童蒙蒙, 等. 茶园常用除草剂田间药效试验与残留动态[J]. 茶叶科学, 2019, 39(5): 587-594. Gao W J, Zhang Y Z, Tong M M, et al. Weeds control effect and residues of several herbicides in tea gardens [J]. Journal of Tea Science, 2019, 39(5): 587-594.
[21] Smedbol É, Lucotte M, Maccario S, et al. Glyphosate and aminomethylphosphonic acid content in glyphosate-resistant soybean leaves, stems, and roots and associated phytotoxicity following a single glyphosate-based herbicide application [J]. Journal of Agricultural and Food Chemistry, 2019, 67(22): 6133-6142.
Study on the Distribution of Glyphosate and Its Metabolite Aminomethylphosphonic Acid in
GUO Yongchun1, CHEN Jinfa2, ZHAO Feng3*, WANG Shuyan1, WANG Pengjie1, ZHOU Peng4, OUYANG Liqun4, JIN Shan1, YE Naixing1*
1. College of Horticulture, Fujian Agriculture and Forestry University/Key Laboratory of Tea Science in Universities of Fujian province, Fuzhou 350002, China; 2. National Engineering Research Center for Tea Quality-and-Safety, Anxi 362400, China;3. School of Pharmacy, Fujian University of Chinese Medicine, Fuzhou 350122, China; 4. Fujian Inspection and Research Institute for Product Quality, Fuzhou 350002, China
To study the transport and metabolism of glyphosate, different doses of glyphosate were quantitatively sprayed into young and adult tea plants (Young: 0.9 g·m-2. Adult: 1.5 g·m-2, 4.5 g·m-2and 15 g·m-2) and samples were collected at different times (1, 4, 7, 15 d and 40 d) to determine the contents of glyphosate and its main metabolite aminomethylphosphonic acid in various parts of tea plants. The results show that the order of glyphosate content in tea plants from high to low was root, leaf and stem after spraying glyphosate on the root of tea plant. Aminomethylphosphonic acid was mainly accumulated in the roots of tea plants, and it could also be detected in the stems and leaves of young tea plants (0-0.33 mg·kg-1). However, no aminomethylphosphonic acid was detected in the stems and leaves of adult tea plants. After 40 d of application, glyphosate and aminomethylphosphonic acid were not detected in the roots, stems and leaves of young tea plants at a dose of 0.9 g·m-2. However, they were still detected in the roots of adult tea plants at a dose of 1.5-15 g·m-2(glyphosate: 2.26-26.73 mg·kg-1, aminomethylphosphonic acid: 0.21-2.59 mg·kg-1). Glyphosate residues in both stem and leaves of adult plants were low (0-0.29 mg·kg-1). In this study, through field simulation experiments, the transfer, metabolism and enrichment rules of glyphosate in tea plants after being ingested were analyzed, which could provide a reference for scientific control and risk assessment of glyphosate in tea gardens.
, glyphosate, aminomethylphosphonic acid, residue, distribution
S571.1;S482
A
1000-369X(2020)04-510-09
2020-03-01
2020-04-09
福建农林大学茶产业链科技创新与服务体系建设项目(2020-01)、国家茶叶质量安全工程技术研究中心开放课题(2018NTQS0301)、福建农林大学园艺学院优秀硕士学位论文资助基金(2019S01)
郭永春,女,硕士研究生,主要从事茶树栽培育种与生物技术方面的研究。
zhaofeng0591@fjtcm.edu.cn;ynxtea@126.com
投稿平台:http://cykk.cbpt.cnki.net

