茶树CsAAPs亚家族基因的克隆与表达分析
郭玲玲,张芬,成浩,韦康,阮丽,吴立赟,王丽鸳
茶树亚家族基因的克隆与表达分析
郭玲玲,张芬,成浩,韦康,阮丽,吴立赟,王丽鸳*
中国农业科学院茶叶研究所/国家茶树改良中心,浙江 杭州 310008
采用RT-PCR技术,从龙井43中成功克隆了5个茶树(Amino acid permeases,氨基酸通透酶)基因。氨基酸序列比对结果表明,5个CsAAPs亚家族蛋白的序列同源性较高,为70.27%。根据氨基酸序列同源性构建系统发育树,结果显示5个CsAAPs分属3组。生物信息学分析表明,CsAAPs均含有9~10个跨膜区域和16~18个AAP保守基序。为了研究该亚家族对氮素的响应情况,选用3个茶树品种的扦插苗为试验材料,氮饥饿两周后,分别供应不同浓度的NH4NO3,然后利用qRT-PCR对在不同组织、氮素水平及茶树品种中的表达情况进行分析。研究发现在营养组织中均有表达,但是存在一定的组织表达差异,其中在茎中表达量最高,的主要表达部位为根和茎。在给氮素饥饿处理的茶苗从新供氮之后,的基因表达在3个氮素利用效率不同的品种间差异较大;在氮高效品种中茶302茎中表达的和,可以快速地对低氮条件做出响应,在低氮处理3 h后,基因表达水平明显增加。此研究预示着亚家族在茶树体内可能通过复杂的氨基酸转运参与氮代谢调控。
茶树;氨基酸通透酶;基因克隆与表达;氮素
氮素是植物生长发育过程中必需的营养元素之一,是限制植物产量的关键因子[1]。茶树作为重要的叶用经济作物,对氮素的需求量大,因此研究茶树中氮素吸收和转运对提高和改善茶树的产量和品质具有重要的意义[2]。植物中对氮素利用效率的研究主要集中在氮吸收[3-4]、分配及代谢调节[5-6]。氨基酸是茶叶的重要品质成分及氮素贮存形式,茶叶中的鲜爽滋味主要依赖于游离氨基酸的含量,同时它也是茶树体内核酸、叶绿素、线粒体以及次生代谢产物的前体等物质的氮素来源[2]。茶树根系对氮素的吸收以无机态氮为主,即铵态氮(NH4+-N)和硝态氮(NO3--N),无机态氮在根部被同化为谷氨酰胺和茶氨酸等氨基酸,并以此形式被运送到地上部[2]。氨基酸在源库器官之间,以及细胞内和细胞间的转运,均离不开氨基酸转运蛋白[7]。
氨基酸转运蛋白是位于生物膜上用以吸收转运氨基酸的蛋白家族,它广泛存在于动物和植物中,且在细菌、真菌以及酵母中也有发现。根据功能和序列同源性将氨基酸转运蛋白分为2个大家族,包括:ATF超家族(Amino acid transporter family)和APC超家族(Amino acid polyamine and choline transporters superfamily)[8]。其中ATF家族包括6个亚家族,分别为:AAPs(Amino acid permeases)亚家族,LHTs(Lysine histidine transporters)亚家族,ProTs(Proline transporters),-GATs(-aminobutyric transporters)亚家族,ANTs(Aromatic and neutral amino acid transporters)亚家族,AUX(Auxin-resistant family)亚家族[9]。
AAPs亚家族能够广泛的吸收转运各种氨基酸[10-11],可能参与根部以及韧皮部和木质部氨基酸的转运[12-13]。该亚家族基因在拟南芥()中有8个基因成员,~,在根、茎、叶、花、种子中均有表达。除外,其他各基因成员能以1∶1的比例将质子和氨基酸共转运到细胞中[14-15]。可以通过介导脯氨酸的吸收,增加拟南芥对外源脯氨酸的积累,以提高植物耐盐性[16]。菜豆中氨基酸转运蛋白PvAAP1可在木质部和韧皮部进行氨基酸的装载,然后转运氨基酸到子叶中供种子发育和化合物的积累[17]。参与氨基酸在韧皮部的装载和向胚中转运氨基酸的生理过程。拟南芥中的主要在根部表达,推测其在土壤中有吸收氨基酸的功能[18]。而蓖麻中的主要表达部位在源库组织中,被认为可能在蛋白质合成的氨基酸积累中发挥更大的作用[19]。在田间相关浓度下,其对氨基酸根部吸收有重要作用[20],吸收氨基酸类型多为阳离子氨基酸[21];拟南芥的突变体能够影响韧皮部氨基酸的组成情况[12]。同时Marella等[22]发现和可以通过调控拟南芥氨基酸的转运,进而影响其根部根结线虫的寄生和繁殖。另有研究报道,衰老、水、盐和高温等胁迫条件能够对氨基酸转运蛋白起到诱导作用[23-26];植物在缺氮的环境中,也会增强对氨基酸的吸收,这表明土壤氮素养分缺乏可能会诱导植物根系合成氨基酸转运载体[27]。Dong等[28]从茶树全基因组中筛选得到茶树氨基酸通透酶9个,CsAAP1~9;同时发现除CsAAP3、CsAAP7、CsAAP9外,其余6个CsAAPs对茶氨酸有较高的亲和性,其中CsAAP1与茶氨酸从根到新生部位的运输高度相关。
本研究基于课题组前期经不同氮素浓度处理后得到的茶树转录组测序结果,筛选获得14条亚家族成员基因序列,以龙井43的叶片、茎及根为试验材料,最终克隆得到5个茶树亚家族基因的全长序列,分析它们编码氨基酸的基本特征,并初步探讨了该亚家族基因在不同组织和不同氮素浓度条件下的表达特点和响应规律,以期揭示茶树氨基酸转运、分布及氮代谢的分子调控机制,从而为氮素高效型茶树品种的筛选及选育提供研究基础。
1 材料与方法
1.1 试验材料及处理
分别取龙井43(LJ43)的嫩叶(一芽一叶)、成熟叶、茎和根,转入液氮中速冻处理,并于–80℃冰箱保存,以用于后续的克隆试验。选用龙井43、中茶108(ZC108)和中茶302(ZC302)一年生无性系茶树幼苗水培于中国农业科学院茶叶研究所温室中,温度控制在26℃左右,湿度为60%~70%,光照时间为白天14 h,夜晚10 h。水培所用营养液配方参照Ruan等[29]的方法,采用小型通气泵全天24 h通气,以保证根系的通氧量。在茶苗生长稳定且长势良好时,对3个品种的嫩叶、成熟叶、茎和根分别进行取样,于蒸馏水中清洗,擦干后迅速转入液氮中,–80℃保存备用,用于后续的组织特性分析。与此同时,茶苗进行氮饥饿处理两周,随后均转入氮素浓度为0.2 mmol·L-1(低氮水平),2 mmol·L-1(正常氮素水平)和10 mmol·L-1(高氮水平)的营养液中培养,氮源为NH4NO3,2 d换1次营养液。每个处理设3次重复,分别于处理0、3、72 h取样,第1次取样时间为上午9时,每个时间点取3株,分组织清洗后转入液氮,于–80℃保存备用。
1.2 CsAAPs亚家族基因克隆及测序
总RNA的提取和cDNA的合成方法参见文献[30]。
在课题组前期研究的基础上,以基因名称“amino acid permease”进行搜索、FPKM(Fragments perKilobase million)值(>5)以及序列长度等为参考条件,筛选得到茶树AAPs亚家族基因序列14条,将具有包含最长CDS区域的基因序列利用软件Primer premier 5进行PCR扩增引物设计,如表1所示,克隆得到基因序列,随后连接PMD-18T载体(TAKARA)并转化大肠杆菌,挑取阳性克隆送生工生物工程(上海)股份有限公司进行测序。将测序正确的序列与Wei等[31]发布的CSS(var.)基因组序列进行比对验证,该基因组是对杂合度较低的茶树品种舒茶早进行测序得到的。
1.3 CsAAPs亚家族基因的生物信息学分析
经测序所得的正确核苷酸序列,利用Editseq软件查询其开放阅读框(Open reading frame,ORF)并对编码的氨基酸序列进行推导;使用NCBI数据库中的Blastp工具对推导获得的蛋白质序列进行同源性比对。通过在线工具ProtParam(http://web.expasy.org/protparam)在线软件计算推导蛋白质的相对分子质量等基本理化性质;利用Protscale(http://web.expasy.org/protscale)进行蛋白的亲水性/疏水性分析;SignalP 4.1(www.cbs.dtu.dk/services/SignalP)进行蛋白信号肽预测;ProtCompVersion 9.0(http://linuxl.Softberry.com/berry.phtml)进行蛋白的亚细胞定位分析;TMHMM(http://www.cbs.dtu.dk/services/TMHMM)进行蛋白跨膜结构域分析。利用MEGA 7对茶树CsAAPs蛋白序列和拟南芥()、葡萄()、可可()、烟草()、咖啡()等的AAPs蛋白序列进行序列同源性分析。采用NCBI的CDD(Conserved domain database)在线数据库对氨基酸序列进行保守结构域分析。使用在线软件MEME[32]预测5个物种中AAPs亚家族基因蛋白的功能结构域,参数条件如下:基序为20个,长度为6~50个氨基酸。使用DNAMAN软件对CsAAPs亚家族蛋白序列进行同源比对分析。

表1 基因克隆引物
1.4 CsAAPs亚家族基因的表达分析
总RNA的提取方法参见文献[30],cDNA的合成根据天根生化科技(北京)有限公司的FastKing cDNA第一链合成试剂盒说明书进行反转录。
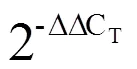
2 结果与分析
2.1 茶树CsAAPs亚家族基因克隆
茶树转录组中筛选得到的14条序列经引物设计后,以LJ43嫩叶、成熟叶、茎和根的混合cDNA为模板,通过RT-PCR方法,成功克隆得到5条亚家族基因。经DNA测序,发现克隆得到的序列与转录组数据库中的CDS序列长度一致,仅存在个别的碱基差异,部分序列有个别氨基酸差异。根据序列功能预测的基本信息(表3)及Blast结果,将基因分别命名为、、、、,并将序列提交到GenBank数据库中,登录号分别为MK532959、MK532960、MK532961、MK532962、MK532963。
在茶树基因组KEGG注释信息中以“amino acid permease”为条件进行搜索,得到68条注释信息为氨基酸通透酶的序列,其中63注释信息为“amino acid permease 7”,1条注释信息为“amino acid permease 2”,1条注释信息为“amino acid permease 8”,2条注释信息为“amino acid permease”。把克隆得到的该亚家族基因序列与CSS基因组[26]进行比对验证,各基因所对应的基因组Scaffold编号分别为Scaffold3879:394084:396743、Scaffold4449:360031:379573、Scaffold13481:217697:219993、Scaffold694:1372452:1390756和Scaffold2943:1011332:1018534。、、和比对到的序列片段长度分别为1 452、1 467、1 311 bp和1 453 bp,且相似度均在99%及以上。同时发现CSS基因组中的仅有805 bp的片段,远短于克隆得到的序列,原因可能是CSS基因组中未拼接到完整的序列。
表2 荧光定量PCR引物
表3 茶树CsAAPs亚家族信息
2.2 茶树CsAAPs亚家族基因序列的生物信息学分析
2.2.1 系统进化分析及结构域预测
利用MEGA 7软件将CsAAPs蛋白序列与拟南芥、葡萄、可可、烟草和咖啡中的AAPs亚家族共23条蛋白序列构建亲缘关系树。由图1可见,AAPs亚家族主要被分为3组,其中组1中包括AAP3和AAP4,组2包括AAP6和AAP8,组3仅包括AAP7。不同茶树CsAAPs与其他物种的AAPs分别聚类到同一小组中,这表明了茶树的CsAAPs亚家族基因在进化上是相对保守的。使用MEME在线软件分析,结果如表4和图2所示,5个基因包含20个保守基序,其中保守基序的motif 1—motif 14以及motif 20在亚家族中广泛存在。而motif 15只存在于组3的中;motif 16只存在于中;motif 17存在于组1的和中;motif 19只存在于中。采用NCBI的CDD(Conserved domain database)在线数据库对氨基酸序列进行保守结构域分析,结果显示,5个基因均包含Aa_trans(Transmembrane amino acid transporter protein,登录号:pfam01490)结构域,归属SLC5-6-like_sbd亚家族,该亚家族具有转运氨基酸的功能,可将Na+与糖、氨基酸等共同转运。DNAMAN序列比对结果如图3所示,CsAAPs亚家族蛋白的同源性较高,为70.27%。其中CsAAP3和CsAAP4的序列相似度达77.62%,而与其他序列的相似度不足60%。
2.2.2 编码氨基酸的理化性质分析
如表5所示,利用Protparam对CsAAPs的氨基酸序列进行理化性质预测,结果显示CsAAP3、CsAAP4、CsAAP6、CsAAP7和CsAAP8分别编码483、485、483、464、480个氨基酸;相对分子量最大为53.48 kDa,最小为51.35 kDa。CsAAP3、CsAAP4、CsAAP6、CsAAP8理论等电点分别为8.94、8.86、9.14、8.78,均为碱性蛋白质;CsAAP7的理论等电点4.93,为酸性蛋白质。CsAAPs基因编码蛋白的稳定指数均在30以上,说明该亚家族转运蛋白为稳定蛋白。5个CsAAP蛋白的平均疏水性值大于0.300,说明CsAAPs亚家族转运蛋白为疏水蛋白,与Protscale的预测结果一致。利用SignalP 4.1进行信号肽预测,结果显示没有明显的信号肽序列,说明该亚家族蛋白为非分泌型蛋白。通过Softberry网站在线预测蛋白的亚细胞定位,显示CsAAPs蛋白定位在质膜上,为膜蛋白。同时,利用TMHMM对CsAAPs亚家族蛋白序列进行跨膜区的预测,结果显示CsAAP4和CsAAP6有9个跨膜区,CsAAP3、CsAAP7和CsAAP8有10个跨膜区。
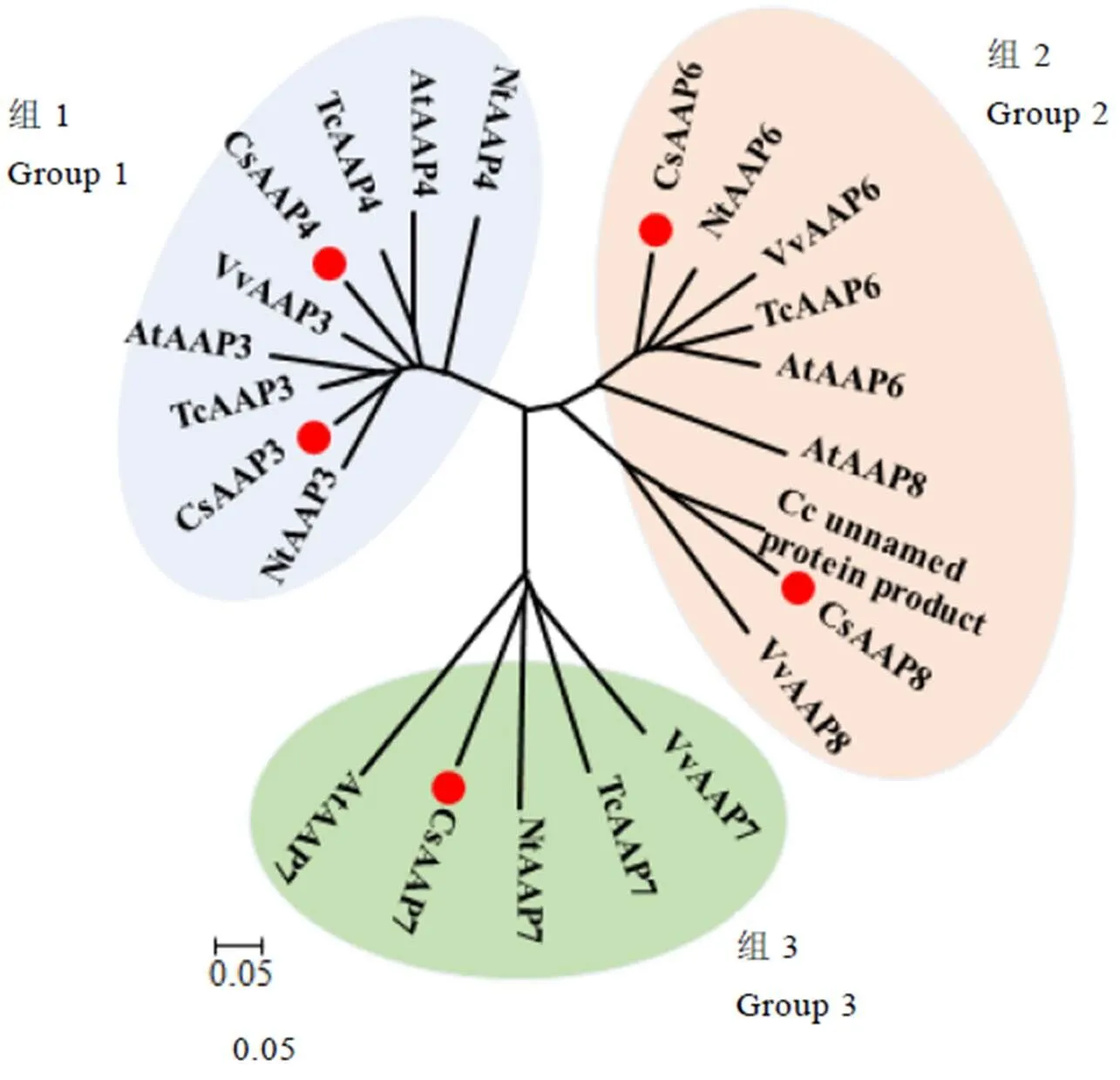
注:蛋白登录号:AtAAP3:Q39134,AtAAP4:Q9FN04,AtAAP6:P92934,AtAAP7:Q9FF99,AtAAP8:O80592,VvAAP3:A5B880,VvAAP6:E0CNV4,VvAAP7:D7UAP6,VvAAP8:F6H362,NtAAP3:A0A1S4B456,NtAAP4:A0A1S4BEE9,NtAAP6:A0A1S3ZXD5,NtAAP7:A0A1S3Z1U3,TcAAP3:A0A061FHJ7,TcAAP4:A0A061DJ76,TcAAP6:A0A061FE42,TcAAP7:A0A061F4P0,Cc unnamed protein product:A0A068UID0
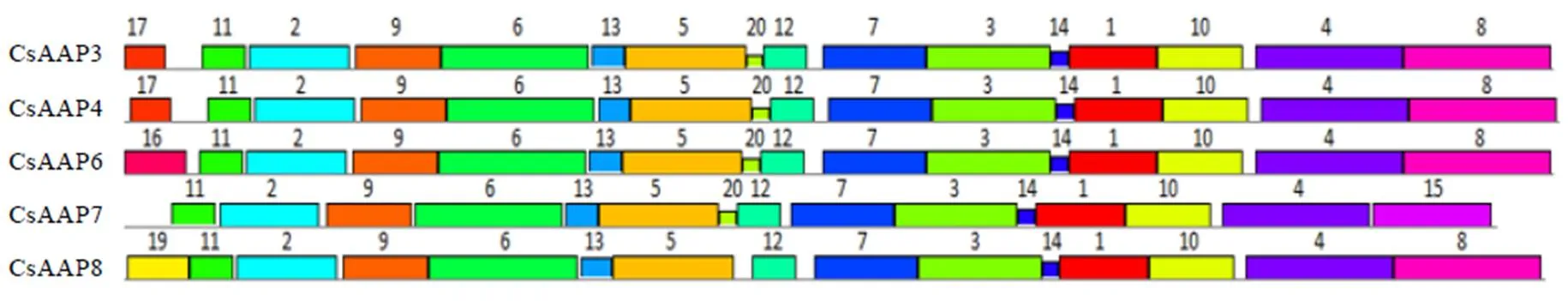
图2 CsAAPs亚家族基因保守基序(1—20)

图3 CsAAPs亚家族基因氨基酸序列比对
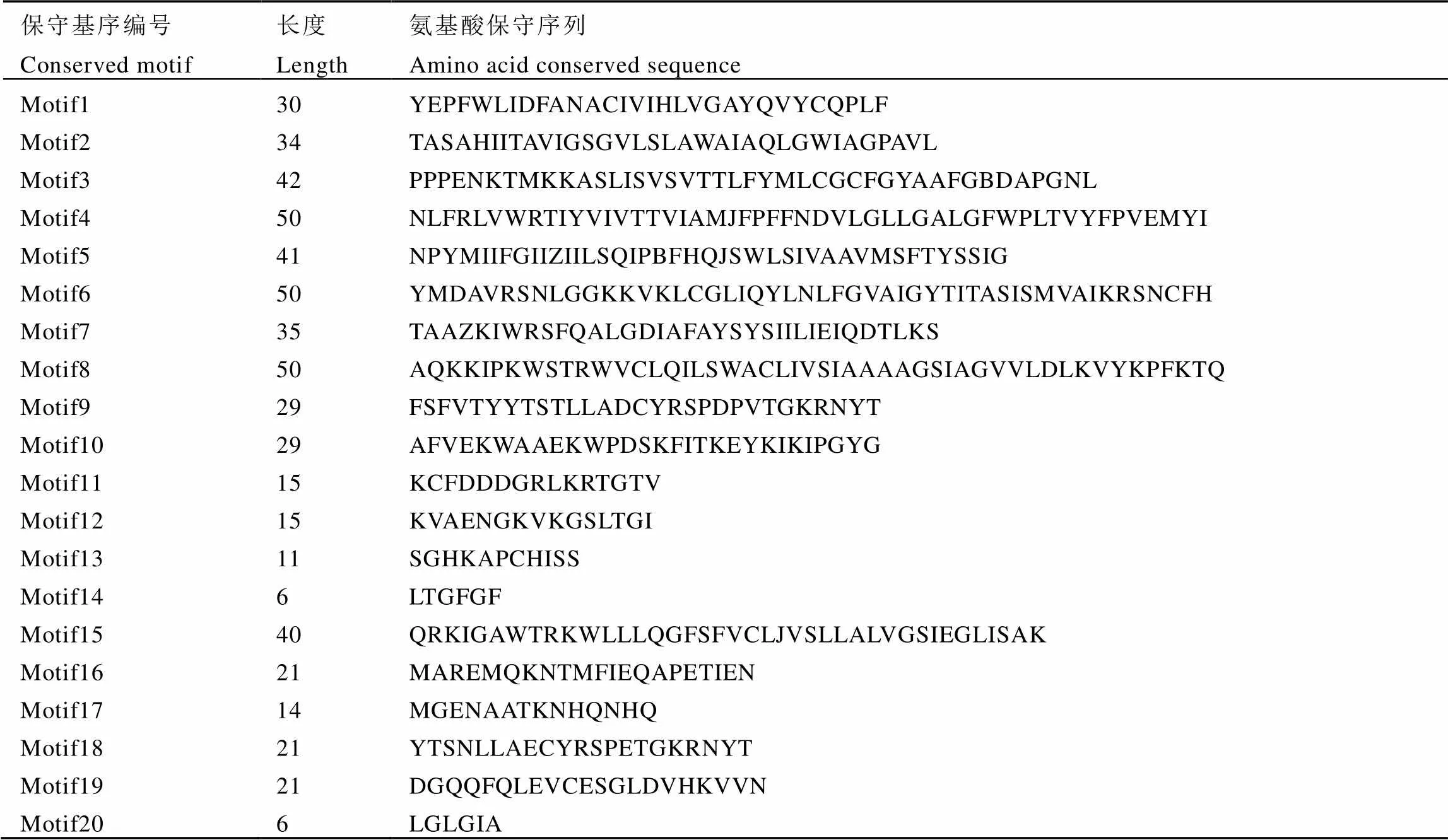
表4 茶树CsAAP亚家族蛋白保守序列
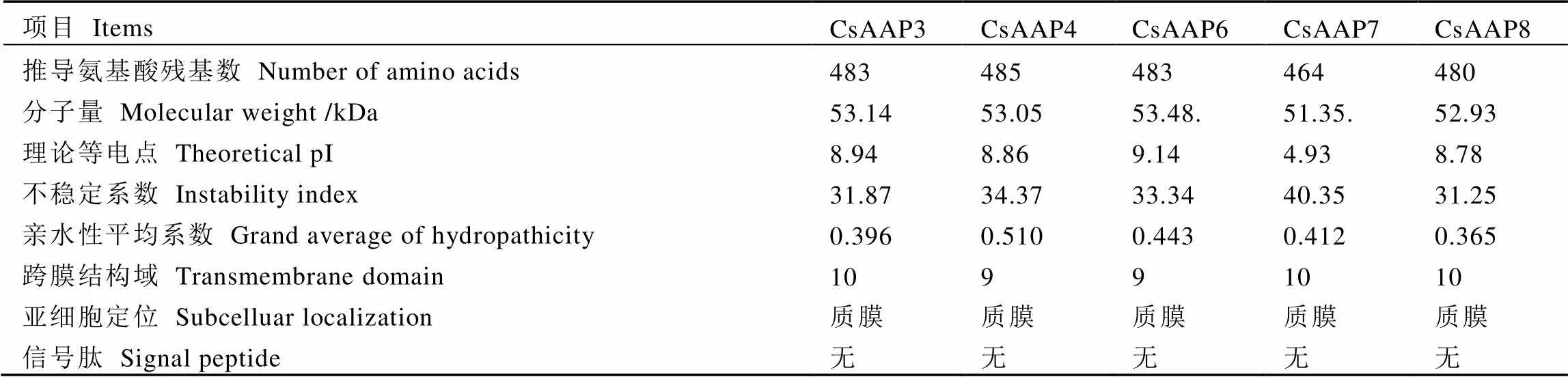
表5 茶树CsAAPs亚家族蛋白理化性质分析
2.3 茶树CsAAPs亚家族基因的组织表达特性及其对氮素响应的分析
2.3.1 组织表达特性分析
荧光定量PCR分析5个基因在3个茶树品种嫩叶、成熟叶、茎和根中的表达模式,利用热图软件MeV绘制热图后对结果进行展示(图4)。亚家族基因在茶树3个品种以及4个组织中都有表达,但表达情况不同。在品种间的表达趋势一致,但表达量上存在差异。在组织中表达差异较大,在茎中表达量最高,其次为成熟叶;主要表达部位为成熟叶;在各组织中基因表达水平差异不大,但在叶片中的表达量高于根和茎;主要在嫩叶和茎中表达;主要在根和茎中表达。
2.3.2对氮素响应的基因表达分析
依据各在的组织表达特性,利用荧光定量PCR,分析嫩叶、成熟叶、根及茎4个组织中对氮素响应的表达变化情况,并重点关注了茶树在不同氮素水平下和不同品种中的表达规律。
利用热图软件MeV对各基因在不同处理下的相对表达量绘制热图,从图5中可以发现:氮素处理后,各基因在不同氮素浓度水平和不同品种间的表达情况存在较明显的差异。经分层聚类(HCL,Hierarchical clustering)后,各基因在氮素处理下被分成两大组。其中一组包含了在LJ43嫩叶和茎中表达的基因(、、、)和在ZC108嫩叶中表达较高的基因(和);其余处理聚在另一组。在72 h氮素处理条件下,在3个品种的茎中上调表达,其中LJ43在氮素浓度为10 mmol·L-1处理下,表达上调;ZC108中,在3个氮素浓度处理后明显上调;ZC302中在氮素浓度为0.2 mmol·L-1和2 mmol·L-1处理下表达上调。3 h氮素处理后,在LJ43中的响应程度弱于ZC108和ZC302。成熟叶中的经氮素处理3 h,在3个氮素水平下表达量均升高,仅在ZC302中表达存在明显差异,正常氮素水平显著高于低氮和高氮水平。在嫩叶中的表达量低于成熟叶,但在不同茶树品种及氮素处理水平条件下,其表达的变化趋势与成熟叶中一致。2 mmol·L-1氮素处理72 h,在LJ43中的表达较ZC108和ZC302突出。在不同氮素浓度下,在3个品种中的表达情况差异较大,被聚类在不同的组中。LJ43中,长时间且高浓度的氮素处理对基因的表达量影响较大。在ZC302中的表达明显高于ZC108,但在两个品种中的表达变化趋势类似。在茎中表现较为突出的和,在3 h氮素处理后,随氮素浓度的升高,其在ZC302茎中的表达量呈降低趋势。
3 讨论
氨基酸通透酶(AAPs)对氨基酸的吸收转运具有广泛的选择性,氨基酸种类不同,其亲和力也有所不同[7]。研究报道,植物氨基酸转运蛋白在植物抗缺氮、水、盐和高温等胁迫条件中发挥着作用。茶氨酸是茶树中特有的氨基酸,在根部合成之后,被转运到地上部。研究发现6个CsAAPs对茶氨酸有较高的亲和性,其中CsAAP1与茶氨酸从根到新生部位的运输高度相关[23],表明亚家族基因在茶树氮素分配及转运中具有重要作用。茶树的氮代谢具有显著区别与其他植物的特点。在茶树中,茶氨酸被作为氮素长途转运和储存的重要形式,因此氨基酸转运尤其是与茶氨酸转运相关的氨基酸通透酶(AAPs)基因的研究就显得尤为重要。
本研究基于茶树转录组数据克隆了茶树中5个基因,即、、、、的序列全长,并将序列提交到GenBank数据库,登录号分别为MK532959、MK532960、MK532961、MK532962、MK532963。与CSS基因组序列进行了比对验证,发现除外,该亚家族的其他序列与CSS基因组中的序列基本一致。经氨基酸序列比对分析发现,该家族编码的氨基酸序列与其他物种AAP亚家族具有较高的同源性,说明该亚家族基因在进化上是保守的,可能与其他物种中的AAPs基因具有类似转运氨基酸的功能。
组织表达特性分析显示亚家族基因在3个茶树品种的嫩叶、成熟叶、茎和根中均有表达,且该亚家族基因的组织表达特性在3个品种间的表达趋势是一致的。但亚家族基因在不同组织中的表达水平存在差异,说明该亚家族基因在茶树的各组织中是普遍存在的,且在特定的组织部位行使其功能。拟南芥主要在根中表达[34],而大豆()中的在叶和茎中表达较水平较高,在根中表达水平低,具有转运谷氨酸的功能[35]。茶树中的在成熟叶和茎中表达量较高,与大豆中的表达模式类似,因此推测可能参与茶树中谷氨酸的运输。与拟南芥中类似[15],也主要在成熟叶中进行表达。拟南芥中的研究发现在木质部薄壁组织中表达,可能是由于木质部氨基酸浓度较低,需要高亲和力的细胞,因此推测AtAAP6可能参与木质部的氨基酸吸收;表达部位主要在幼嫩的果荚和种子[36]。而在茶树各组织器官中均有检测到,且组织间的差异不大。本研究结果显示,茶树在嫩叶和茎中表达量较高;在茎和根中的表达量较高。
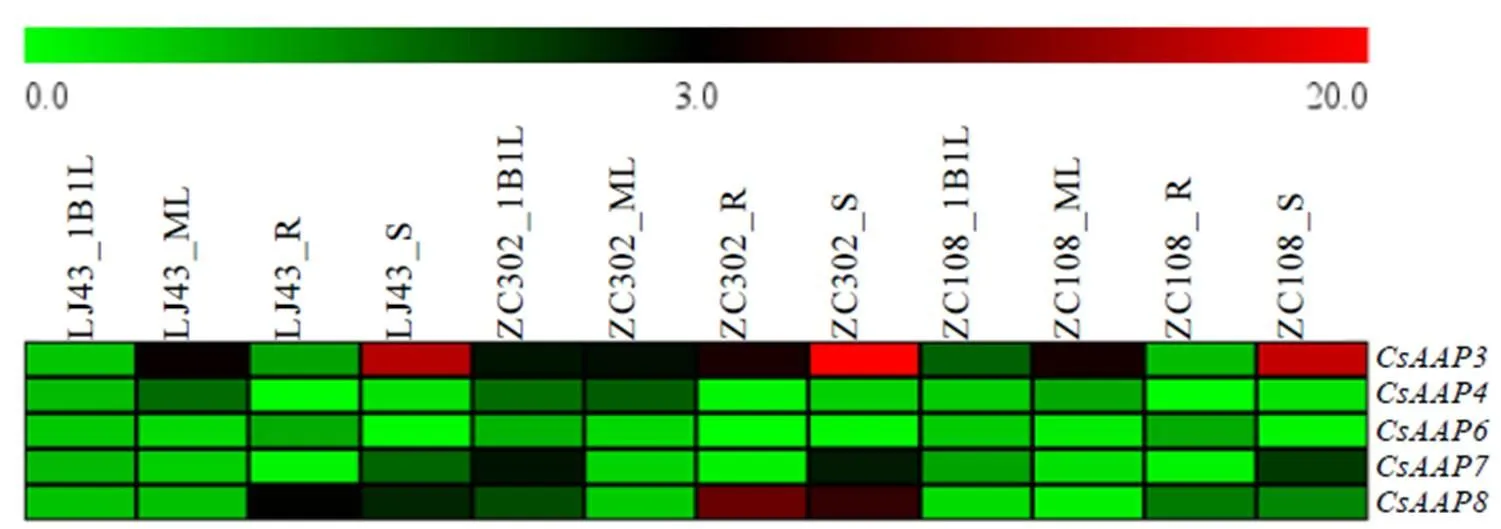
注:1B1L为嫩叶(一芽一叶);ML为成熟叶;S为茎;R为根。下同
实时荧光定量PCR结果显示,茶树亚家族基因除和外,其余3个基因的表达量在不同氮素水平及3个品种中变化较为明显。有文献报道LJ43为高氮高效的品种,能适应氮素浓度较高的环境,在低氮条件下的氮素利用效率却较低[37];ZC302和ZC108在低氮条件下的吸收效率较高[38]。在氮高效品种中茶302茎中和可以快速地对低氮条件做出响应,在低氮处理3 h后,基因表达水平明显增加。而LJ43中,不能快速地对低氮条件做出响应,仅在高氮处理72 h后,其表达水平才增加。这些研究预示,CsAAP亚家族基因表达对低氮条件的快速响应及在提高茶树低氮条件下的氮素利用效率中具有重要作用。
氨基酸的转运是茶树体内氮代谢的重要一环,本研究结合生物信息学、组织表达特性以及在不同氮素条件下表达模式与基因表达的品种间差异进行探究,初步筛选出了氨基酸通透酶亚家族中与茶树氮代谢联系较为紧密的基因,即和。二者在茎中的表达量较高,茎为植物体内长距离运输的重要组织部位,推测它们可能参与茶树中氨基酸由源到库的运输,但负责转运氨基酸的类型仍需进一步研究确认。本研究同时发现,该亚家族基因对低氮条件有着较快的响应,可能在低氮条件下茶树氮素利用效率的提高等方面发挥重要作用。
[1] Frink C R, Waggoner P E, Ausubel J H. Nitrogen fertilizer: retrospect and prospect [J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1175-1180.
[2] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003. Wan X C.Tea biochemistry [M]. 3rd ed. Beijing: China Agriculture Press, 2003.
[3] Araus V, Vidal E A, Puelma T, et al. Members of BTB gene family of scaffold proteins suppress nitrate uptake and nitrogen use efficiency [J]. Plant Physiology, 2016, 171(2): 1523-1532.
[4] Chen J G, Fan X R, Qian K Y, et al. pOsNAR2.1:OsNAR2.1 expression enhances nitrogen uptake efficiency and grain yield in transgenic rice plants [J]. Plant Biotechnology Journal, 2017(15): 1273-1283.
[5] Yanagisawa S, Akiyama A, Kisaka H, et al. Metabolic engineering with Dof1 transcription factor in plants: Improved nitrogen assimilation and growth under low-nitrogen conditions [J]. Proceedings of the National Academy of Sciences, 2004, 101(20): 7833-7838.
[6] Shrawat A K, Carroll R T, Depauw M, et al. Genetic engineering of improved nitrogen use efficiency in rice by the tissue-specific expression of[J]. Plant Biotechnology Journal, 2008, 6(7): 722-732.
[7] Tegeder M. Transporters for amino acids in plant cells: some functions and many unknowns [J]. Current Opinion in Plant Biology, 2012, 15(3): 315-321.
[8] Su Y H, Frommer W B, Ludewig U. Molecular and functional characterization of a family of amino acid transporters from Arabidopsis [J]. Plant Physiology, 2004, 136(2): 3104-3113.
[9] Réjane P, Guillaume P. Regulation of amino acid metabolic enzymes and transporters in plants [J]. Journal of Experimental Botany, 2014, 65(19): 5535-5556.
[10] Fischer W N, André B, Rentsch D, et al. Amino acid transport in plants [J]. Trends in Plant Science, 1998, 3(5): 188-195.
[11] Fischer W N, Loo D D, Koch W, et al. Low and high affinity amino acid H+-cotransporters for cellular import of neutral and charged amino acids [J]. Plant Journal for Cell Molecular Biology, 2002, 29(6): 717-731.
[12] Hunt E, Gattolin S, Newbury H J, et al. A mutation in amino acid permeasereduces the amino acid content of thesieve elements but leaves aphid herbivores unaffected [J]. Journal of Experimental Botany, 2010, 61(1): 55-64.
[13] Zhang L, Tan Q, Lee R, et al. Altered xylem-phloem transfer of amino acids affects metabolism and leads to increased seed yield and oil content in[J]. The Plant Cell, 2010, 22(11): 3603-3620.
[14] Boorer K J, Loo D D, Frommer W B, et al. Transport mechanism of the cloned potato H+/sucrose co-transporter[J]. Journal of Biological Chemistry, 1996, 271(41): 25139-25144.
[15] Boorer K J, Fischer W N. Specificity and stoichiometry of the Arabidopsis H+/amino acid transporter[J]. Journal of Biological Chemistry, 1997, 272(20): 13040-13046.
[16] Wang T, Chen Y, Zhang M, et al.amino acid permease1 contributes to salt stress-induced proline uptake from exogenous sources [J]. Frontiers in Plant Science, 2017, 8: 2182. doi: 10.3389/fpls.2017.02182.
[17] Tan Q, Grennan A K, Pélissier H C, et al. Characterization and expression of French bean amino acid transporter[J]. Plant Science, 2008, 174(3): 348-356.
[18] Okumoto S, Koch W M, Fischer W N, et al. Root phloem-specific expression of the plasma membrane amino acid proton co-transporter[J]. Journal of Experimental Botany, 2004, 55(406): 2155-2168.
[19] Neelam A, Marvier A C, Hall J L, et al. Functional characterization and expression analysis of the amino acid permeasefrom castor bean [J]. Plant Physiology, 1999, 120(4): 1049-1056.
[20] Ahmad I. New insights into plant amino acid transport and its contribution to nitrogen nutrition [D]. Umeå: Swedish University of Agricultural Sciences, 2015.
[21] Svennerstam H, Ganeteg U, Näsholm T. Root uptake of cationic amino acids bydepends on functional expression of amino acid permease 5 [J]. The New Phytologist, 2008, 180(3): 620-630.
[22] Marella H H, Nielsen E, Schachtman D P, et al. The amino acid permeasesandare involved in root-knot nematode parasitism of[J]. Molecular Plant-microbe Interactions, 2013, 26(1): 44-54.
[23] Rentsch D, Hirner B, Schmelzer E, et al. Salt stress-induced proline transporters and salt stress-repressed broad specificity amino acid permeases identified by suppression of a yeast amino acid permease-targeting mutant [J]. The Plant Cell, 1996, 8(8): 1437-1446.
[24] Ueda A, Shi W, Sanmiya K, et al. Functional analysis of salt-inducible proline transporter of barley roots [J]. Plant and Cell Physiology, 2001, 42(11): 1282-1289.
[25] Meyer A, Eskandari S, Grallath S, et al., a high affinity transporter for gamma-aminobutyric acid in[J]. Journal of Biological Chemistry, 2006, 281(11): 7197-7204.
[26] Zhao H M, Ma H L, Yu L, et al. Genome-wide survey and expression analysis of amino acid transporter gene family in rice (L.) [J]. PLos One, 2012, 7(11): e49210. doi: 10.1371/journal.pone.0049210.
[27] Persson J, Gardeström P, Näsholm T. Uptake, metabolism and distribution of organic and inorganic nitrogen sources by[J]. Journal of Experimental Botany, 2006, 57(11): 2651-2659.
[28] Dong C, Li F, Yang T, et al. Theanine transporters identified in tea plants (L.) [J]. The Plant Journal, 2020, 101(1): 57-70.
[29] Ruan J Y, Gerendas J, Hardter R, et al. Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea () plants [J]. Annals of Botany, 2007, 99(2): 301-310.
[30] 张芬, 王丽鸳, 成浩, 等. 茶树亚硝酸还原酶基因的克隆及表达分析[J]. 园艺学报, 2016, 43(7): 1348-1356.
Zhang F, Wang L Y, Cheng H, et al.Molecular cloning and expression analysis of nitrite reductase genein tea plant [J]. Acta Horticulturae Sinica, 2016, 43(7): 1348-1356.
[31] Wei C, Yang H, Wang S, et al. Draft genome sequence of, var., provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(18): E4151-E4158.
[32] Bailey T, Elkan C. Fitting a mixture model by expectation maximization to discover motifs in biopolymers [J]. Proceedings of the Second International Conference on Intelligent Systems for Molecular Biology, 1994(2): 28-36.
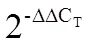
[34] Breitkreuz K E, Shelp B J, Fischer W N, et al. Identification and characterization of GABA, proline and quaternary ammonium compound transporters from[J]. Febs Letters, 1999, 450(3): 280-284.
[35] 李美美. 大豆氨基酸透性酶基因GmAAP3f功能的初步研究[D]. 天津: 南开大学, 2016.
Li M M. Preliminary study on the function of soybean amino acid permease gene GmAAP3f [D]. Tianjin: Nankai University, 2016.
[36] Okumoto S, Schmidt R, Tegeder M, et al. High affinity amino acid transporters specifically expressed in xylem parenchyma and developing seeds of[J]. Journal of Biological Chemistry, 2002, 277(47): 45338-45346.
[37] 王新超. 不同品种茶树氮素营养差异及其机制的研究[D]. 北京: 中国农业科学院, 2003.
Wang X C. Study on the genotypic difference of nitrogen nutrient and its mechanism in tea plant[(L.) O. Kuntze] [D]. Beijing: Chinese Academy of Agricultural Sciences, 2003.
[38] 刘圆. 不同氮效率茶树品种氮素吸收利用相关基因表达模式探究[D]. 北京: 中国农业科学院, 2016.
Liu Y. The altered expression of genes related to nitrogen absorption and utilization of tea cultivars with different nitrogen use efficiency [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
Molecular Cloning and Expression Analysis ofGene Subfamily in
GUO Lingling, ZHANG Fen, CHENG Hao, WEI Kang, RUAN Li, WU Liyun, WANG Liyuan*
Tea Research Institute, the Chinese Academy of Agricultural Sciences, National Center for Tea Improvement, Hangzhou 310008, China
In this study, five sequences of the amino acid permease () genes were successfully cloned from tea cultivar Longjing 43 by RT-PCR. The amino acid sequence alignment analysis revealed the high homology among the five CsAAP proteins (70.27%). Phylogenetic tree based on amino acid sequences showed that five CsAAPs could be classified into three groups. Further bioinformatics analysis demonstrated that these CsAAPs contained 9-10 transmembrane structures and 16-18 conserved AAP motifs. To investigate the response of this subfamily to nitrogen, cutting seedlings of three tea cultivars were fed with NH4NO3of different concentrations after two weeks of nitrogen starvation and then used for qRT-PCR analysis. The results show that these fivewere expressed in all vegetative tissues of tea cutting seedlings, but there were certain differences in tissue expressions. Among them,showed the highest gene expression levels in stems and the main expression sites ofwere roots and stems. The expression levels ofvaried temporallyand spatially with nitrogen treatments. The gene expression ofwas significantly changed among the tea cultivars with different nitrogen use efficiency. The expressions ofandin the stem of the high nitrogen efficient cultivar Zhongcha 302 could quickly respond to low nitrogen levels. Their gene expression levels were increased significantly after 3 h of the low nitrogen treatment. These results implies that CsAAPsubfamily might play important roles in the regulation of nitrogen metabolism through the intricate transports of amino acids in tea plants.
, amino acid permeases (AAPs), gene cloning and expression, nitrogen
S571.1;S154.1
A
1000-369X(2020)04-454-11
2019-09-15
2019-12-12
国家自然科学基金(31570695)、中央级科研院所基本科研业务费专项(1610212018004)、国家现代农业产业技术体系建设专项资金项目(CARS-19)、浙江省农业新品种选育重大专项(2016C02053)
郭玲玲,女,硕士研究生,主要从事茶树遗传育种方面的研究。
wangly@tricaas.com
投稿平台:http://cykk.cbpt.cnki.net

