阿帕替尼联合经肝动脉化疗栓塞术治疗老年中晚期原发性肝癌临床观察
李风成 程君 谭林 高学武 王金玲 徐静 李莎莎 姜宁
我国是原发性肝癌(primary liver cancer,PLC) 的高发国,由于缺乏早期诊断,确诊的病人绝大部分为中晚期,仅有不到20%的病人可行根治性切除[1]。因此研究安全有效的局部治疗方法对广大病人具有重要意义。肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是目前公认的一线局部疗法[2],但由于病人存在血供情况不同、血管畸形、动-静脉瘘等个体差异,再加之病灶数目、大小、肝功能分级、有无门静脉癌栓等情况导致TACE在不同的病人中疗效存在很大差异,且TACE术后肿瘤易生成新生血管或复发,因此联合治疗可能会达到更好的效果。阿帕替尼是我国自主研制的小分子酪氨酸激酶抑制剂,国家食品药品监督管理局(CFDA)于2014年批准其作为二线抗肿瘤药物[3],在食管-胃结合部腺癌、晚期胃腺癌治疗失败病人的治疗中,显示出了较好的抑癌效力,但对PLC中晚期病人治疗的报道较少。本研究应用阿帕替尼与TACE联合治疗71例PLC中晚期病人,对疗效和安全性进行观察,现报道如下。
1 资料与方法
1.1 一般资料 前瞻性入选我院2017年12月至2018年12月肝癌TNM分期ⅢA和ⅢB期的PLC病人152例,根据治疗方法分为2组,对照组81例采用TACE治疗,男52例,女29例,年龄60~70岁,平均(66.8±6.9)岁;观察组71例采用TACE联合阿帕替尼治疗,男46例,女25例,年龄60~71岁,平均(67.3±7.4)岁。2组年龄、病灶直径(多发病灶以各病灶最大径和)、卡氏(KPS)评分、TACE治疗次数、TNM分期、Child-Pugh分级、性别构成差异均无统计学意义(P>0.05)。见表1。

表1 2组病人一般情况比较
1.2 纳入及排除标准 本研究经医院医学伦理委员会批准。纳入标准:(1)所有病人符合国家卫计委颁布的PLC诊疗规范(2017年版)临床诊断标准或经病理穿刺确诊为PLC,TNM分期ⅢA、ⅢB期的初治病人;(2)KPS评分>80分,肝功能Child-Pugh分级A级、B级,预计生存期>3个月;(3)无TACE治疗禁忌证,无治疗药物过敏史;(4)病人对本研究知情同意。排除标准:(1)合并门静脉癌栓及其他恶性肿瘤;(2)伴心力衰竭、心律失常、脑出血、心肌梗死等严重心脑血管疾病者;(3)有明显的肾功能损害者。
1.3 方法
1.3.1 对照组:行TACE术,术前完善相关检查,充分做好术前准备,2%利多卡因局部麻醉后采用Seldinger法穿刺股动脉,造影定位确定肿瘤供血动脉后,超选择将微导管插入病灶各滋养供血动脉,注入50 mg奥沙利铂+30 mg表柔比星+5~25 mL碘化油(根据肿瘤直径计算碘化油用量,3~5 cm加入5~10 mL;5~10 cm加入10~25 mL)+造影剂混合乳化剂。最后注入液态碘化油栓塞,造影显示血供动脉血流停滞或明显减慢为栓塞终点。术毕拔管压迫止血,加压包扎穿刺点,穿刺侧肢制动6 h,术后3 d大量补液,常规予抑酸护胃、止吐、护肝等对症治疗,2个月1次,治疗终点为不良反应无法耐受或肿瘤进展。
1.3.2 观察组:TACE治疗同对照组,于术后第4天开始口服阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140105),初始剂量500 mg/d,服用1~2周后根据不良反应和耐受情况调整剂量,其中16例有明显不良反应病人减量至250 mg/d,1~3周后不良反应降级或消失逐渐增加至原剂量。服药时间至下一周期TACE治疗前4 d停药,TACE术后第4天继续服用,治疗终点为不良反应无法耐受或肿瘤进展。
1.4 观察指标 (1)病人均于首次TACE术后3、6、12个月行增强CT检查,根据结果评价疗效;(2)生存期:病人均门诊随访,随访至2019年5月或终点事件死亡,记录病人生存期;(3)不良反应:记录2组病人治疗期间不良反应,包括病理性血压升高、手足综合征、蛋白尿、骨髓抑制、腹泻、发热、疼痛、恶心呕吐等。
1.5 疗效判定 完全缓解(CR):CT检查提示靶病灶均无动脉期增强;部分缓解(PR):CT检查提示靶病灶动脉期增强,但病灶直径总和缩小>30%;疾病稳定(SD):CT检查提示靶病灶动脉期增强,但病灶直径总和缩小≤30%,或增大≤20%;疾病进展(PD):CT检查提示靶病灶动脉增强期,病灶直径总和增大>20%,或有新生病灶及病人死亡。客观缓解率(ORR)=(CR+PR)/总病例数×100%。

2 结果
2.1 2组ORR比较 观察组和对照组TACE术后3个月ORR差异无统计学意义(P>0.05)。观察组术后6、12个月 ORR均高于对照组,差异有统计学意义(P<0.05)。见表2。
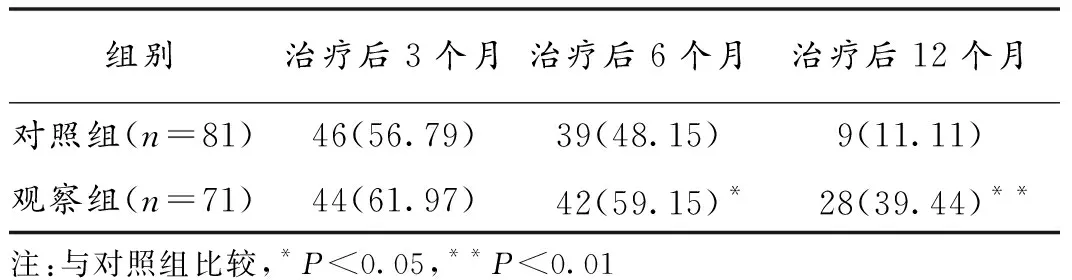
表2 2组病人ORR比较(n,%)
2.2 2组生存期比较 观察组中位生存时间为17.09个月,对照组中位生存时间为12.65个月,2组生存曲线差异有统计学意义(χ2=7.126,P=0.006)。见图1。

图1 2组病人Kaplan-Meier生存曲线图
2.3 2组不良反应发生率比较 观察组病理性血压升高、手足综合征、蛋白尿、腹泻发生率均高于对照组,差异均有统计学意义(P<0.05或P<0.01)。2组骨髓抑制、发热、疼痛、恶心呕吐发生率差异无统计学意义(P>0.05)。见表3。

表3 2组病人不良反应发生率比较(n,%)
3 讨论
血管生成是肿瘤细胞增殖和转移的重要环节。PLC的血供约75%为肝动脉,另有25%的肿瘤涉及异位血管供血[4],因此包膜内部分门静脉供血、肿瘤边缘及直径过大肿瘤病灶在TACE术后难以完全坏死。残存的肿瘤细胞增殖需大量的氧气和营养物质,由此可引起局部组织氧缺乏,可导致肿瘤生成新的血管,以克服缺氧和氧化应激引起的依赖性氧能源产生不足的问题。血管内皮生长因子(vascular endothelial growth factor,VEGF)和乏氧诱导因子-1(hypoxia inducible factor-1 alpha,HIF-1α)是调控生成新生血管的关键因子[5]。动物实验研究证实,VEGF在低糖及缺氧缺血环境中分泌均会增加,且VEGF可增加血管的通透性,利于肿瘤转移[6]。多项研究发现,TACE术后残留肿瘤组织,血清VEGF和HIF-1α水平均会升高[7-8],说明TACE术后会加重肿瘤内部缺氧,促进新生血管生成,对肿瘤增殖有促进作用。另外TACE术后侧支循环代偿性形成也可能增加残留肿瘤的增殖、复发、转移风险,使治疗变得困难,并影响病人预后。
针对TACE术后血管内皮生长因子受体(VEGFR)表达的增加及PLC的血管生成机制,理论上讲采用血管生成抑制剂与TACE联合具有协同作用,可提高疗效。阿帕替尼可竞争性高度抑制VEGFR-2的ATP结合位点,主要作用靶点为VEGFR-2/KDR,可阻止其与VEGF结合,抑制新生血管生成。体外和体内试验均显示了阿帕替尼有出色的抑癌作用。本研究结果显示,观察组TACE术后3个月ORR为61.97%,略高于对照组的56.79%,虽然差异无统计学意义,但其疗效在中长期逐渐显现;观察组术后6、12个月ORR分别为59.15%、39.44%,均高于对照组的48.15%、11.11%,且观察组中位生存时间明显长于对照组。说明阿帕替尼与TACE联合可产生协同作用,从而更好地发挥抗肿瘤作用,增加抗肿瘤的疗效,可为中晚期PLC病人提供更多选择。
化疗药物均具有细胞毒性作用,本研究TACE采用第三代铂类奥沙利铂+表柔比星方案。奥沙利铂较之前二代铂类化疗药物的作用机制相同,但其与大多数化疗药物具有协同作用,适合联合应用,且不良反应更小[9]。奥沙利铂+表柔比星方案的不良反应主要是骨髓抑制、发热、恶心呕吐,但病人均可耐受。联合阿帕替尼治疗后,观察组不良反应明显增加,其中病理性血压升高、手足综合征、蛋白尿、腹泻发生率分别为60.56%、49.30%、33.80%、25.35%,均显著高于对照组,与相关文献报道基本相符[10]。出现上述不良反应的原因可能是阿帕替尼为高选择性VEGFR抑制剂,在抗血管生成的同时会抑制自身血管的扩张效应,使血管退化致外周血管阻力增加,从而引起病理性血压升高。同时阿帕替尼在抑制VEGF的同时会损伤肾小球上皮和内皮细胞,产生蛋白尿。
综上所述,阿帕替尼联合TACE治疗中晚期PLC可提高疗效,延长病人生存期,虽然一些不良反应发生率增加,但病人获益更大。而且相关不良反应可能提示病人VEGFR对阿帕替尼靶向治疗的敏感程度,因此鼓励病人坚持治疗以获得更好的疗效。

