聚乙二醇对大豆分离蛋白美拉德反应和功能特性的影响
满朝新 谭兆伦 胡 淼 李 杨 谢凤英 齐宝坤
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
大豆分离蛋白(Soy protein isolate, SPI)通过碱溶-酸沉淀的方法从脱脂大豆粉中提取,根据离心后不同的沉降系数,SPI主要由两种球蛋白组成,即伴大豆球蛋白(7S)和大豆球蛋白(11S)[1]。SPI的亲水亲油特性使其具有良好的油-水界面吸附能力,并通过厚保护层降低界面张力,因此可作为稳定乳液的有效乳化剂[2]。但由于其结构限制,SPI的乳化性能不理想。
美拉德反应被证实是一种改善蛋白功能特性的有效方法,例如乳化性等[3]。目前,应用于蛋白改性的美拉德反应多为干热法,即在受控温度及湿度下制备蛋白-多糖复合物[4-6],这种方法通常需要数天甚至更长的时间,而且反应不受控制,容易产生过度褐变现象,所以不适用于工厂加工生产。湿法美拉德反应是在高温下制备蛋白-多糖复合物[7],这种方法加工时间较短,且能有效将反应控制在初期阶段。但这种方法缺点是:在高温环境下,蛋白大量聚集并抑制美拉德反应,使得美拉德反应程度较低[8]。
为了解决这个问题,一些研究者引入生命科学中的大分子拥挤效应。当溶液中存在高浓度大分子物质时,反应遵从排除体积理论,促进反应向总体积减少的方向移动,即结合方向移动[9-10]。且在大分子拥挤环境下,高浓度大分子物质能够极大地降低蛋白聚集的可能性[11-12]。血红蛋白、卵清蛋白、牛血清蛋白等天然蛋白与多糖都是优秀的拥挤剂,可用于模拟细胞拥挤环境[13],但这些物质易与SPI或葡聚糖(Dextran,D)发生反应,影响美拉德反应的进行,故需选择一种不与SPI及D发生反应的无关生物大分子物质。
聚乙二醇(Polyethylene glycol, PEG)是一种无毒、不与SPI和D发生反应的无关生物大分子物质,通过控制溶液中PEG的含量,可以避免不同底物浓度对溶液反应速率的影响,并获得不同拥挤程度的溶液环境。文献[14]研究了PEG对乳清分离蛋白超声美拉德反应的影响,发现PEG能够有效提高产物的接枝度。
本文通过湿法制作SPI-D复合物,通过测定接枝度、电泳、粒径、红外光谱、表面疏水性、乳化活性等指标,探究不同PEG质量浓度对SPI美拉德反应的影响,并研究其对SPI改性的影响。
1 材料与方法
1.1 材料与试剂
大豆,东北农业大学大豆研究所;氢氧化钠、氯化钠,天津市光复精细化工研究所;透析袋(8~14 ku)、葡聚糖(10 ku),北京索莱宝科技有限公司;盐酸、磷酸二氢钠、磷酸氢二钠、PEG(6 ku),北京新光化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平,梅勒特-托利多仪器(上海)有限公司;CL-2 型恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;落地式冻干机,上海汇分电子科技有限公司;LGR20-W型台式高速冷冻离心机,北京京立离心机有限公司;Delta320 型pH计,梅特勒-托利多仪器公司;MAGNA-IR560型傅里叶变换红外光谱仪,美国NICOLET公司;F-4500型荧光分光光度计,日本HITACHI公司; UV-5100 型高性能紫外可见分光光度计,上海奥析科学仪器;Phomo型酶标仪,郑州安图实验仪器有限公司;SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)仪, 北京君意东方电泳设备有限公司。
1.3 实验方法
1.3.1SPI制备
SPI的制备根据文献[15]的方法,将大豆粉碎后过60目筛后用正己烷脱脂。以液料比10 mL/g将脱脂豆粕与水混合,用NaOH溶液调节pH值至8.0,20℃下搅拌1 h,然后4℃下8 000g离心20 min,取上清液,用HCl溶液调节上清液pH值为4.5,静置后4℃下6 000g离心20 min,取沉淀,水洗3次,然后溶解于水中形成蛋白溶液,用NaOH溶液调节pH值至7.0, 4℃下8 000g离心20 min, 除去少量不溶物, 将蛋白溶液冷冻干燥得SPI。
1.3.2SPI-D美拉德产物制备
根据文献[16]的方法,将SPI、D按照1∶2的质量比溶于去离子水中,SPI质量浓度为0.02 g/mL,D质量浓度为0.04 g/mL,然后分别添加0、0.02、0.04、0.06、0.08、0.10 g/mL的PEG,通过添加0.1 mol/L HCl或0.1 mol/L NaOH溶液将溶液pH值调至7.0,并在4℃下搅拌后静置12 h使蛋白完全水合后,将其在90℃水浴下分别反应3 h,然后10 000g离心20 min,将得到的上清液用蒸馏水透析24 h后冷冻干燥,然后采用BCA(一种能与铜离子特异性结合的钠盐)法测量蛋白浓度,取未加热的SPI-D混合物做对比。
1.3.3接枝度测定
根据文献[17]采用邻苯二甲醛(OPA)法测定游离氨基含量从而计算SPI的接枝度。取40 mg OPA溶于1 mL甲醇中,加入0.1 mol/L 25 mL硼砂溶液、2.5 mL体积分数为20%的十二烷基磺酸钠溶液和100 μL β-琉基乙醇,并用去离子水定容至50 mL,即得OPA试剂。准确称取样品,将其配制成蛋白质质量浓度为0.5 mg/mL的溶液,取样品溶液400 μL,加入8 mL OPA试剂,混合均匀后置于37℃水浴30 min,取反应后的溶液在340 nm下测定吸光度。计算样品中游离氨基的含量,并计算接枝度,接枝度G的计算公式为
(1)
式中A1——糖基化反应前SPI的游离氨基质量浓度
A2——糖基化反应后SPI-D接枝物的游离氨基质量浓度
1.3.4SDS-PAGE实验
根据文献[18]的方法进行SDS-PAGE实验。分别配置12%的分离胶与5%的浓缩胶,将5%的2-巯基乙醇(2-ME)加入到样品缓冲液中。将样品和缓冲液的混合物在沸水中加热3 min,用于电泳运行的缓冲液是0.025 mol/L Tris-HCl、0.192 mol/L甘氨酸和0.1%SDS,上样量为10 μL,之后凝胶采用0.1%考马斯亮蓝(R-250)染色液(含体积分数45%的甲醇和体积分数10%的冰乙酸)染色30 min,并用脱色液洗涤脱色后分析。
1.3.5粒径分析
根据文献[19]使用Mastersizer 2000型粒径电位仪进行粒径的测量。在装入PCS8501型比色杯之前,用0.1 mol/L磷酸盐缓冲液(pH值7)将样品稀释至0.1%。所有测量均在25℃下进行3次。对于分散相使用1.450的折射率,对于连续相(10 mol/L磷酸盐缓冲液,pH值7.4)使用1.331的折射率。
1.3.6红外光谱分析
根据文献[20]将超声处理后的SPI溶液进行冻干,冻干后的样品置于干燥器中用P2O5充分干燥,取样品1.5 mg,与200 mg溴化钾研磨混匀后压片进行红外光谱测定。在实验过程中,为了减少蒸汽的干扰,用干燥的N2持续注入测量室。测定时波数范围为400~4 000 cm-1,扫描次数为64次,分辨率4 cm-1,得到的红外吸收曲线采用Peak fitting软件和高斯曲线拟合,分析拥挤环境下SPI二级结构含量的变化。
1.3.7表面疏水性测定
根据文献[21]方法略有修改,使用0.01 mol/L磷酸盐缓冲液(pH值7.0)制备5 mL不同质量浓度蛋白质溶液(0.05、0.1、0.15、0.20、0.25 mg/mL)的等分试样。然后向蛋白质溶液中加入20 μL 1-苯胺基萘-8-磺酸(ANS)溶液(8.0 mmol/L,pH值7.0),充分混合并在黑暗环境中20℃下静置15 min后,测量样品的荧光强度。激发波长设定为300 nm,发射波长为450 nm,狭缝宽度为5 nm。将测量的荧光强度对蛋白质溶液质量浓度制图,并选择具有良好线性关系的回归线斜率作为蛋白质表面疏水性指数H0。
1.3.8游离巯基含量测定
游离巯基含量参照文献[22]测定。将1 mL蛋白质质量浓度1 mg/mL的样品溶液溶于5 mL Tris-Gly缓冲溶液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L乙二胺四乙酸,8 mol/L尿素,pH值8.0)。然后,将20 μL 2-硝基苯甲酸(DTNB)试剂加入上述混合溶液中,并通过涡旋混合器快速混合。最后,将混合物在室温下反应15 min。在412 nm的波长下测量吸光度。不含DTNB的混合溶液用作对照。
游离巯基质量摩尔浓度O计算公式为
O=73.53A412D/E
(2)
式中A412——412 nm处的吸光度
E——固体质量浓度,mg/mL
D——稀释因子
1.3.9溶解度测定
参照文献[23]的方法稍作修改测定SPI-D混合物溶解性,取冻干粉末溶解于蒸馏水中,配制成质量浓度约为10 mg/mL的蛋白质溶液,搅拌1 h使样品溶解,静置2 min后,将静置后的上层溶液倒入离心管中离心15 min (10 000g)。取上清液2 μL稀释10倍,采用BCA法测定蛋白质含量。以牛清蛋白为标准物,蛋白质溶解度为上清液中蛋白质量占样品中总的蛋白质量百分比。
1.3.10乳化活性及乳化稳定性测定
样品乳化活性及乳化稳定性的测定参照文献[24]。在0 min和10 min时从乳液样品底部分别取样50 μL,经SDS稀释200倍,充分混合后在500 nm处测定吸光度,以SDS作空白对照。乳化活性指数和乳化稳定性指数分别表示为
(3)
(4)
式中E1——乳化活性指数,m2/g
E2——乳化稳定性指数,%
T——活性常数,取2.303
N——稀释倍数,取200
θ——油相体积分数,取20%
L——比色杯厚度,取1 cm
C——乳化液形成前蛋白质水溶液中蛋白质质量浓度,取2 mg/mL
A0、A10——乳状液在0、10 min的吸光度
1.4 数据处理
本实验数据均为3个平行样的平均值,结果采用SPSS 22.0分析软件和Origin 8.0软件进行处理,采用ANOVA对数据进行差异显著性分析(p<0.05)。
2 结果与分析
2.1 接枝度
蛋白中的游离氨基与还原糖中的羰基通过共价连接形成席夫碱[25],通常用游离氨基结合程度即接枝度评估美拉德反应的程度。如图1所示,随着PEG质量浓度的提高,蛋白糖化程度不断加深,在PEG质量浓度提高到0.06 g/mL以上时,糖化增速放缓。在反应过程中,美拉德反应的底物含量没有变化,糖化程度提高可能是由于在加热的液体环境下蛋白部分解离成亚基,为D提供了更多的结合位点[26]。只提高了无关大分子物质PEG的含量,糖化程度却能逐渐提高,证明拥挤环境能促进大豆蛋白糖化,而这与文献[16]研究一致。
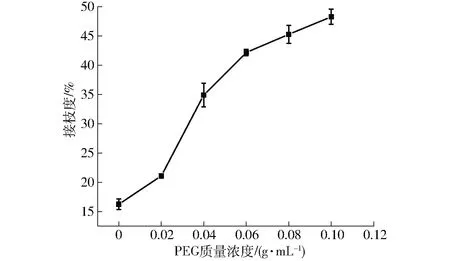
图1 不同PEG质量浓度下SPI-D复合物的接枝度Fig.1 Glycation degree of SPI-D complexes under different PEG concentrations
2.2 SDS-PAGE
为了进一步证实大豆蛋白与D的共价复合及拥挤环境对共价复合的影响进行了SDS-PAGE实验,如图2所示,在凝胶顶部出现条带,这种现象的产生可能是有大分子的美拉德结合物产生,较高分子量的蛋白的产生被认为是美拉德反应形成复合物的重要表现[24,27]。在PEG质量浓度从0增加到0.10 g/mL时,凝胶顶部条带强度逐渐增加,证明拥挤环境促进大豆蛋白糖化。在加热的大豆蛋白的凝胶顶部观察到微弱的扩散带(对比)。可能是加热过程中形成异构肽或二硫键交联导致大分子蛋白质的出现[28]。图2还显示,在美拉德反应下,样品泳道所有条带强度均有减弱,这表明这些亚基都参与了与D的美拉德反应,且有部分亚基分解为更小的亚基或多肽。随着PEG质量浓度的不断提升,凝胶条带强度逐渐减弱,证明有更多的亚基参与美拉德反应,从侧面说明拥挤环境可以促进大豆蛋白糖化。
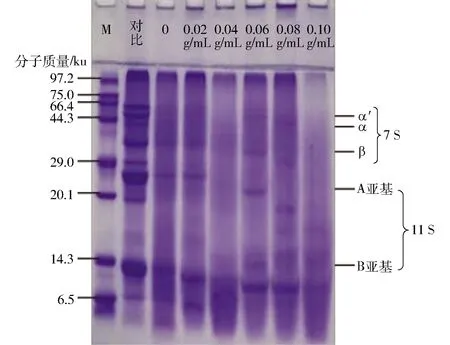
图2 不同PEG质量浓度下SPI-D复合物的 SDS-PAGE图谱Fig.2 SDS-PAGE of SPI-D complexes under different PEG concentrations
2.3 粒径
动态光散射是基于物质在溶液中的布朗运动测定其粒子直径,SPI的糖基化改性程度与聚集程度可以通过粒径及其分布直观表达。原始蛋白平均粒径最大,然后随着糖化程度的逐渐加深,产物的平均粒径越来越小。原因是随着糖化程度的逐渐加深,蛋白的结构被打开,高度有序的结构转变为随机结构[16],降低了蛋白的聚集;而随着PEG质量浓度逐渐升高,美拉德反应下蛋白亚基分解为更小的亚基或多肽,这些都降低了SPI的平均粒径,使复合物具有更好的溶解性。
2.4 红外光谱分析
红外光谱分析能够有效研究美拉德反应,因为存在易于识别的中红外光谱区域,而且其中碳水化合物的光谱区域与蛋白质不会显著重叠[29]。
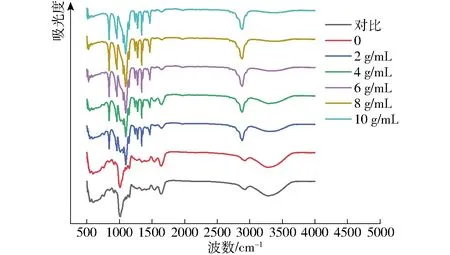
图3 不同PEG质量浓度下SPI-D复合物的FT-IR光谱Fig.3 FT-IR spectra of SPI-D complexes under different PEG concentrations
复合物的红外图谱如图3所示,SPI和D之间的美拉德反应会造成氨基基团的损失,使得部分关于氨基基团的吸收峰减少;而另一方面,新的吸收峰的出现归因于美拉德反应产物。在3 000~3 500 cm-1范围内观察到的吸收带可归因于游离和结合的O—H和N—H基团,它们能够与蛋白质中肽键的羰基形成氢键[30],而随着PEG含量的不断增加,吸收带逐渐消失。1 654 cm-1处的C—O拉伸(酰胺I)是SPI的主要吸收峰,美拉德反应物在1 654 cm-1处的峰值低于天然SPI,表明美拉德反应消耗了部分基团;糖类通过共价键与SPI 连接,2 885 cm-1处的吸收峰可能与糖环中CH的伸缩振动有关[31],随着PEG含量的增加,糖化程度逐渐加深,吸收峰明显增大。950~1 050 cm-1区域的变化可能来自蛋白质的侧链振动,表明蛋白质结构的改变[32]。与天然SPI比较,复合物在840 cm-1处的吸收峰明显增大。证实了多糖的α-糖苷键的存在,且随着PEG质量浓度的提高,吸收峰越来越明显,证明有更多SPI-D复合物产生,拥挤环境能够有效增加SPI接枝度。
通过PeakFit 4.12将光谱中1 600~1 700 cm-1段进行曲线拟合,获得每个二级结构的相对含量,结果如表1所示,α-螺旋与β-折叠的含量均有不同程度下降,而无规则卷曲的含量则是逐渐增加。其中α-螺旋是一种缝隙较少的紧密结构,主要由多肽间的氢键维持[24],蛋白变性势必会破坏多肽间氢键,使得α-螺旋含量降低,且变性程度越大,α-螺旋含量越低。而β-折叠含量降低,无规则卷曲含量逐渐增高,说明了蛋白二级结构的改变。而随着有序结构的不断减少,无序结构逐渐增多,说明越来越多的SPI与D共价结合,这与前文接枝度及电泳结果一致,证明拥挤环境能够有效增加SPI接枝度。
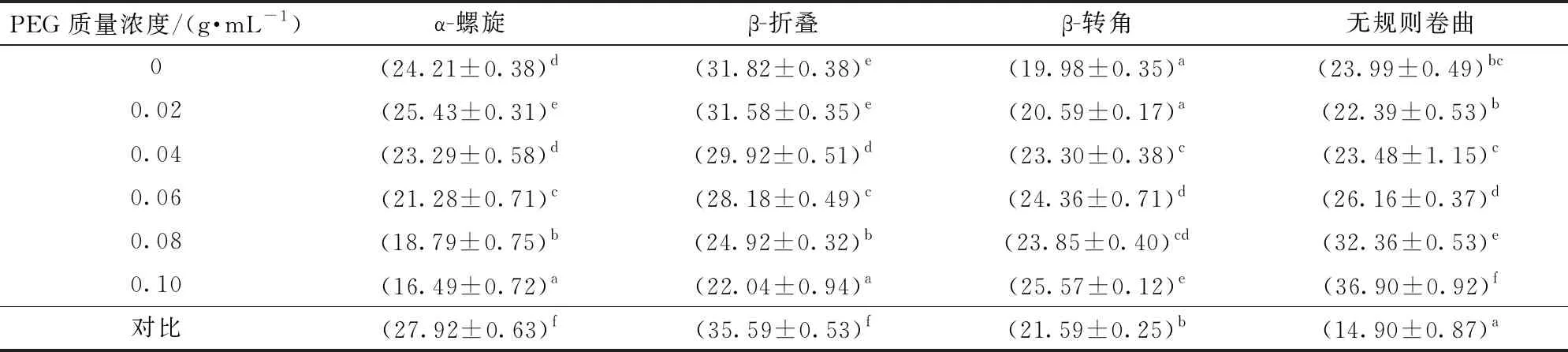
表1 不同PEG质量浓度下SPI-D复合物的二级结构相对含量Tab.1 Relative content of the secondary structure of SPI-D complex under different PEG concentrations %
2.5 表面疏水性
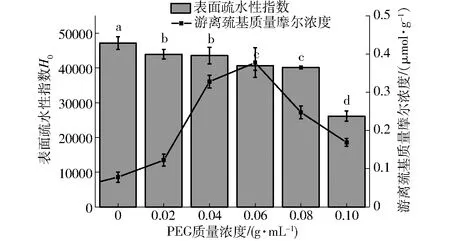
图4 不同PEG质量浓度下SPI-D复合物的表面疏 水性和游离巯基含量Fig.4 Surface hydrophobicity and free sulfhydryl content of SPI-D complexes under different PEG concentrations
表面疏水性指数H0被认为是暴露在蛋白质分子表面上的疏水基团的数量,它可以反映蛋白质的构象变化,且与蛋白质的功能性质密切相关[33]。如图4(不同字母表示表面疏水性差异显著)所示。文献[34]研究表明,在加热条件下,SPI的表面疏水性急剧上升,而随着糖化程度不断加深,SPI的疏水性呈现下降的趋势。上升的原因可能是加热处理后会有更多的疏水基团暴露在蛋白质分子表面,下降的原因可能是糖基化修饰能够部分屏蔽疏水基团。图4中随着糖化程度的加深,SPI的表面疏水性却呈现下降趋势。下降的原因可能是SPI高度糖化,进一步打开蛋白分子,使内部紧密球状区域的疏水基团也暴露出来,过多的疏水基团通过疏水相互作用再聚合[35],使得疏水性降低。这些结果表明,由糖化引起的SPI二级结构不同程度的改变,使得样品的表面疏水性不同程度的减小。
2.6 游离巯基
巯基基团和二硫键显著影响食物蛋白质的功能特性,尤其是凝胶化中的网络形成[36]。如图4所示,随着无关生物大分子PEG含量的提高,美拉德产物中的游离巯基含量先上升后下降。研究表明,有两个情况能够导致蛋白质中的游离巯基含量发生变化,一是外部作用导致蛋白分子展开,暴露其中的原始巯基;二是蛋白亚基的解离,二硫键断裂产生新的游离巯基[37]。初期,随着PEG含量的上升,游离巯基含量在增加。大豆蛋白中含有一定的二硫键,大豆蛋白在溶液中加热,使得部分蛋白解离成亚基,二硫键断裂,从而释放更多的巯基[18]。但随着PEG含量逐渐上升,游离巯基含量却不断下降,原因可能是随着糖化程度的进一步提高,过多的游离巯基重排形成新的二硫键[26];故随着PEG质量浓度的提高,拥挤环境能加速蛋白中的二硫键断裂生成更多的游离巯基,表面拥挤环境能促进蛋白分解成亚基,促进糖化。
2.7 溶解度
溶解度是表现蛋白的重要指标,会直接影响蛋白的部分功能性质如乳化性等,而糖化能有效提高蛋白的溶解性。随着PEG质量浓度的不断提升,复合物溶解度总体有所提高,但当PEG质量浓度为0.02、0.08 g/mL时,溶解度较低。美拉德反应向蛋白中引入亲水基团可以增加复合物的空间稳定性[38],进而增加复合物的溶解度。随着美拉德反应的逐渐加深,复合物的溶解度不断提高。当PEG质量浓度为0.02 g/mL时,促进糖化效果不明显,粒子直径仍然较大,影响复合物溶解,故溶解性较低;当PEG质量浓度为0.08 g/mL时,溶解度降低的原因可能是拥挤过度,影响部分SPI处于水合状态,故溶解性低,而当PEG质量浓度为0.10 g/mL时,水合不完全的蛋白沉淀,溶液中只余下糖化复合物,故其溶解度高。
2.8 乳化活性及乳化稳定性
糖化蛋白质最显着的特征之一就是能有效改善其乳化性能。因此,研究了糖化对SPI乳化性质的影响,结果如图5(图中相同参数不同字母表示差异显著)所示。随着PEG质量浓度的增加,SPI-D复合物的乳化活性呈现不断增加的趋势,但当PEG质量浓度为0.02、0.08 g/mL时,乳化活性出现异常下降。上升的原因是糖与蛋白质的共价结合可以在油滴周围形成大分子稳定层,并通过空间排斥使其稳定,防止其絮凝和聚结[39]。此外,α-螺旋等有序结构减少,无规则卷曲等无序结构增加也能提高蛋白的乳化性能[40];当PEG质量浓度为0.02、0.08 g/mL时,复合物溶液浑浊,溶解性较差,导致复合物较少的吸附到油水界面上[41],故导致乳化活性异常下降。

图5 不同PEG质量浓度下SPI-D复合物的乳化 活性及稳定性Fig.5 Emulsification activity and stability of SPI-D complexes under different PEG concentrations
如图5所示,随着糖化程度的不断提高,样品的乳化稳定性总体有较大提高。这是由于D和大豆蛋白之间的共价结合,乳液粘度增强,凝胶网络改善,因此可以提高乳化稳定性[42]。当PEG质量浓度为0.02、0.08 g/mL时,复合物溶液浑浊,溶解性比其他质量浓度较差,难以有效延缓乳析,故乳化稳定性较差。
3 结束语
通过添加PEG参与SPI-D美拉德反应,研究拥挤环境对美拉德反应产物的表征及结构影响,结果表明:拥挤环境能极大地促进大豆蛋白糖化程度,同时提高表面疏水性、乳化活性及乳化稳定性;PEG参与美拉德反应使得SPI-D复合物表现出更好的平均粒径,比未添加PEG的SPI-D溶液分散性更好;拥挤环境下的美拉德反应改变SPI二级结构,α-螺旋等结构减少,无规则卷曲增加,此时SPI有序构象的组成、柔性结构的展开影响蛋白质整体构象的柔韧性,更易与D形成功能特性较好的复合物。结果表明在SPI与D美拉德反应中引入无关大分子PEG是一种提高糖化程度的有效方法。

