乳腺癌组织GFRα1基因甲基化状态与患者淋巴结转移的关系
丰锦春,李宇翔,李丹,杨亮,朱丽萍,吴涛
新疆医科大学附属肿瘤医院,乌鲁木齐830011
乳腺癌是当今女性发病率最高的恶性肿瘤之一,肿瘤转移是导致患者生活质量下降及死亡的重要原因,目前临床上仍然缺乏针对肿瘤转移的有效对策[1]。利用分子标志物预测肿瘤患者转移的潜能,对制定有效的个体化治疗方案具有重要作用,同时对提高患者的生存率和生活质量也有重要意义。研究显示,胶质细胞系源性神经营养因子受体α1(GFRα1)与乳腺癌、神经胶质细胞瘤、胰腺癌等多种肿瘤的发生有关[2~4],其表达与乳腺癌临床分期及Her-2阳性率呈正相关关系[5]。一项多中心队列研究结果显示,GFRα1甲基化改变与胃癌的远处转移密切相关[6]。但是目前关于乳腺癌组织GFRα1基因甲基化状态与患者淋巴结转移的关系鲜见报道,为此我们进行了如下研究。
1 资料与方法
1.1 临床资料 纳入标准:①行乳腺癌改良根治术,术中行腋窝Ⅰ、Ⅱ组淋巴结清扫;②经术后病理证实为浸润性乳腺癌;③临床资料完整。排除标准:①年龄<18岁;②合并其他恶性肿瘤;③乙肝表面抗原(HBsAg)、丙型肝炎抗体(HCV-Ab)或人免疫缺陷病毒抗体(HIV-Ab)阳性;④妊娠期妇女;⑤术前接受过化疗、放疗、内分泌治疗或免疫治疗;⑥男性乳腺癌患者;⑦特殊类型乳腺癌,如炎性乳癌、派杰病、黏液癌、髓样癌、小管癌等。选择2016~2019年于我院行手术治疗、符合上述标准的女性乳腺癌患者100例,根据术后淋巴结病理结果分为转移组及未转移组,每组各50例。转移组年龄(51.72±12.99)岁,绝经19例,BMI(23.08±2.28)kg/m2;病理类型:浸润性导管癌46例、浸润性小叶癌4例;激素受体(ER)阳性29例,孕激素受体(PR)阳性26例,原癌基因HER-2阳性12例。未转移组年龄(49.30±11.39)岁,绝经16例,BMI(23.17±2.03)kg/m2;病理类型:浸润性导管癌43例、浸润性小叶癌7例;ER阳性35例,PR阳性31例,HER-2阳性7例。两组上述资料均具有可比性(P均>0.05)。本研究通过医院伦理委员会审核,患者均签署知情同意书。
1.2 癌组织GFRα1基因甲基化状态检测 采用BSP法。收集两组术中留取的原发肿瘤组织标本,置于液氮中速冻,-80 ℃冰箱保存。将冻存组织剪碎,使用EasyPure Genomic DNA Kit试剂盒提取DNA,EpiTect Fast DNA Bisulfite Kit(QIAGEN)试剂盒对DNA进行亚硫酸盐转化。根据GenBank中人GFRα1基因序列获得启动子区序列,使用Methyl Primer Express v1.0软件设计甲基化引物,进行目的基因扩增。使用SanPrep柱式DNA胶回收试剂盒进行回收,pEASY-T1 Cloning Kit试剂盒进行连接和转化。利用BIQ-Analyzer软件对测序成功的数据进行甲基化位点及数量统计,通过序列比对确定20个CpG位点的C是否发生甲基化变为T,计算两组甲基化率。
1.3 癌组织GFRα1蛋白表达检测 采用Western blotting法。取两组冻存组织,研磨后加入RIPA裂解液,充分混匀。4 ℃条件下放置60 min,12 000 r/min离心15 min,收集上清。BCA法测定蛋白浓度,SDS-聚丙烯酰胺凝胶电泳;考马斯亮蓝染色,漂洗后加入适量5×SDS-PAGE loading buffer(含β-巯基乙醇),100 ℃沸水加热处理5 min,使蛋白充分变性。12 000 r/min离心5 min,取上清备用;PVDF转膜,5%脱脂奶粉封闭1 h,TBST冲洗3次×5 min。加入GFRα1及内参β-actin一抗(稀释比例分别为1∶200、1∶1 000),4 ℃孵育过夜,加入山羊抗兔IgG二抗(稀释比例分别为1∶5 000、1∶15 000),室温孵育1 h。显色后采用ChemiScope mini化学发光仪检测、拍照并分析条带灰度值,计算GFRα1蛋白相对表达量。
2 结果
2.1 两组癌组织GFRα1甲基化率比较 转移组、未转移组癌组织GFRα1基因甲基化率分别为76.333%±19.036%、52.000%±14.842%,两组比较P<0.05。转移组GFRα1基因CpG6、CpG13、CpG14、CpG16甲基化率均高于未转移组(P均<0.05),两组其他CpG位点甲基化率比较差异均无统计学意义(P均>0.05)。见表1、表2。
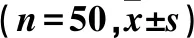
表1 两组癌组织GFRα1基因第1~10个CpG位点的甲基化率比较
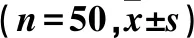
表2 两组癌组织GFRα1基因第11~20个CpG位点的甲基化率比较
2.2 两组癌组织GFRα1蛋白表达比较 转移组、未转移组癌组织GFRα1蛋白相对表达量分别为0.679±0.044、0.495±0.064,两组比较P<0.05。
2.3 GFRα1基因甲基化率与蛋白表达的关系 GFRα1基因甲基化率与蛋白相对表达量呈正相关关系(r=0.703,P=0.023)。
3 讨论
神经胶质细胞源性神经营养因子(GDNF)是神经营养因子超家族的一员,GDNF家族受体有4个,分别为GFRα1、GFRα2、GFRα3、GFRα4,其对应的配体分别为GDNF、NRTN、ARTN、PSPN[7]。受体GFRα1属于膜受体,与配体GDNF结合后,在生理条件下的主要功能是促进神经元的生长发育和迁移[8]。近年来随着神经-内分泌-肿瘤研究的不断深入,越来越多的研究表明GDNF及其受体GFRα1在肿瘤发生、发展中具有重要作用。已有研究证实,GFRα1异常表达可影响肿瘤的生物学行为,其在乳腺癌、胰腺癌、前列腺癌及神经胶质瘤中发挥促进肿瘤进展的作用[9]。GFRα1在肿瘤治疗过程中也有一定作用,异常表达的GFRα1可导致骨肉瘤细胞对化疗药物产生耐药性[10]。在乳腺癌方面,GFRα1高表达可促进乳腺癌细胞的侵袭及迁移[4]。研究表明,GFRα1在Luminal型乳腺癌组织中大量表达,在正常乳腺组织中表达很少,阻断肿瘤细胞GFRα1表达可发挥抗肿瘤作用,说明GFRα1可能成为治疗Lumial型乳腺癌的靶点之一[11]。另有研究发现,在三阴性乳腺癌组织中GFRα1的环状RNA表达增加,并与患者的生存率呈负相关关系,提示GFRα1有可能作为三阴性乳腺癌的潜在诊断及治疗靶点[12]。
DNA甲基化是哺乳动物细胞中最稳定的表观遗传修饰之一,不仅能够在组织中稳定存在,而且即使DNA甲基化改变只发生在少数细胞中也可以被灵敏地检出。在肿瘤发生、发展过程中,除了相关基因发生结构变异失活外,转录起始点附近CpG岛的异常甲基化是其失活的主要途径。目前,DNA甲基化检测已经逐步应用于癌前病变诊断[13~15]、化疗敏感性[16~19]及肿瘤患者预后预测[20,21]等方面,并且在预测肿瘤转移和复发方面也具有良好的应用前景。本研究结果显示,转移组GFRα1甲基化率显著高于未转移组,进一步分析发现在CpG6、CpG13、CpG14、CpG16四个位点的甲基化率具有统计学差异。在胃癌的相关研究中发现,GFRα1基因去甲基化后可重新激活该基因表达,导致胃癌转移的发生[6]。这与本研究结果并不符,可能与不同肿瘤之间GFRα1的表达机制不同有关。GFRα1的调控是一个复杂的、多因素参与的过程,未来需进行更大规模的多中心队列研究来进一步证实这一问题。
基因启动子区甲基化异常升高可以导致诸如细胞周期调节基因、抑癌基因、凋亡基因等重要调节基因转录沉默,使得相关基因表达降低或缺失,从而促进肿瘤形成和转移[22]。本研究结果显示,转移组GFRα1蛋白表达高于未转移组,且GFRα1基因甲基化率与蛋白相对表达量呈正相关关系;提示GFRα1蛋白高表达可能促进了乳腺癌的淋巴结转移,而GFRα1基因甲基化率增高可能是其蛋白水平异常表达的原因之一,这一推测及其具体机制仍待进一步研究证实。

