大承气汤对肠梗阻解除后大鼠肠机械屏障损伤的保护作用
马军宏,李东华,刘晋津,吴 腾,于向阳,周振理
肠梗阻是临床常见的急腹症,凡肠内容物不能正常运行或通过发生障碍时称之为肠梗阻。肠梗阻发生时出现肠黏膜结构和功能的严重损害,引起急性肠黏膜损伤,严重时诱发肠屏障功能障碍,引发全身感染、内毒素血症、全身炎性反应综合征(systemic inflammatory response syndrome,SIRS)、多器官功能障碍综合征(multiple organ dysfuction syndrome ,MODS),导致肠功能障碍甚至衰竭。中医药对恢复肠道功能及保护肠屏障功能有一定的疗效。中医将肠梗阻归属于“关格”“肠结”等,辨证多为阳明腑实证,通里攻下法简称“下法”,大承气汤是其代表方剂,可调整肠道生理功能,改善肠梗阻肠道通透性,改善胃肠道屏障功能,促进胃肠功能恢复。本研究通过建立可复性肠梗阻模型,检测D-乳酸及肠上皮紧密连接蛋白(Claudin)-1 mRNA 水平,探讨大承气汤对肠梗阻解除后大鼠肠屏障损伤的保护作用,为临床应用提供理论根据。
1 材料与方法
1.1 动物 健康SPF级Wistar大鼠30只,雌雄不限,体重250~270 g,购自北京华阜康生物科技股份有限公司(SCXK京2019-0008)。实验前在天津市中西医结合急腹症研究所标准动物实验中心适应1周,给予标准饲料和水喂养,不限制食水。通风、清洁、20~25 ℃环境下,相对湿度(50±10)%,明暗交替周期为12/12 h。自由进食、饮水。
1.2 方药 大承气汤(选自伤寒论):由大黄、厚朴、枳实、芒硝按4:3:3:1.5比例配伍,水煎煮,滤液浓缩为100%(生药含量为1 g/mL)药液。由天津市南开医院急腹症研究所药剂科统一制备,灭菌处理,分装处理,置于4℃保存。待梗阻解除后每日给予大鼠标准饲料喂养,分别给予制备好的大承气汤(1ml/100g),每日2次灌胃。
1.3 主要试剂 D-乳酸ELISA盒(E02D0015,上海BlueGene Biotech公司);动物组织总RNA提取试剂盒(北京天根生化科技有限公司);反转录试剂盒:RevertAid First Strand cDNA Sythesis Kit(美国,Thermo公司);实时荧光定量PCR(RTPCR) 试 剂 盒:Maxima SYBR Green/Fluorescein qPCR Master Mix(2×) (Thermo,美国 )。
1.4 大鼠可复性肠梗阻模型制备
1.4.1 无损伤肠管阻断夹制作 将双扁铁心扎线(宽3.0 mm,夹心金属直径0.3 mm,以下称为扎线)统一截取长度为16 mm,以一次性使用10 Fr导尿管模拟末段回肠,将扎线围绕在导尿管外侧制作成“Ω”型,即“无损伤肠管阻断夹”,阻断夹周长为10 mm,两端各弯曲3 mm以防刺破肠管,过硅油,制作完成后高压灭菌备用。
1.4.2 可复性肠梗阻模型制作 大鼠模型制作术前禁食12 h,禁饮6 h,以10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉。备皮、消毒,取腹中线下1/3作无菌皮肤切口,长约2 cm,逐层分离后进腹腔无菌操作打开腹腔暴露回盲部,用无损伤镊轻柔将回盲部提出切口外,放于无菌纱布上。自回盲部向回肠末段方向约1 cm处寻找肠管相对较游离且肠系膜较长段,以眼科用止血钳在该处小肠系膜无血管区戳孔,将自制无损伤肠管阻断夹穿过肠系膜套于肠管外并夹闭,以形成“外压式”梗阻装置,造成肠腔完全性梗阻。用温生理盐水将肠管表面异物冲洗干净,还纳至腹腔原位,术中向腹腔内滴注5%左氧氟沙星葡萄糖注射液约1 mL,逐层关闭腹腔。正常对照组不做处理。需要解除梗阻时,麻醉后进腹找到梗阻点将无损伤肠梗阻阻断夹移除。
1.5 动物分组、给药及取材 将造模后大鼠分为模型组和中药组(每组12只),对照组6只为非造模组。中药组于梗阻解除后开始给予大承气汤灌胃干预(1 mL/100 g),每日2次灌胃,连续96 h。模型组给予相同剂量的生理盐水灌胃干预(1 mL/100 g),每日 2次灌胃,48 h、96 h后麻醉满意后开腹(每个时间点随机取6只),经腹主动脉取血5 mL,注入预置抗凝剂的试管,3000 r/min×15 min离心后收集血清,取500 μL血清快速分装后于-20 ℃冻存待测;取梗阻近端1 cm处小肠2 cm,去除肠腔异物,以预冷的生理盐水反复冲洗干净,然后用无菌医用纱布吸干,分装并编号立即投入液氮,随即转入-70 ℃超低温冰箱内冻存待行RT-PCR。
1.6 检测指标及方法
1.6.1 血清D-乳酸 采用大鼠D-乳酸ELISA试剂盒检测。将试剂盒室温(20~25℃)放置30 min,取酶标板,将标准品各50 μ L依次加入空白微孔中,加入50 μ L的样本,对照孔则加入50 μL PBS液,各孔加入100 μL的酶标记液后用封板膜密封酶标板,37℃反应60 min,充分清洗酶标板5次,保持各孔有充足的水压(浓缩洗涤液以1:100的比例与蒸馏水稀释),酶标板洗涤后以吸水纸彻底拍干,各孔加入准备好的显色剂A,B各50 μL,37 ℃避光反应10~15 min,各孔加入50 μL终止液以终止反应,检测450 nm波长处OD值,以标准品的浓度为横坐标(对数坐标),OD 值为纵坐标(普通坐标),在半对数坐标纸上绘出标准曲线,由样品的OD值标准曲线查出相应的浓度,乘以稀释倍数即得血清目标浓度。
1.6.2 肠上皮Claudin-1 mRNA表达测定 采用RT-PCR方法检测各组大鼠小肠上皮Claudin-1mRNA表达情况。
1.6.2.1 引物设计及合成 引物由上海Invitrogen公司设计并合成,Claudin 1上游引物:5'-TAC ACACATGCCTCCAATGCCGTTC-3'产物大小199 bp。Claudin 1下游引物:5'-CCAAG ATGCAAATCCAGGTCTACCC -3'。β-actin 上游引物:5'-ACAACCTTCTTGCAGCT CCTC-3'产物大小198 bp。β-actin下游引物:5'-GACCCATACCCACCATCACAC-3'。
1.6.2.2 总RNA提取 组织每10~20 mg加入300 μL Trizol裂解液,使用移液枪将混合液吹至澄清,12 000 r/min离心5 min,留取上清液,加入氯仿涡旋混匀,室温静置30 min后,在4 ℃下,12 000 r/min离心5 min,取上层上清液,加入等量异丙醇,置于-80 ℃过夜。
1.6.2.3 cDNA的合成 取出总RNA溶液室温融化,在4 ℃下,12 000 r/min离心5 min,弃上清,管底可见白色或淡黄色RNA。加入75%乙醇,缓慢上下颠倒混匀,在4 ℃下,12 000 r/min离心5 min,弃上清,加入无水乙醇溶解,放置于室温中晾至溶剂挥干。用10~30 μL DEPC水溶解,瞬时离心洗涤沉淀,使用NanoDrop 2000测定RNA的浓度和纯度。反应体系为20 μL,其中RNA模板5μL,5×Reaction buffer 4μL,Oligo dT primer 1μL,dNTP Mix 2μL,RiboLock RNase Inhibitor 1μL,RevertAid M-MuLV RT 1μL,Nuclease-free ddH2O 6μL。反应程序为:42℃60 min, 70℃ 5 min。根据HiFiScript cDNA合成说明进行反转录得到cDNA。
1.6.2.4 RT-PCR检测Claudin-1mRNA表达水平反应体系为25 μL 其中cDNA模板1 μL,上下游引物(浓度为10 μmol/L)各0.5 μL, Maxima SYBR Green/Fluorescein qPCR Master Mix(2×)12.5 μL,Nuclease-free H2O 10.5 μL。反应程序为:95 ℃10 min热启动后开始循环:95 ℃15 s,60 ℃60 s共45个循环。熔解曲线的反应条件是起始温度为55 ℃,每升高0.5 ℃停留20 s,直到95 ℃终止反应。反应结束后,按下列公式进行数据处理和统计分析,用相对定量法分析结果,用Claudin1Ct值-β-actin Ct值,得到ΔCt;用处理组的ΔCt -空白组ΔCt的均值,得到ΔΔCt;各组与空白组比较Claudin1 mRNA的相对表达水平=2-ΔΔCt。
1.7 统计学分析 采用SPSS17.0统计软件对本研究数据资料进行统计学比较分析。计量资料以均数±标准差表示,比较方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肠梗阻解除后大鼠小肠组织病理学改变 对照组小肠黏膜各层结构完整,上皮排列有序,绒毛结构清晰,肠绒毛排列整齐,未见淋巴细胞增生及炎细胞浸润。模型组48 h大鼠小肠黏膜和黏膜下层间质水肿、血管充血、黏膜层中性粒细胞浸润、肠绒毛毛细血管充血、浆膜层明显炎性渗出;梗阻缓解后96 h可见小肠黏膜微绒毛排列紊乱明显,绒毛上皮细胞脱落。中药组经大承气汤干预后与模型组对比,梗阻缓解后48 h未见明显变化,至中药干预96 h后,中药组大鼠肠管微绒毛结构较模型组清晰,小肠黏膜上皮细胞排列有序,脱落坏死的绒毛上皮细胞明显减少,浆膜层可见炎性渗出,肠绒毛毛细血管充血明显减轻,见图1。
2.2 血清D-乳酸含量变化 肠梗阻解除后模型组分别在48 h、96 h血清D-乳酸与对照组相比,无统计学差异(P>0.05);中药组大鼠在48 h、96 h血清D-乳酸含量明显降低(P<0.01),即大承气汤灌胃后血清D-乳酸水平出现明显下降,见表1。
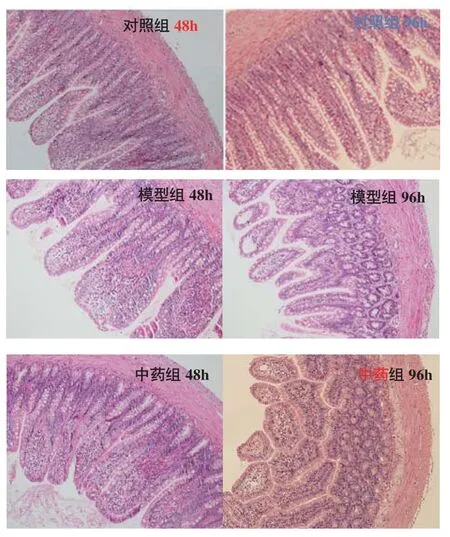
图1 各组小肠组织病理组织学改变(HE 40)

表1 各组大鼠血清D-乳酸比较
2.3 肠上皮Claudin-1mRNA表达水平改变 肠梗阻解除后模型组大鼠肠上皮黏膜Claudin-1mRNA表达降低(P<0.05),大承气汤组灌胃后大鼠肠黏膜Claudin-1mRNA水平于48 h、96 h与对照组比显著提高(P<0.01),见表 2。

表2 大鼠肠黏膜Claudin-1mRNA相对表达值
3 讨论
肠梗阻发生后肠黏膜结构和功能受到损害,引起急性肠黏膜损伤,进而出现肠屏障功能障碍,诱发菌群移位、SIRS、MODS等,导致死亡等严重后果。肠黏膜屏障主要由机械屏障、生物屏障、免疫屏障及化学屏障构成,其中机械屏障是肠黏膜屏障的根本。肠机械屏障的完整性和连续性是肠黏膜屏障功能的解剖学基础,小肠机械屏障损害是肠功能功能障碍最早的病生理改变,也是出现肠源性菌血症、毒血症的主要原因,其结构基础是肠黏膜上皮细胞及细胞与细胞之间完整的连接。细胞之间最主要的连接方式是紧密连接,紧密连接是肠黏膜上皮细胞之间的主要连接方式,对于上皮细胞之间屏障功能及细胞之间稳固排列发挥重要功能,对维持肠黏膜屏障机械结构完整和正常功能发挥起重要作用,紧密连接的破坏导致肠黏膜屏障受损[1]。
Claudins是紧密连接膜蛋白的家族成员,其表达数量及分布结构直接影响紧密连接的组织结构和功能[2-3]。Claudin-1基因是构成紧密连接的主要骨架蛋白之一,作为紧密连接蛋白原纤维形成的主要成分,并参与维持上皮细胞极性和调节肠屏障的通透性,对于维持肠上皮结构和功能,保护肠道屏障完整性起着重要作用[4-6]。紧密连接在肠腔发生病理性变化时可迅速发生动态改变,肠腔内毒素迅速从肠上皮紧密连接处突破肠黏膜屏障[7]。根据前期实验积累已经确定肠梗阻模型48h后出现肠功能实质损害导致肠功能障碍[8],本实验通过建立了大鼠可复性肠梗阻模型,实验观察到随着梗阻时间延长,Claudin-1呈逐渐下降趋势,提示肠梗阻过程中肠屏障破坏严重,恢复肠屏障功能成为梗阻解除后肠功能恢复的治疗重点和难点。本实验观察到给予大承气汤干预后的回肠Claudin-1mRNA表达逐渐恢复,优于模型组,笔者推测梗阻解除后应用大承气汤可以明显减轻肠黏膜上皮之间的紧密连接破坏,使微绒毛增多,从而提高紧密连接蛋白含量,同时可以保护肠黏膜细胞减少凋亡,以防紧密连接结构破坏进一步加重,维护肠黏膜屏障的完整性,进一步证实大承气汤对肠梗阻解除后肠黏膜屏障损伤具有保护作用[9],实验结果表明通里攻下为治则的大承气汤有助于保护肠道屏障功能,进而促进肠功能恢复。
D-乳酸是细菌发酵的产物,大肠杆菌、乳酸杆菌及克利伯菌等肠腔内菌群均可以分解代谢产生。正常人体内D-乳酸含量很少,肠梗阻发生后肠黏膜绒毛顶端上皮脱落,细胞旁路径增加而致肠黏膜通透性增加,肠腔菌群大量繁殖,肠黏膜生物屏障被破坏,此时细菌产生的大量D-乳酸即经过受损的肠黏膜进入血液系统,出现血中D-乳酸蓄积,血清D-乳酸可以反映肠损伤的程度[10],临床上常用作评价肠道损伤的有效标志物。中医将肠梗阻辨证为“阳明腑实证”,应用大承气汤通里攻下、行气破滞,可清除细菌,中和降解内毒素,改善肠道微循环,降低血管通透性,促进肠管运动,改善MODS时肠管平滑肌功能,具有修复组织的作用。本实验中肠梗阻造模后血清D-乳酸水平持续升高,肠梗阻发生后肠道中细菌产生的大量D-乳酸可通过受损肠道黏膜入血,肠管通透性增加,进一步损伤肠黏膜屏障,因此测定D-乳酸可直接反映肠黏膜损伤程度。解除梗阻后给与大承气汤干预后,中药组大鼠血清D-乳酸水平下降明显优于对照组及模型组。中药干预后96 h,大承气汤组大鼠D-乳酸水平已接近正常水平,提示肠黏膜屏障已基本恢复,证实通里攻下法正是“阳明腑实证”治疗的“金标准”。
大承气汤出自《伤寒论》,由大黄、厚朴、枳实和芒硝四味药组成,具有通里攻下,峻下热结之功,主治大便不通,频转矢气,脘腹痞满,腹痛拒按,按之硬,甚或潮热谵语,手足濈然汗出之阳明腑实证,是通里攻下的著名代表方。君药大黄所含活性化学成分最多,其中蒽醌类化合物能改善肠黏膜血流灌注,对缓解肠黏膜缺血缺氧有重要作用,其主要机制可能是通过维持肠黏膜细胞的正常结构、细胞间连接及绒毛高度,防止或修复肠黏膜萎缩及损伤,保护肠黏膜的完整性[11-12]。在对通里攻下法对MODS肠屏障功能保护作用的研究中,以示踪剂观察肠黏膜和肠细胞膜通透性,大承气汤可以明显降低细胞间质、肠细胞内的镧颗粒明显,说明其可有效降低模型动物肠黏膜和肠细胞膜的通透性,有助于减轻肠黏膜组织的病理损害。研究还发现大黄能兴奋肠壁M样受体,促进肠蠕动,清除肠麻痹,增强肠张力并减少水分的吸收。在对MODS的大鼠肠道运动障碍使用大承气冲剂治疗时可见,大承气冲剂能明显提高大鼠传输功能及肌电慢波频率和振幅,证实了大承气冲剂可明显促进MODS鼠肠蠕动,保护和增强胃肠运动功能。在缺血-再灌注损伤过程中,大黄还可以下调肠上皮细胞的凋亡基因ICE mRNA表达,并有效降低肠上皮的凋亡。厚朴酚是从厚朴中提取的一种含有酚羟基的生物活性物质,可以干预休克和感染打击下的细胞因子调控,修复胃肠动力障碍的作用[13-14],同时实验研究发现厚朴可改善脓毒症所致胃肠运动障碍的功能[15]。芒硝在肠内不易被吸收, 使肠内渗透压升高, 大量水分保留在肠腔, 机械性刺激肠壁而致泻。大黄与芒硝配伍有“增水行舟, 润燥软坚”之功效, 致泻作用增强[16]。
为研究清肠化湿方对实验性大鼠结肠炎结肠组织Claudin-1表达水平的影响,翟金海等[17]用免疫组化观察结肠上皮Claudin-1蛋白的表达情况,用实时荧光定量PCR法检测Claudin-1 mRNA相对表达水平,结果发现清肠化湿方可明显减轻大鼠结肠炎模型结肠组织Claudin-1蛋白损伤,保护紧密连接,保护肠黏膜屏障,从而达到治疗溃疡性结肠炎的目的。重症急性胰腺炎时血浆内毒素及D-乳酸浓度升高,此时即存在肠黏膜屏障损伤,肠黏膜通透性增加,肠黏膜组织Claudin-1mRNA、蛋白表达显著降低,表明重症急性胰腺炎时肠组织紧密连接遭到破坏,给予氧化苦参碱干预治疗后,血浆内毒素、D-乳酸浓度逐步降低,肠黏膜组织Claudin-1mRNA、蛋白表达逐步提高,说明肠黏膜屏障损伤得到修复,改善了肠黏膜通透性,抑制肠道细菌移位;同时氧化苦参碱通过靶向调控蛋白Claudin-1限制肠上皮细胞旁间隙通透性的机制,为预防和治疗重症急性胰腺炎继发肠黏膜屏障损害提供了新途径[18-19]。白小武等[20]观察到大黄素能增加肠缺血再灌注大鼠肠黏膜Claudin-1含量,提示大黄素可以缓解肠缺血再灌注造成的肠道损伤、保护肠上皮细胞间紧密连接,对肠黏膜屏障具有保护作用。
肠梗阻发生后肠黏膜上皮屏障明显受损,为防止肠道内细菌及其毒素进入机体,保护连续、完整及正常的黏膜上皮及其连接,本实验对肠梗阻解除后应用大承气汤提高Claudin-1mRNA的表达水平,降低大鼠血清D-乳酸水平,证实了大承气汤可以改善上皮细胞功能,从而维持屏障结构及功能的完整性。

