蓝萼乙素对三阴性乳腺癌MDA-MB-231细胞增殖、迁移及侵袭的影响
吴元肇,金 早
乳腺癌作为国内外常见的女性恶性肿瘤,在40~60岁的人群中具有较高的发病率。目前,乳腺癌已成为威胁妇女生命健康的重大疾病,其发病率在女性肿瘤中跃居第一,病死率亦高达40%[1]。乳腺癌按生物学行为和临床病理特征可分为不同亚型,其中较为严重的是三阴性乳腺癌(triple negative breast cancer,TNBC),占全部乳腺癌的15%~20%[2]。通过免疫组化可发现,TNBC组织中雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体-2(Her-2)均表达为阴性[3]。作为乳腺癌中较为特殊的亚型,TNBC具有高度侵袭性,极易发生局部及远端转移[4]。由于TNBC缺乏明确靶点,临床暂无有效的内分泌治疗及靶向治疗策略,因而无法进行系统治疗[5],因此探索TNBC新的治疗药物具有重要的意义。
中医药在乳腺癌治疗方面具有悠久历史,因其疗效优及不良反应少等优势,在肿瘤治疗方面取得了明显进展[6]。蓝萼香茶菜(Rabdosia japonica (Burm. f.) Hara var. glaucocalyx (Maxim.)Hara)味苦、寒,具有清热利尿、解毒消肿等功能,临床常用于感冒、咽喉肿痛、胃炎、肝炎、乳腺炎、癌症等治疗[7-8]。现代研究发现,蓝萼香茶菜中的重要二萜类成分,可有效干扰乳腺癌病变进程[9],同时其主要二萜类成分-蓝萼乙素,体外可明显抑制宫颈癌细胞迁移与侵袭[10]。因此笔者推测蓝萼乙素可通过抑制乳腺癌细胞迁移与侵袭,从而发挥治疗乳腺癌的作用。基于上述,本课题拟体外培养MDA-MB-231细胞,通过分子生物学手段探讨蓝萼乙素的抗癌机制,为其临床应用提供科学依据。
1 材料与方法
1.1 主要试剂与仪器 人乳腺癌细胞株(MDAMB-231)购自中国科学院上海细胞库;MTT、DMSO购自美国Sigma Aldrich公司;蓝萼乙素(L-083-180611)购自成都瑞芬思生物科技有限公司;BCA、ECL试剂盒购自美国Thermo Fisher公司;N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、 E-钙黏蛋白(E-cadherin)、p-P38MAPK、P38MAPK及叉头蛋白O3A(FOXO3α)抗体购自美国Cell signaling Technology公司;β-Tubulin、二抗购自南京巴傲得生物科技有限公司;全蛋白提取试剂盒购自南京凯基生物公司;Transwell小室购自美国Corning公司;ORMA371型CO2细胞培养箱购自美国Thermo Fisher公司;SDS-PAGE电泳系统购自上海天能科技有限公司;Western blotting转膜系统、Gel Doc凝胶成像仪购自美国Bio-Rad公司;Synergy HT酶标仪购自美国BioTeK公司;Olympus AX70显微照相系统购自日本Olympus公司。
1.2 细胞传代与培养 取人MDA-MB-231细胞,将其接种在RPMI1640(10% FBS+1% P/S)中,稀释后重悬,在37℃、5% CO2孵育箱中培养,待细胞融合至80%~90%时进行传代培养。
1.3 MTT法检测细胞增殖率 取对数生长期MDA-MB-231细胞,重悬为1×105个/ml密度,接种于96孔培养板,每孔体积为100 μL,置于5% CO2、37 ℃条件下培养24 h,待细胞融合至80%~90%时加入不同浓度(0、2、4、8 μmol/L)蓝萼乙素,每组设6个复孔。23 h后加入MTT液(5 g/L)20 μL,置于细胞培养箱中继续培养4 h,取出96孔板并弃上清,每孔再加入150 μL DMSO振荡10 min溶解,用酶标仪在490 nm波长处检测吸光度(A)。计算细胞增殖率(%)=(A处理组/A空白对照组)×100%。
1.4 划痕实验检测细胞迁移能力 取对数生长期的MDA-MB-231细胞,稀释成1×106个/mL浓度后接种于6孔板中,置于5% CO2、37 ℃条件下培养24 h。待细胞融合至80%~90%时用移液枪头(200 μL)在孔底部中间划条直线。PBS洗去脱落细胞,每孔中加入不同浓度(0、2、4、8 μmol/L)蓝萼乙素,每组设3个复孔。同时,采用倒置显微镜观察、拍摄划痕0 h及24 h的细胞迁移情况,并计算细胞的迁移距离。
1.5 Transwell法检测细胞侵袭力 采用Matrigel(1:8稀释)对Transwell小室底部膜的上室面进行铺胶,随后置于细胞孵育箱中使Matrigel聚合成凝胶。取对数生长期的MDA-MB-231细胞,将其稀释成1×106个/mL,取100 μL悬液加入上室,下室中加入600 μL培养基。将MDA-MB-231置于5% CO2、37 ℃条件下培养24 h,待细胞融合至80%~90%时加入不同浓度(0、2、4、8 μmol/L)蓝萼乙素进行干预。24 h后取出小室,弃上清液,PBS清洗2遍,4%多聚甲醛固定15 min,将小室适当风干。0.1%结晶紫染色20 min,用棉签擦去上室的细胞,显微镜下任意抽取5个视野观察并计数。计算细胞侵袭率(%)=(处理组细胞数/空白对照组细胞数)×100%。
1.6 免疫印迹(Western blotting) 法检测N-cadherin、Vimentin、E-cadherin、p-P38MAPK、P38MAPK、FOXO3α及β-Tubulin表达情况 取对数生长期MDA-MB-231细胞,按1×106个/ml接种于6孔板,待细胞融合至80%~90%时加入不同浓度(0、2、4、8 μmol/L)蓝萼乙素进行干预。24 h后收集细胞并裂解,取20 μg蛋白,经SDSPAGE电泳,然后电转移至PVDF膜,5% BSA封闭。N-cadherin、Vimentin、E-cadherin、p-P38MAPK、P38MAPK、FOXO3α及β-Tubulin一抗4 ℃过夜孵育,再用辣根过氧化物酶(HRP)标记的二抗室温孵育30 min,以β-Tubulin为内参。ECL化学发光、显影。
1.7 统计学方法 采用SPSS17.0统计软件进行单因素方差分析。计量资料以均数±标准差表示,多组比较用方差分析,进一步两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 蓝萼乙素可有效抑制乳腺癌MDA-MB-231细胞的增殖能力 空白对照组(0 μmol/L)中乳腺癌细胞增殖明显,细胞活力较强。加入不同浓度(2、4、8 μmol/L)蓝萼乙素可明显抑制细胞增殖,与空白对照组比较有明显差异(P<0.05),且呈浓度依赖性,以4、8 μmol/L蓝萼乙素的作用较强。见图1。

图1 蓝萼乙素对MDA-MB-231细胞增殖的影响
2.2 蓝萼乙素可明显抑制乳腺癌细胞侵袭能力 Transwell检测结果表明,空白对照组中MDA-MB-231细胞侵袭能力较强。加入不同浓度的(2、4、8 μmol/L)蓝萼乙素进行处理,具有侵袭能力的乳腺癌细胞明显减少,与空白对照组比较差异明显(P<0.05),且呈浓度依赖性,以4、8 μmol/L蓝萼乙素的作用较强。见图2。
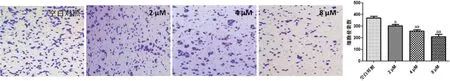
图2 蓝萼乙素对MDA-MB-231细胞侵袭能力的影响
2.3 蓝萼乙素可明显抑制乳腺癌细胞的迁移能力 划痕实验结果表明,空白对照组中MDAMB-231细胞的伤口愈合较快。加入不同浓度的蓝萼乙素(2、4、8 μmol/L)干预后,可明显抑制乳腺癌细胞的迁移速度,与空白对照组比较差异明显(P<0.05),以8 μmol/L蓝萼乙素的作用最强。见图3。

图3 蓝萼乙素对MDA-MB-231细胞迁移能力的影响

图4 蓝萼乙素对MDA-MB-231细胞中p-p38MAPK及FOXO3a表达水平的影响
2.4 蓝萼乙素可明显提高乳腺癌细胞中p-P38MAPK及FOXO3a的表达水平 Western blotting检测结果表明,MDA-MB-231细胞中p-P38MAPK及FOXO3a的表达水平较低。加入不同浓度(2、4、8 μmol/L)蓝萼乙素干预处理后,乳腺癌细胞中的p-P38MAPK及FOXO3a表达水平明显增加,与空白对照组比较差异明显(P<0.05),且呈浓度依赖性,以4、8 μmol/L蓝萼乙素的作用较强。见图4。2.5 蓝萼乙素干扰乳腺癌细胞中上皮-间质转化(EMT)相关蛋白标志物的表达水平 Western blotting检测结果表明,MDA-MB-231细胞中E-cadherin的表达水平较低,而Vimentin及N-cadherin的表达水平较高。加入不同浓度(2、4、8 μmol/L)蓝萼乙素可明显促进E-cadherin的蛋白表达,抑制Vimentin及N-cadherin的蛋白表达,与空白对照组比较差异明显(P<0.05),且呈浓度依赖性,以4、8 μmol/L蓝萼乙素的作用较强。见图5。
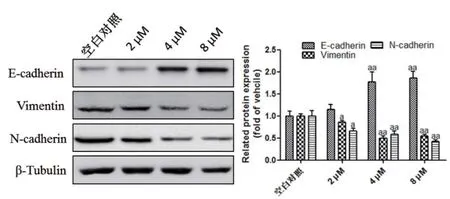
图5 蓝萼乙素对MDA-MB-231细胞中E-cadherin、Vimentin及N-cadherin表达的影响
3 讨论
近年来,随着发病率及死亡率的不断攀升,癌症已成为中国疾病死亡的首要因素。乳腺癌是中国女性的常见癌症,严重危害妇女健康,其发病例数、死亡例数分别占全球发病及死亡的11.2%及9.2%,且发病年龄呈年轻化,对社会、家庭造成严重影响[11]。通常该类肿瘤具有高侵袭性,可诱发多脏器功能衰竭与恶性病变,最终导致患者死亡。临床常采用手术切除进行治疗,但术后肿瘤的复发与转移难以避免,因此寻找可有效抑制乳腺癌细胞转移与侵袭的药物是乳腺癌治疗领域的焦点[12]。天然药用植物长期以来作为抗肿瘤药开发的重要源头,从中寻找生物活性产物则是药物研发人员的关键目标[13]。因此,本课题拟体外培养MDA-MB-231细胞,并加入蓝萼乙素干预处理,探讨蓝萼乙素治疗乳腺癌的作用及机制。
EMT是上皮细胞获得迁移能力的主要途径,通过该方式使得上皮细胞失去细胞极性、基底膜连接受损等,从而可获得高迁移、侵袭及降解细胞外基质等能力,使肿瘤细胞向邻近组织侵袭或进入血管并向远处转移[14]。主要表现为上皮细胞间紧密连接的胞膜蛋白(E-cadherin)表达减少,而间质细胞间的连接蛋白(N-cadherin、Vimentin)表达增加[15-16]。已有研究表明,EMT在乳腺癌的转移和侵袭过程中起重要作用[17],因此通过干预EMT的进程可成为控制乳腺癌转移的关键途径。本研究发现,蓝萼乙素可有效抑制间质细胞标志物N-cadherin及Vimentin的表达,促进上皮细胞标志物E-cadherin的表达,缩短细胞的迁移距离,同时还可减少侵袭细胞数量。提示蓝萼乙素可通过干扰EMT进程有效抑制MDA-MB-231细胞的迁移与侵袭能力。而p38MAPK作为MAPK家族中的重要成员,当其活化后可介导下游信号传导,从而参与细胞分化、迁移、调亡及增殖等[18]。同时,FOXO3a作为转录因子FOXO家族成员,具有抑癌作用,在人体各组织器官(如:肺、肝、乳腺等)中广泛分布,参与细胞增殖、信号转导及氧化应激等重要生理活动[19]。通过刺激p38MAPK磷酸化可有效促进FOXO3a蛋白的表达[20]。方瑞等[21]发现,通过激活p38MAPK/FOXO3a信号通路可有效干扰三阴性乳腺癌细胞的EMT进程,继而干扰相关迁移与侵袭的行为活动,与与本研究结果一致。本研究还发现,蓝萼乙素能促进p38MAPK的磷酸化及FOXO3a的蛋白表达,同时还可有效抑制MDA-MB-231细胞的增殖能力。
综上所述,蓝萼乙素可通过介导p38MAPK/FOXO3a信号通路,调控MDA-MB-231细胞增殖、迁移及侵袭的能力。

