腹腔镜胆总管切开取石一期缝合治疗胆总管结石术后胆漏发生的危险因素研究
汤海波,琚然
(滁州市第一人民医院普外一科,安徽 滁州 239000)
胆总管结石,虽是一种良性疾病,但治疗不及时会导致急性胆源性胰腺炎、梗阻性黄疸、急性化脓性胆管炎,甚至出现休克危及生命。治疗胆总管结石的经典手术方式是胆总管切开探查取石、放置T管引流。但随着腹腔镜和胆道镜技术的发展以及大量临床实践的对比研究,目前对胆总管结石的外科治疗方式主要以腹腔镜联合胆道镜胆总管探查一期缝合为主[1-3],逐渐放弃了T管的留置[4]。虽然一期缝合相比T管引流术在减少并发症、缩短住院时间、减少住院费用等方面效果显著[5],但依然存在较高的胆漏发生率[6]。因此有必要对胆总管一期缝合术后胆漏发生的危险因素进行探讨与研究。
资料与方法
一、一般资料及纳入、排除标准
收集2017年1月至2019年6月滁州市第一人民医院收治的200例患胆总管结石行腹腔镜手术的病人,纳入回顾性研究,手术由经验丰富的肝胆外科医师(5年以上主刀手术经验,完成500例以上腹腔镜肝胆手术)完成。本研究经医院伦理委员会批准,所有病人签署知情同意书。
纳入标准: ①经腹部超声、CT及MRI影像检查诊断胆总管结石明确的病人,可有或没有右上腹痛、黄疸、发热等症状;②既往无肝胆手术史;③年龄18~79岁;④胆总管直径≥0.4 cm。
排除标准:①化脓性胆管炎及胆源性胰腺炎急性期未得到控制;②急性化脓梗阻性胆管炎,需要鼻胆管引流的病例;③胆道结石无法取尽,需要留置T管的病人;④患有肝胆胰恶性肿瘤者;⑤合并严重心肺或其他脏器病变不能耐受手术者;⑥妊娠或哺乳期妇女;⑦胆管囊肿。
二、手术
1.术前情况 搜集并记录所有病人术前一般资料及主要实验室检查结果(血液标本术前1 d采集),有急性胆管炎病例,经抗感染治疗后好转(无休克症状,24 h体温不超过38.5 ℃)再行手术。
2.手术过程 所有病人在气管插管静脉麻醉下进行,首先解剖胆囊三角,暴露胆囊动脉夹闭并离断;解剖胆囊管并夹闭但不离断,便于牵拉暴露胆总管;打开胆总管表面脂肪组织及浆膜,使用剪刀剪开胆总管,在直径为3.7 mm奥林巴斯胆道镜下用取石钳和取石网篮取石,胆道镜下确定结石取净后、胆道无狭窄、Oddi括约肌收缩功能良好,缝合胆总管:对直径大于1.2 cm且增厚,采用强生3-0可吸收线;对于胆总管直径小于1.2 cm或胆管壁不增厚,采用柯惠5-0可吸收线。采用单根线自上而下,再自下而上连续缝合,保持针距1~1.5 mm,边距1.0 mm左右,打结松紧适宜,缝合后如有胆漏,间断缝合加固。离断胆囊管,切除胆囊,常规在胆囊床和肝肾隐窝放置引流管1~2根,自右上腹穿刺孔引出。
3.术后资料 根据国际肝脏外科学组(ISGLS)的定义[7],胆漏的诊断标准为:术后引流液中总胆红素浓度超过血浆总胆红素水平上限的3倍且持续时间≥3 d,或因腹腔胆汁性积液需要进行介入操作,或因胆汁性腹膜炎需要再次手术。根据严重程度分为三个等级。A级:不需要和需要很少的临床干预;B级:需要临床处理(如:额外增加的诊断或介入操作),但不需要再次手术,或A级胆漏超过1周;C级:胆漏需要再次手术。发生胆漏的病例,引流管引流量少于10 ml/d且持续3 d,拔除引流管。
三、统计学方法

结 果
200例病人中44例(22%)出现胆漏,所有胆漏病人均经过引流治愈,引流时间2~14 d,未发生需要介入或手术处理的C级胆漏。
对胆漏组和非胆漏组资料进行单因素分析,结果显示体质量指数(BMI)、糖尿病、肝硬化、胆总管结石数目、胆总管直径、白细胞计数、血红蛋白、血小板计数、血淀粉酶、手术时间、术中出血量及胆汁培养阳性两组间差异均无统计学意义(均P>0.05);胆漏组术前病程时间、丙氨酸转氨酶、肌酐、总胆红素均高于非胆漏组,血清白蛋白低于非胆漏组,差异均有统计学意义(均P<0.05),结果详见表1。
多因素分析结果显示术前病程时间长(OR=1.754,P<0.05),丙氨酸转氨酶水平升高是发生胆漏的独立危险因素(OR=1.031,P<0.05),血清白蛋白水平高是胆漏发生的保护因素(OR=0.764,P<0.05)。结果见表1。
对胆漏危险因素及保护因素纳入ROC曲线(图1、图2),分析得出术前病程时间cut-off值为5.5 d,曲线下面积(AUC)0.842,灵敏度0.773,特异度0.795,血清白蛋白cut-off值为28.25 g/L,AUC 0.890,灵敏度0.846,特异度0.773,丙氨酸转氨酶cut-off值为208.5 U/L,AUC 0.917,灵敏度0.818,特异度0.846。结果见表2。
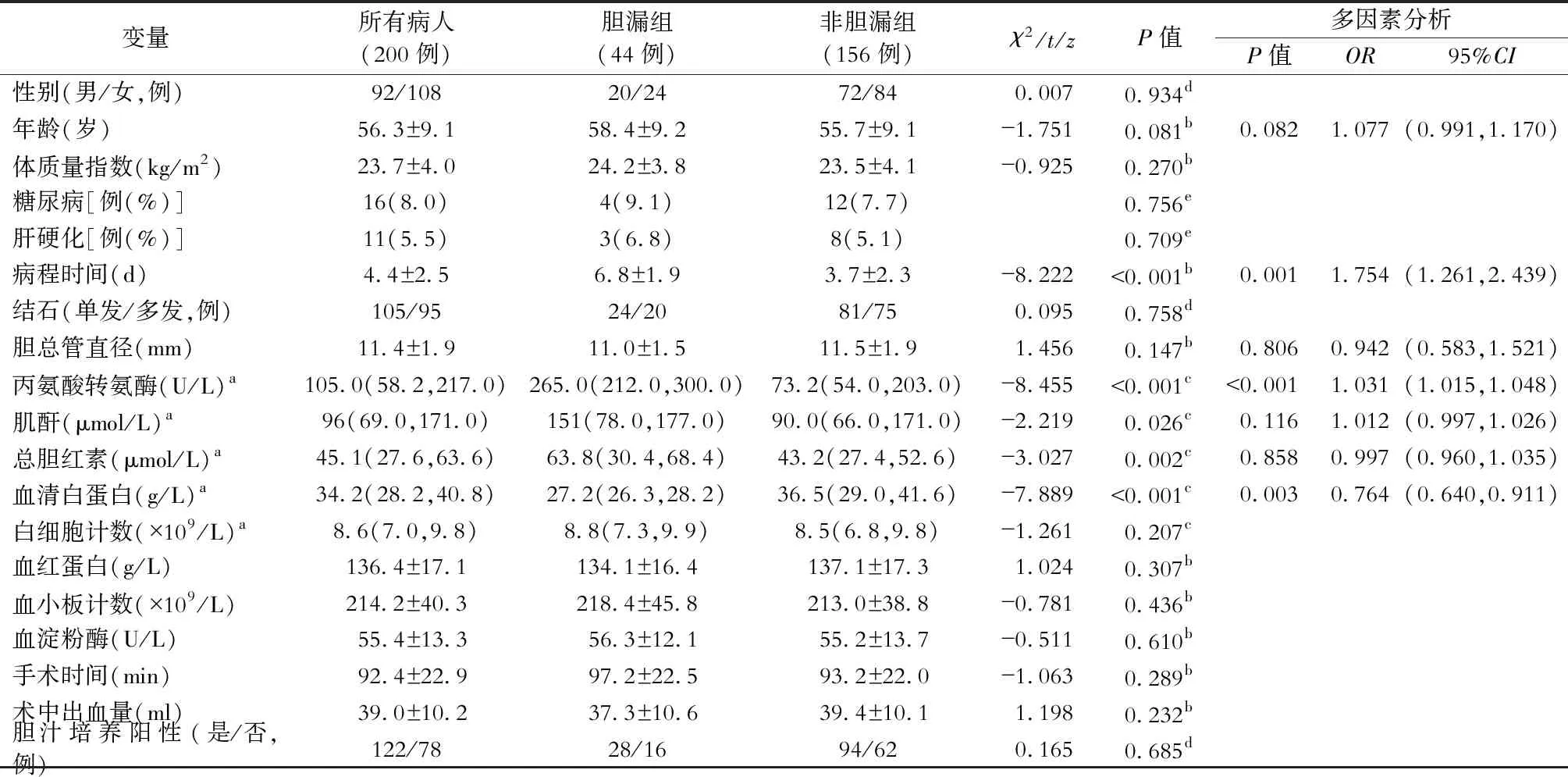
表1 胆漏的单因素分析和多因素分析
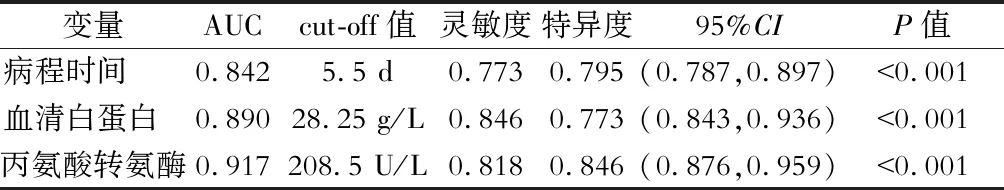
表2 胆漏独立危险因素的预测效能
讨 论
胆漏是胆道手术的主要并发症,尽管有些可以经保守治疗后痊愈,但严重的胆漏仍需介入甚至再次手术治疗,如处理不及时仍然会危及生命[8-9]。多年来,不少肝胆外科医生为了降低术后胆漏发生率,进行了一些临床探索。早期对于胆总管结石行胆总管切开探查后并不直接缝合,而是常规放置T管引流,其目的之一就是为了避免发生胆漏,但是大量临床研究发现术后T管放置会诱发感染、引起大量胆汁流失而不得不增加补液量[10-11],导致住院时间延长等弊端,甚至出现T管移位或因为拔管而诱发胆漏并发症[12]。因此胆总管探查术后常规T管放置术的方法开始受到质疑。
本研究纳入的病例是术中确认无结石残留、胆总管无狭窄的胆总管结石病人,所有的病例均行胆总管一期缝合。我们发现即便术后有胆漏发生,在确保引流通畅前提下,数日乃至数十日后胆漏也会自然愈合,而没有需要介入操作或再次手术的C级胆漏发生。当然,一期缝合对于术者的缝合技术要求更高,为了减少术后胆漏发生率,有学者总结出一些缝合经验[13]。我们的缝合经验是根据胆总管不同直径和胆管壁厚度采用3-0或5-0可吸收线连续缝合胆总管切口。同时,为了最大限度地避免缝合处胆漏的发生,我们以双层缝合的方式对其进行加固。本文病例胆漏的发生率为22%,这要高于以往的研究,这与我们所有入组病人均采用一期缝合有关,而有研究表明留置T管可以降低胆漏的发生率[14]。另外是针对直径较小的胆管,术者缝合时更担心缝合后出现胆总管狭窄的问题,因此缝合过程中并不追求非常严密的缝合。
本研究结果显示丙氨酸转氨酶增高和低蛋白血症是胆漏发生的独立危险因素。丙氨酸转氨酶是提示胆道炎症的主要指标之一,胆总管结石的病人往往合并胆道炎症、胆管壁水肿,缝合过程中容易被缝线切割造成胆漏,并且术后水肿的胆管壁不容易愈合,造成术后胆漏的发生。血清白蛋白是反应机体营养状况的重要指标,胆总管结石病人由于炎症导致白蛋白消耗,术前摄食减少、肝功能受损导致白蛋白合成减少,肾功能不全又会使白蛋白丢失过多,无论什么原因引起的低蛋白血症都能导致胆总管水肿,增加术中缝合的难度,并影响胆总管的愈合,继而发生胆漏,这与之前的报道相符合[15]。
高龄会增加胆漏的发生,有学者[16]对1 000例接受肝胆手术病人进行研究,结果发现25~45岁病人胆漏发生低于45~80岁病人,年龄因素与并发胆漏之间存在明显关联性。随着年龄的增大,机体的营养状况、抵御外界刺激的能力及肝肾功能都会有不同程度影响,但多因素分析后其不为影响胆漏发生的独立危险因素,这可能是本研究人群年龄偏大,两组年龄都在45~80岁之间,差异并不明显;也可能由于年龄因素通过其他危险因素而表现,比如高龄病人胆道炎症更重,术前血清白蛋白更低,术前需要抗感染治疗的时间更长。肌酐水平常用来衡量肾小球滤过功能,肾灌注不足、血管活性物质水平的改变、水电解质紊乱等多重因素的作用下使得血肌酐值高于正常水平。胆总管结石病人肌酐增高往往与胆管炎严重程度、年龄等因素密切相关,单因素分析显示胆漏组肌酐高于非胆漏组,但多因素分析结果显示肌酐增高并不是胆漏发生的独立危险因素,但肌酐仍是需要我们重视的指标,术前要尽量补足液体以避免肾灌注不足,并使用强有力的抗生素来控制感染,以减少毒素对肾脏的损伤。
虽然术前总胆红素含量和胆总管直径是诊断胆总管结石的敏感指标[17-18],但本研究中胆总管直径和总胆红素均未被发现是胆漏发生的独立危险因素。有学者[19]提出行胆总管一期缝合术者胆总管直径需≥4 mm,以避免胆总管缝合时的狭窄,但笔者发现即使术前胆总管不扩张,只要能使用胆道镜进行胆总管探查,就可以进行一期缝合。熟练的缝合技术既不增加胆漏的发生,也不会引起胆总管狭窄。总胆红素增高往往与胆道梗阻和胆道炎症有关,当取尽结石后胆道梗阻随之解除,而胆道炎症是引起胆漏的重要因素,但有梗阻并不意味一定有炎症,因此单因素分析提示胆漏组术前总胆红素增高,而多因素分析并未显示总胆红素增高是胆漏的危险因素。
最后我们发现术前病程时间长是胆漏的独立危险因素,可能的原因包括:首先,术前需要更长时间抗感染的病人往往胆管炎更重;其次,胆管炎较轻的病人,长时间的术前等待会增加胆管周围的炎症粘连和胆管壁的水肿,增加手术难度;由于急性胆管炎病人术前一直处于禁食状态,直至术后肛门排气后才恢复半流质饮食,由此引起的负氮平衡导致低蛋白血症,加重了胆管壁的水肿,引起术后胆漏。因此在全身情况允许前提下,需要我们尽早手术,以减少胆漏的发生。
术后胆漏的发生往往受多个因素共同作用,因此,术前对这些危险因素进行有效干预来预防胆漏的发生显得尤为重要。针对感染严重的胆总管结石病人,通过抗感染、护肝和输注白蛋白等综合手段进行术前干预,尽可能使丙氨酸转氨酶降低到208.5 U/L、术前血清白蛋白恢复到28.25 g/L情况下,在5.5 d内施行手术治疗,以降低胆漏发生率。
综上所述,术前病程长、术前丙氨酸转氨酶高和血清白蛋白低是胆总管结石行一期缝合后发生胆漏的危险因素,临床医生对术后胆漏高危病人的早期识别,并通过有效的干预措施,可以降低胆总管术后胆漏发生率。

