急性自发性孤立性内脏动脉夹层诊疗分析
王辉,高秀娟,马佩,李朋,陈刚,韩新强,盛玉国,徐英江
(1.滨州医学院附属医院创伤中心,山东 滨州 256603;2.滨州医学院附属医院神经血管外科,山东 滨州 256603;3.南京医科大学第一附属医院,江苏 南京 210029;4.滨州医学院附属医院介入血管外科,山东 滨州 256603)
急性自发性孤立性内脏动脉夹层(acute spontaneous isolated visceral artery dissection,AVAD)是一个罕见且凶险的血管源性疾病[1],首发症状多表现为腹部疼痛,若出现肠缺血或夹层动脉瘤破裂可能危及生命。随着影像技术不断发展,该病越来越多地被人们所认识[2]。有专家认为该病是一种自愈性疾病[3]。目前治疗方案包括抗栓治疗[抗凝药物治疗和(或)抗血小板药物治疗]以及侵入性治疗(腔内治疗和开放手术治疗)[4]。由于其罕见,该疾病的自然病程和治疗方案仍没有统一的或指南性的意见。本研究回顾性分析了我院25例AVAD病人的临床资料,分析发病特点及诊治策略,以期为该病诊治提供理论基础。
资料与方法
一、临床资料
回顾性分析2000年1月至2019年1月期间滨州医学院附属医院明确诊治的25例AVAD病人临床资料,其中肠系膜上动脉夹层(superior mesenteric artery dissection,SMAD)19例,腹腔动脉夹层(celiac artery dissection,CAD)6例。临床资料采集内容包括一般流行病学数据、临床表现、首发症状、影像学表现、治疗策略的选择及随访结果。本研究得到滨州医学院附属医院伦理委员会批准。应用检索相关的术语(如SMA夹层、肠系膜上动脉夹层、CA夹层、腹腔动脉夹层等)来识别AVAD病人病例资料。如果夹层发生在创伤、医源性损伤或伴随主动脉夹层的情况下,则予以排除。所有影像学资料均由一名放射科医生与一名血管外科医生共同阅览,以确保准确性。对于SMAD根据Yun分型分为三型:Ⅰ型,假腔有入口和出口,血流通畅;Ⅱa 型,血流可经入口进入假腔,但无出口;Ⅱb 型,假腔内血栓形成,无血流;Ⅲ型,夹层导致真、假腔均闭塞[5]。
二、治疗方法
1.非手术治疗 病人入院后若无腹膜炎均给予抗栓治疗(低分子肝素钠 100 U/kg ,皮下注射,1次/12 h;阿司匹林肠溶片100 mg/d和氯吡格雷75 mg/d,口服)。同时行禁饮食、胃肠减压、镇痛解痉、保护胃黏膜、适当肠外营养等治疗,合并高血压的病人血压应维持130/80 mmHg(1 mmHg=0.133 kPa)。在抗栓治疗下如腹痛症状缓解可考虑继续非手术治疗,并逐渐过渡饮食(流食—半流食—软食)。出院后低分子肝素桥接华法林继续抗凝(国际标准化比值控制在2.0~3.0,抗凝时间≥6个月)。同时继续抗血小板治疗(阿司匹林肠溶片100 mg/d,≥18个月)。
2.手术治疗 纳入的所有病人入院时若伴有弥漫性腹膜炎时给予开放手术治疗。腔内治疗包括:①经非手术治疗后腹痛症状无缓解或可疑肠缺血;②复查CT血管造影(CTA)显示动脉真腔受压>80%或夹层动脉瘤直径>2.0 cm。腔内治疗失败或出现弥漫性腹膜炎时,再考虑行开放手术治疗。手术治疗的病人,术后继续给予抗栓治疗。出院后继续华法林抗凝(抗凝时间≥6个月),抗血小板治疗(阿司匹林肠溶片100 mg/d,≥24个月,或氯吡格雷75 mg/d,≥12个月)。
三、随访
本组25例,随访率为84%(21/25)。随访时间2~92个月,平均随访21.5个月。出院后随访期间评估的结果包括症状、口服药物情况、合并症控制情况、支架的通畅程度、动脉瘤变化及是否有干预的指征、血管重构的情况等。
四、统计学分析
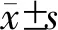
结 果
一、一般结果
共纳入25例AVAD病人(100%男性),平均年龄54.5岁(28~74岁),其中SMAD 19例,CAD 6例。12例(48%)病人有高血压病史,14例(56%)有吸烟史,其他心血管危险因素的患病率很低。值得注意的是,有21例(84%,21/25)表现为腹痛,2例无症状体检时偶然发现,2例腰背部疼痛,10例伴有恶心、呕吐。根据SMAD的Yun分型,Ⅱ型最多见,占58%(11/19),其中Ⅱa6例,Ⅱb5例;余Ⅰ型5例(26%),Ⅲ型3例(16%)。其中第1破口距肠系膜上动脉起始部的距离为23~61 mm,夹层长度为40~76 mm。第1破口距腹腔动脉起始部的距离为9~16 mm,夹层长度为6~13 mm。最终16例抗栓保守治疗7 d后腹痛症状消失;腔内治疗8例,其中支架置入术4例,弹簧圈栓塞术3例,肠系膜上动脉置管溶栓1例。1例SMADⅢ型病人腹痛症状严重,出现腹膜炎,急诊行肠系膜上动脉取栓+小肠切除术,术后病人出现短肠综合征需要长期肠外营养支持(表1)。
二、随访结果
本组25例病人中,初始行腔内治疗的(裸支架置入术)病人1例;开放手术治疗1例;初始接受抗栓治疗23例,其中16例病人保守治疗1周后腹痛症状明显改善,保守治疗有效率为70%(16/23)。随访期间有 5 例病人出现夹层进展,转行腔内治疗,1 例病人复查CTA显示真腔压缩狭窄出现饱餐后慢性腹痛,转行腔内治疗(图1),1例病人发现夹层动脉瘤转为腔内治疗,1例CAD假腔呈瘤样扩张,考虑夹层动脉瘤形成,行裸支架置入术(图2)。5例病人在随访期间经历了短期的餐后腹胀情况,后渐缓解。其余病人在随访期间均未出现症状复发,CTA 随访结果示76%(19/25)病人夹层假腔血栓化,真腔血供改善,8%(2/25)夹层完全重塑。
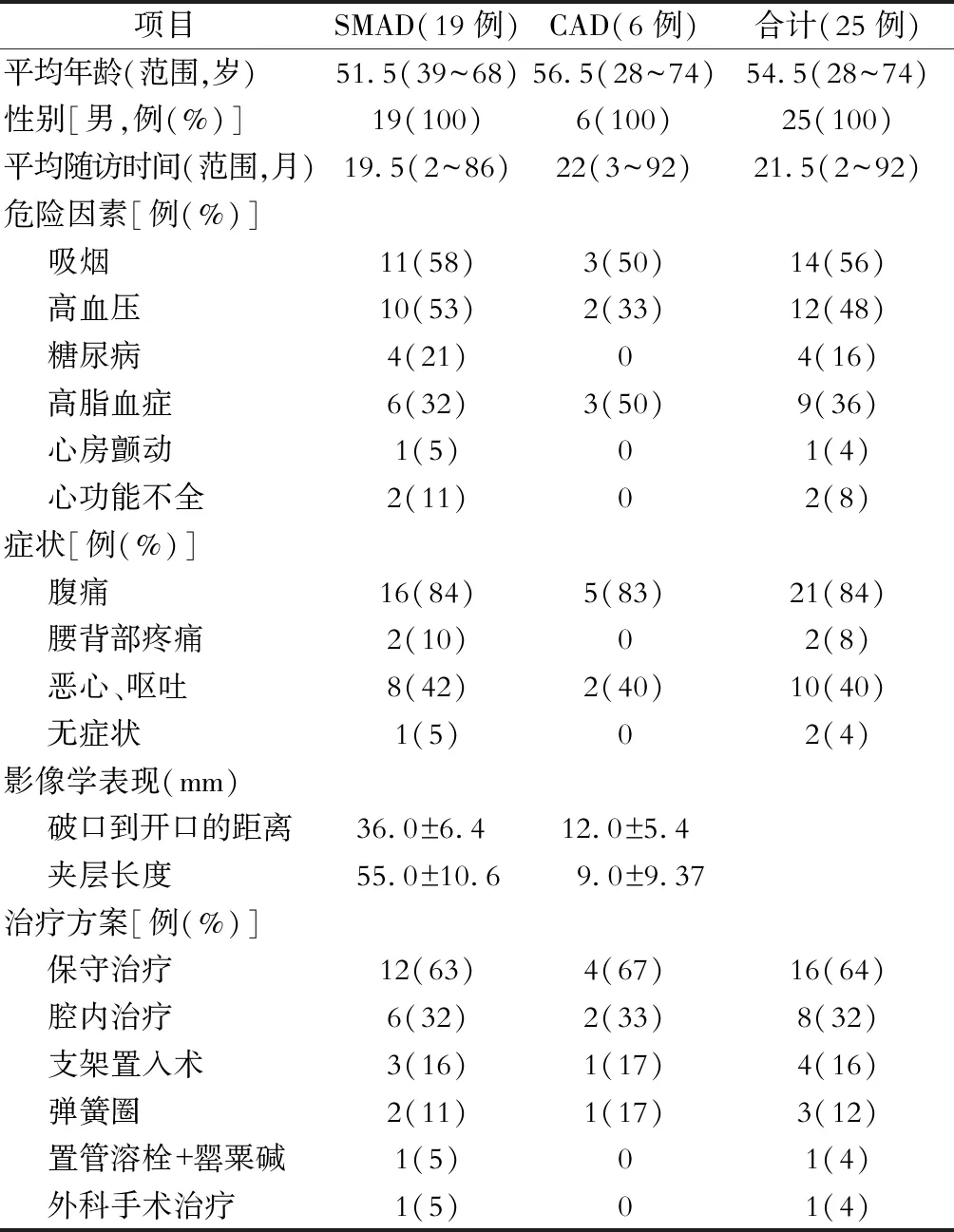
表1 25例AVAD病人的基本情况
讨 论
AVAD好发于中青年男性,潜在的病因包括动脉中膜囊性坏死、动脉粥样硬化、纤维肌发育不良和弹性组织紊乱(Marfan syndrome和Ehlers-Danlos病)[6]。然而,在大多数情况下具体病因尚不清楚。AVAD病因学说多样(如血流动力学、外伤、医源性及遗传性),但单纯的一种学说并不能完全解释其发病机制[7]。本病首发症状为腹痛,多为上腹部,且临床表现与体征不符,常伴有恶心,呕吐和(或)腹泻;少数人有慢性肠缺血的临床表现(肠痉挛、厌食和体重减轻);极少数病人无症状,偶然在体检中发现。然而,临床工作中我们发现SMAD较CAD腹部疼痛更为剧烈且临床症状与体征不符。原因一方面与肠管对于缺血、缺氧的耐受性差有关,另一方面各脏器的供血特点不同,肝脏为双重血供,胃、脾脏侧支循环丰富,而一旦肠管缺血短时间内能代偿的侧支循环较少,同时腹腔内脏末梢神经传来的冲动刺激呕吐中枢可引起恶心、呕吐症状[8-9]。
目前对于AVAD治疗方案尚存在争议。Ambo等[10]在1994年首次报道了应用单纯抗凝成功治疗1例SMAD,然而1998年Yasuhara等[11]在没有使用抗凝剂的情况下对2例SMAD病人进行成功治疗。2000年以前,外科开放手术是该病的主要治疗方案。手术方式包括夹层动脉段切除+移植物置换术、主动脉-肠系膜上动脉旁路移植术、右侧胃网膜-肠系膜上动脉旁路移植术、肠系膜上动脉补片血管成形术及动脉瘤内缝合术等。自2000年Leung等[12]首次报道腔内治疗SMAD以来,腔内治疗成为国内首选治疗方式[13]。根据颈动脉夹层的治疗经验,抗血小板治疗在预防短暂性缺血发作、脑卒中或死亡方面有效。颈动脉夹层的治疗结果可能对AVAD的管理存在指导意义[14]。在本中心,最初的治疗最常使用氯吡格雷桥接华法林治疗,然后在症状缓解和影像学上夹层稳定后过渡到单纯抗血小板治疗。
此外,影像学特点也对该病治疗方案的选择起着重要的作用。根据泊肃叶定律,液体流动阻力与半径的四次方成反比,与长度成正比[15]。基于这个理论,腹痛与真腔的直径和夹层病灶的长度有关。在该病的随访过程中更容易发生餐后腹痛及夹层动脉瘤,因此按时随访对于观察疾病动态变化非常关键。AVAD治疗方案的选择应该依据病人的临床症状和CTA影像而定,抗栓非手术治疗通常作为内脏动脉夹层一线治疗。抗栓非手术治疗失败或夹层动脉瘤形成时采用血管腔内治疗(图1)。当非手术治疗出现持续性或恶化的腹痛、肠缺血或动脉瘤性动脉破裂时选择开放式手术治疗。依据本中心经验,我们推断AVAD病人的自然病程转归的可能:①夹层逐渐趋向于稳定,假腔内血栓化,管腔完全重塑恢复正常形态;②夹层形态不变,入口出口持续存在,假腔内持续有血流;③假腔缓慢增大逐渐形成夹层动脉瘤;④夹层进展,导致真腔受压狭窄或闭塞,出现急性肠缺血坏死,严重时导致死亡。
综上所述,抗栓药物的非手术治疗应是AVAD的一线治疗方案,当怀疑肠缺血或夹层病变进展时,腔内治疗是安全可行的治疗方法。弥漫性腹膜炎出现时,应及时手术治疗。

