SYT1对肝癌细胞侵袭、转移的影响及其分子机制*
许静,喻超,杨盛力,孙诚谊**
(1.贵州医科大学附属医院 肝胆外科,贵州 贵阳 550004;2.贵州医科大学 肝胆胰脾重点实验室,贵州 贵阳 550004;3.贵州省肝胆胰脾疾病研究所,贵州 贵阳 550004)
恶性肿瘤属于国内临床病死率较高的疾病,而肝癌是导致癌症死亡的五大主要原因之一[1-2]。肝癌的发生具有种族和区域差异性,高发于发展中国家,中国每年新增肝癌病例数占全世界的二分之一以上[3]。肝癌早期症状并不明显,肿瘤标志物甲胎蛋白(alpha fetoprotein,AFP)在癌症初期的敏感性低[4],超声检查虽能提高检出率,但受检查者的临床经验以及机器的先进程度影响[5-8],因此患者确诊时往往已是中晚期;且肝癌恶性程度较高,病情进展快且容易发生转移[9],因此,亟需找到更有效的分子治疗靶点以获得更好的抗癌方法。突触囊泡蛋白(synaptotagmin, SYT)家族在人体内广泛分布,已知有多于17种的亚型,突触囊泡蛋白1 (synaptotagmin, SYT1) 作为突触小泡膜表面的Ca2+传感器,在胞吞胞吐以及囊泡转运时起至关重要的作用[10-12]。研究认为,SYT1能抑制直肠癌细胞的增殖,并且诱导其死亡[13],而SYT1在肝癌中的作用尚未有相关报道。前期预实验表明,抑制SYT1的表达能明显降低癌细胞的增殖率,有望在肝癌治疗上找到新思路。上皮-间充质转化(epithelial-mesenchymal transition,EMT)主要发生于上皮细胞来源的肿瘤,指上皮表型转化为间充质表型的现象,该过程涉及复杂的分子机制,与肿瘤的侵袭转移密切相关,可观察到肿瘤细胞中钙黏附蛋白E(E-cadherin)的表达下降,而波形蛋白(Vimentin)表达增多[14-17],因此,可检测这两种蛋白的表达量来验证肿瘤侵袭转移的分子机制。本文通过抑制SYT1表达后研究其对肝癌细胞的侵袭和迁移能力带来的影响,探讨沉默SYT1后抑制肝癌的分子机制。
1 材料与方法
1.1细胞株与主要试剂
在本研究中所使用的肝癌细胞株为Hep3B、Huh7、HCCLM3、SMMC-7721、HLF和BEL-7404,正常肝细胞HL-7702,由武汉华中科技大学附属协和医院肿瘤中心实验室惠赠,所使用的表达质粒为si-SYT1,DMEM(dulbecco's modified eagle medium)培养基、胰蛋白酶(TRYPSIN)、胎牛血清(fetal bovine serum,FBS)均购自美国gibco公司,Transwell小室购自美国Chemicon公司的ECM550,RNA提取试剂Trizol购自美国Invitrogen公司,引物SYT1、逆转录试剂盒、si-SYT1试剂盒均由武汉谷歌生物科技有限公司提供,proteintech公司提供SYT1、E-cadherin、 Vimentin一抗,CPTransfection kit 转染试剂盒购自广州锐博公司,4%多聚甲醛固定液、苏木精、结晶紫购自武汉博士德生物公司。
1.2方法
1.2.1细胞培养 用加了10%胎牛血清及1%双抗的DMEM培养基培养肝癌细胞Hep3B、Huh7、HCCLM3、SMMC-7721、HLF和BEL-7404,以及正常肝细胞HL-7702,并将Hep3B、Huh7根据转染的载体不同分组后,置于37 ℃、含5% CO2的恒温恒湿培养箱中。
1.2.2细胞转染 分别取对数生长期的Hep3B、Huh7细胞,2×105个/孔,均匀置于六孔板中培养,待6 h细胞贴壁,换液后,用SYT1表达空载体、SYT1干扰慢病毒及SYT1过表达慢病毒质粒分别转染两株细胞,分别为SYT1对照组(对照组)、SYT1干扰下调组(干扰组)和SYT1过表达组(过表达组),用lipofectamine3000促进转染。
1.2.3SYT1在肝癌组织及对应的癌旁组织中的表达 选取肝胆胰外科自2010年7月—2019年5月收集的150例原发性肝癌患者,采用免疫组化实验观察SYT1在肝癌组织及其对应癌旁组织中的表达。用4%多聚甲醛固定肝癌组织及癌旁组织,石蜡包埋,组织切片置于68 ℃恒温箱中,烘烤20 min,二甲苯浸泡20 min,更换二甲苯溶液再次浸泡20 min;依次用无水乙醇、80%乙醇、70%乙醇、3%H2O2分别浸泡10 min,用PBS洗去切片表面的其他液体(洗3次,每次5 min);再用0.01 mol/L枸橼酸缓冲液浸泡,并加热至95 ℃,加热20 min,再静置30 min待其冷却;用PBS溶液洗3次;室温下,用正常羊血清工作液封闭10 min;滴加一抗4 ℃过夜后,用PBS缓冲液洗3次,室温下加入二抗反应1 h, PBS缓冲液洗3次;DAB显色液染色10 min,PBS冲洗10 min,苏木精复染,自来水冲洗10 min,脱水、透明、封片,显微镜观察SYT1在肝癌组织和癌旁组织中的表达。
1.2.4SYT1在不同肝癌细胞及正常肝细胞中的表达 用Trizol溶液提取RNA,SYBR Premix ExTaq试剂盒进行qPCR实验:经去基因组、总RNA纯度和完整性检测后,将样品进行逆转录、扩增,qPCR反应体系为5μmol/L qPCR primer 0.9 μL, SYBR(2X) 7.5μL,DdH2O 5.6 μL,待检测样品 1 μL,经95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,循环40次。SYT1引物F链为GCTGCTGGTAGGGATCATTCR链为GTTTTTCGGTGGACTTTTGTCTC,GAPDH引物F链为GGAGCGAGATCCCTCCAAAATR链为GGCTGTTGTCATACTTCTCATGG。以GAPDH为内参,以2-ΔΔCt表示目的基因相对表达量,实验重复3次,结果取平均值。
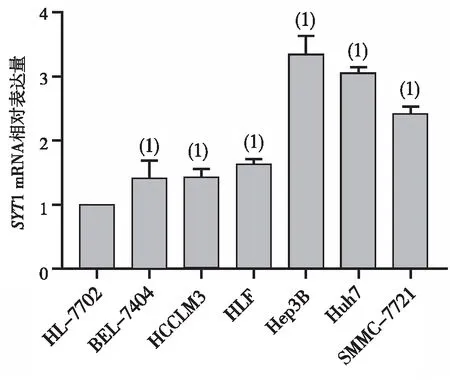
1.2.5SYT1对肝癌细胞迁移能力的影响 分别取对数生长期的Hep3B、Huh7细胞,将细胞分为对照组和干扰组。利用由医用级硅胶制作的OrisTM细胞接种限位塞(cell seeding stoppers),将细胞接种于96孔板内的外环形区,接种数为 40 000 个/孔,设置 3个复孔。6 h后细胞贴壁,更换培养液并用Calcein-AM进行细胞染色,染色30 min后,使用Cell Analyzer 6500HS机器采集图像,作为0 h图像。然后继续培养48 h,再次采集图像,计算迁移率。迁移比率=(干扰组迁移48 h的细胞面积-干扰组迁移0 h的细胞面积)/(对照组迁移48 h的细胞面积-对照组迁移0 h的细胞面积)。
1.2.6SYT1对肝癌细胞迁移、侵袭能力的影响 将转染后的Hep3B、Huh7细胞分为对照组、干扰组和过表达组,用带有基质胶的transwell小室和不带基质胶的transwell小室,分别进行细胞迁移和侵袭实验。用无血清的DMEM培养基制备细胞悬液,调整细胞浓度至2×105/mL。取200 μL 铺于Transwell小室上室,下室加入500 μL含10%胎牛血清的DMEM 培养基中,置于37 ℃、5% CO2培养箱中孵育24 h。24 h后取出Transwell小室上室,用棉签擦去基质胶和上室内的细胞,固定后结晶紫染色,在显微镜下拍照和计数,结果取平均值。实验设置3 个复孔,重复3 次。
1.2.7E-cadherin和Vimentin在Hep3B、Huh7细胞中的表达 待Hep3B、Huh7细胞长满80%~90%后(约72 h),将细胞置于冰上用RIPA裂解,提取总蛋白;5×loading buffer于100 ℃隔水加热7 min,用90 V恒压电泳、200 mA恒流转膜2 h,4 ℃一抗摇床孵育过夜,室温下二抗孵育2 h;洗膜,检测蛋白表达。
1.3统计学处理
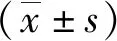
2 结果
2.1SYT1 mRNA和蛋白在肝癌组织及对应的癌旁组织中的表达
在肝癌组织和对应癌旁组织中SYT1 mRNA相对表达量分别为1.68 ± 0.21、4.36 ± 0.33,与癌旁组织比较,肝癌组织中SYT1 mRNA和蛋白相对表达量增加(P<0.05)。见图1。
注:A为SYT1 mRNA的表达(qPCR检测结果),B为SYT1蛋白免疫组化结果(HE,×100);(1)与癌旁组织比较,P<0.05。图1 SYT1 mRNA和蛋白在肝癌组织及其对应癌旁组织中的表达Fig.1 Expression of SYT1 mRNA and protein in liver cancer tissues and para-carcinoma tissues
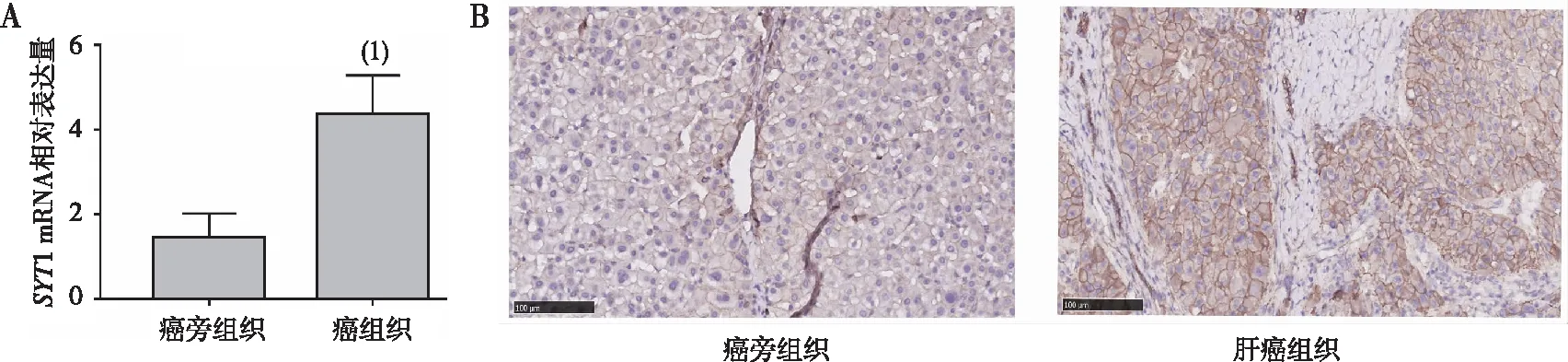
2.2SYT1在不同肝癌细胞及正常肝细胞中的表达
正常肝细胞HL-7702中SYT1的表达低于6株肝癌Huh7、Hep3B、HCCLM3、SMMC-7721、HLF和BEL-7404细胞,其中SYT1在Huh7和Hep3B细胞中的表达又高于其他肝癌细胞(P<0.05)。见图2。
注:(1)HL-7702与比较,P<0.05。图2 SYT1在不同肝癌细胞及正常肝细胞中的表达Fig.2 Expression of SYT1 in different hepatocellular carcinoma cells and normal liver cells
2.3SYT1对肝癌细胞侵袭转移能力的影响
OrisTM细胞迁移实验结果显示,Hep3B和Huh7干扰组细胞迁移能力低于对照组,Hep3B、Huh7的细胞迁移比率分别为0.880 2、0.872 4,差异有统计学意义(P<0.05,图3),提示干扰SYT1的表达后,细胞迁移能力降低。Transwell细胞迁移实验显示,与对照组比较,Hep3B和Huh7干扰组细胞迁移数降低,过表达组的细胞迁移数升高,差异有统计学意义(P<0.05,表1和图4);与对照组比较,Hep3B和Huh7干扰组细胞中代表肝癌细胞侵袭能力的细胞数目较少,过表达组的侵袭细胞增多,差异具有统计学意义(P<0.05,表2和图4),提示过表达组的细胞侵袭、迁移能力明显高于对照组及干扰组的肝癌细胞。

表1 各组Hep3B和Huh7细胞Transwell细胞迁移实验迁移细胞数Tab.1 The number of migration cells in Transwell cell migration test in Hep3B and Huh7 cells of each group

表2 各组Hep3B和Huh7细胞Transwell细胞侵袭实验迁移细胞数Tab.2 The number of migration cells in Transwell cell invasion test in Hep3B and Huh7 cells of each group
2.4SYT1对肝癌细胞中E-cadherin和Vimentin表达的影响
Western blot结果显示,与对照组比较,干扰组Hep3B、Huh7细胞中E-cadherin蛋白表达量增加,而Vimentin蛋白表达量下降,差异有统计学意义(P<0. 05)。见图5。
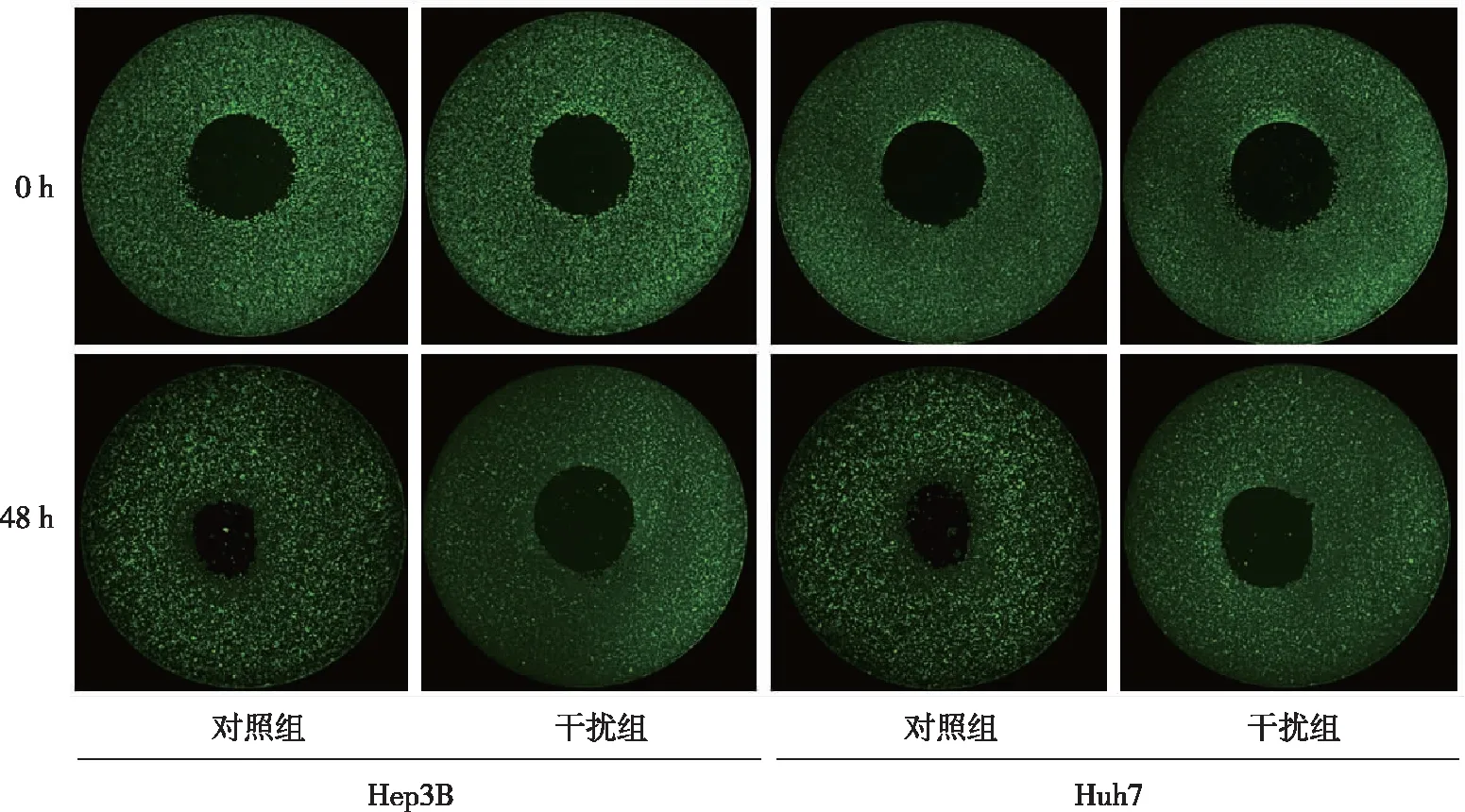
图3 干扰SYT1的表达对 Hep3B和Huh7细胞迁移能力的影响Fig.3 Effect of knockdown of SYT1 expression on cell migration ability in Hep3B and Huh7 cells of each group
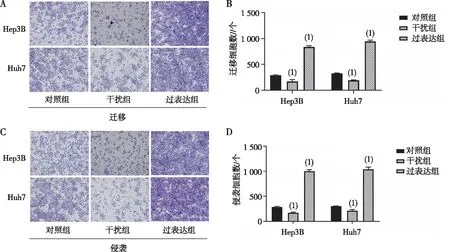
注:A、B为Transwell细胞迁移实验结果,C、D为Transwell细胞侵袭实验结果;(1)与对照组比较,P<0.05。图4 SYT1对 Hep3B和Huh7细胞迁移、侵袭能力的影响Fig.4 Effect of SYT1 on cell migration and invasion in Hep3B and Huh7 cells of each group

图5 SYT1对 Hep3B和Huh7细胞中E-cadherin和Vimentin表达的影响(Western blot)Fig.5 Effect of SYT1 on E-cadherin and Vimentin expression in Hep3B and Huh7 cells of each group(Western blot)
3 讨论
越来越多的研究显示SYT1不仅在转运囊泡时起着至关重要的作用[18-19],也可影响认知功能[20]、与阿茨海默症相关[21]、抑制结肠癌细胞并诱导癌细胞凋亡等[22]。然而,SYT1在肝癌领域的研究尚少,对于它的作用机制更是尚未清楚。本研究探究了SYT1对肝癌细胞侵袭、转移影响,并寻找其可能的分子机制。通过细胞功能试验发现,敲低SYT1的表达后,明显降低了肝癌的侵袭和迁移能力,这对于提高肝癌患者的预后有着积极的意义。接着又探究SYT1对钙粘附蛋白E和波形蛋白表达的影响,以期寻找SYT1促进肝癌侵袭迁移与EMT的关系。
本研究干扰SYT1的表达后,通过免疫印迹实验检测Vimentin和E-cadherin的蛋白表达水平,进一步探究SYT1促进肝癌细胞侵袭迁移能力的分子作用机制与EMT的相关性。SYT1在肝癌细胞和组织中的表达明显高于癌旁细胞,表明该基因与肝癌相关。Transwell和OrisTM细胞迁移实验结果显示,SYT1的下调使得肝癌细胞侵袭、迁移能力下调,提示肝癌的侵袭迁移与该基因密切相关。Western blot实验又证明了SYT1可以促进EMT的发生。
综上所述,本研究结果证实,SYT1作为一种膜蛋白,可增强肝癌细胞增殖、迁移,从而促进肝癌的恶化进程;还证实了,SYT1表达的降低,使Vimentin表达降低而E-cadherin的表达升高,说明SYT1促进了EMT的发生,这可能是SYT1促进肝癌细胞侵袭转移的一个途径。

