GC不同给药途径对MPP患儿的疗效及炎症反应、免疫功能的影响
施佳,王兆平
(1.铜陵市妇幼保健院儿科,安徽 铜陵 244000; 2.铜陵市立医院内科,安徽 铜陵 244000)
肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia,MPP)是儿科的常见疾病,其发病率居儿童肺炎的第二位,占社区获得性肺炎的10%~30%,且发病率呈逐年上升趋势[1]。高热、咳嗽、咽喉肿痛是MPP患儿的主要临床表现,严重者可出现肺不张而诱发呼吸衰竭甚至全身多器官功能损害,严重影响患儿的生命安全及生长发育[2-3]。临床根据MPP的发病特点及诊疗指南,将具有吸收快、疗效长等特点的大环内酯类药物作为此类患儿的首选药物[4-5]。然而,随着大环内酯类药物的广泛应用,肺炎支原体(Mycoplasma pneumoniae,MP)的耐药性也逐渐增强,已难以满足临床治疗需求。为提高MPP的治疗效果,有学者将糖皮质激素(glucocorticoid,GC)应用于MPP患儿的辅助治疗,并取得了较为满意的临床疗效[6]。部分研究显示,雾化吸入GC不仅可增强药物的临床疗效,缩短治疗周期,还可降低恶心、呕吐、继发感染、睡眠障碍等不良反应发生率,疗效显著优于全身给药[7-9]。本研究旨在探讨GC不同给药途径对MPP患儿的疗效及炎症反应、免疫功能的影响,以期为MPP的临床治疗提供参考。
1 资料与方法
1.1一般资料 收集2017年9月至2019年9月铜陵市妇幼保健院收治的97例MPP患儿的临床资料进行回顾性分析,根据GC给药途径分为雾化吸入组(n=49)和全身用药组(n=48)。纳入标准:①符合《诸福棠实用儿科学》[10]中MPP的诊断标准;②年龄为1~14岁;③入选前2周内无抗生素、GC等可能影响本研究结果的药物应用史。排除标准:①合并有先天性或获得性免疫系统缺陷;②合并有先天性呼吸道疾病及心脏病;③合并有其他病原菌感染;④对本研究所用药物过敏或为过敏体质;⑤入选前3个月内有急性感染性疾病史。本研究经铜陵市妇幼保健院医学伦理委员会批准,患儿家属均签署知情同意书。
1.2治疗方法 雾化吸入组:在退热、止咳等常规治疗的同时,将注射用阿奇霉素(东北制药集团沈阳第一制药有限公司生产,批号:160806,180317,190608)10 mg/(kg·d)溶入200 mL 5%葡萄糖溶液中静脉滴注,每日1次,连续滴注5 d;停止滴注4 d 后,改为阿奇霉素肠溶片(华北制药股份有限公司生产,批号:FAR2906002)或阿奇霉素干混悬剂(国药集团汕头金石制药有限公司生产,批号:170303,180902,190704)10 mg/(kg·d)口服,每日1次,连续服用3 d,停服4 d。同时,将吸入用布地奈德混悬液(澳大利亚阿斯利康有限责任公司生产,批号:LOT325823)1~2 mL溶入2 mL 0.9%氯化钠注射液中雾化吸入10 min,每日2次(间隔4 h以上),连续吸入15 d。此后根据患儿具体情况重复治疗。
全身用药组:在退热、止咳等常规治疗的同时,分别将注射用阿奇霉素10 mg/(kg·d)以及注射用甲泼尼龙琥珀酸钠(河南国药集团容生制药有限公司生产,批号:17121206,18060507,19092905)2 mg/(kg·d)溶入200 mL 5%葡萄糖溶液中静脉滴注,每日1次,连续滴注5 d;停止滴注4 d后,改为阿奇霉素肠溶片或阿奇霉素干混悬剂10 mg/(kg·d)以及醋酸泼尼松片(上海上药信谊药厂有限公司生产,批号:018170301,018180602,018190901)1 mg/(kg·d)口服,每日1次,连续服用3 d;停止服用4 d后根据患儿具体情况重复治疗。
1.3疗效判断标准 治疗10 d后,参照楚玉波[11]的疗效判断标准评估患儿临床疗效:患儿咳嗽、发热等症状基本消失,实验室和肺部影像学检查结果正常为显效;患儿咳嗽、发热等症状明显改善,肺部影像学检查结果显示肺部阴影明显吸收为有效;患儿咳嗽、发热等症状无改善或加重,肺部影像学检查结果显示肺部阴影无改变为无效。显效率=显效例数/总例数×100%。
1.4观察指标 分别于治疗前及治疗第5、10天,采集患儿空腹外周静脉血5 mL,4 ℃、离心半径10 cm、3 000 r/min离心5 min后取上清液,采用双抗体夹心酶联免疫吸附法检测炎症因子[白细胞介素(interleukin,IL)-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]水平,采用速率散射比浊法检测免疫指标[免疫球蛋白(immunoglobulin,Ig)A、IgG和IgM]水平。观察并记录两组患儿肠胃不适、口腔溃疡等不良反应的发生情况。

2 结 果
2.1两组患儿一般资料比较 两组患儿的性别、年龄、体质指数、病程比较差异无统计学意义(均P>0.05)。见表1。
2.2两组患儿的临床疗效比较 治疗10 d后,雾化吸入组的显效率高于全身用药组[63.27%(31/49)比41.67%(20/48)](χ2=0.366,P=0.545),雾化吸入组的临床疗效优于全身用药组(Z=-2.125,P=0.034)。见表2。
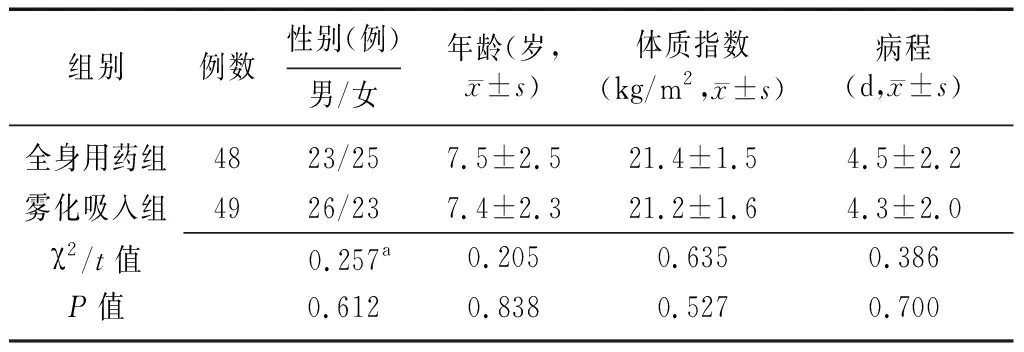
表1 两组MPP患儿的一般资料比较
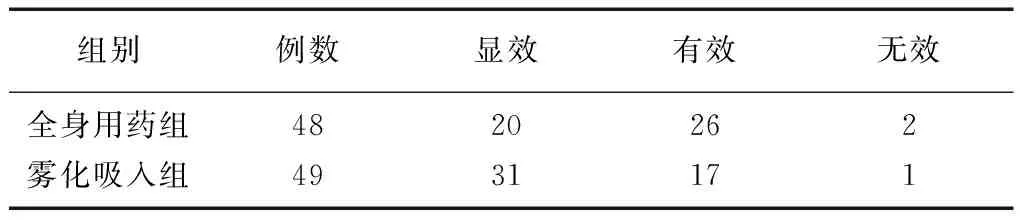
表2 两组MPP患儿的临床疗效比较 (例)
2.3两组患儿的炎症因子水平比较 治疗前后IL-6、IL-10、TNF-α水平的主效应差异有统计学意义(P<0.05);不考虑测量时间,两组间IL-6、IL-10、TNF-α水平的主效应差异有统计学意义(P<0.05);各指标组间和时间点间存在交互作用(P<0.05),两组各指标治疗前后的变化趋势不同,治疗后两组患儿的IL-6、IL-10、TNF-α水平呈下降趋势(P<0.05),治疗第5天雾化吸入组高于全身用药组(P<0.05),治疗第10天雾化吸入组低于全身用药组(P<0.05)。见表3。
2.4两组患儿的免疫指标水平比较 治疗前后IgA、IgG、IgM水平的主效应差异有统计学意义(P<0.05);不考虑测量时间,两组间IgA、IgG、IgM水平的主效应差异有统计学意义(P<0.05);各指标组间和时间点间存在交互作用(P<0.05),两组各指标治疗前后的变化趋势不同,治疗后两组患儿的IgA、IgG水平呈升高趋势,且雾化吸入组各时点均高于全身用药组(P<0.05);而IgM水平呈下降趋势,且治疗第5天雾化吸入组高于全身用药组(P<0.05),治疗第10天雾化吸入组低于全身用药组(P<0.05)。见表4。
2.5两组患儿的不良反应发生情况比较 治疗过程中,全身用药组有8例患儿出现肠胃不适,5例患儿出现口腔溃疡,总不良反应发生率为27.08%(13/48);雾化吸入组有2例患儿出现肠胃不适,1例患儿出现口腔溃疡,总不良反应发生率为6.12%(3/49)。雾化吸入组总不良反应发生率低于全身用药组(χ2=4.571,P=0.033)。
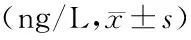
表3 两组MPP患儿治疗前后的炎症因子水平比较

表4 两组MPP患儿治疗前后的免疫指标水平比较
3 讨 论
研究显示,MP的感染率可随年龄的增长而不断升高,其中6岁以上肺炎患儿的MP检出率可高达62%[12]。MP感染除可引发肺炎甚至呼吸衰竭外,部分患儿还可出现肝肾功能损伤、免疫性溶血性贫血、心肌炎等多系统损害[13-14]。近年来,临床将红霉素、罗红霉素、阿奇霉素等大环内酯类抗生素作为MP感染患儿的首选治疗药物,但随着抗生素的广泛应用,其耐药性也逐渐增强。因此,临床将对机体免疫功能具有重要调节作用的GC应用于MMP患儿的辅助治疗,并取得了显著疗效,但全身给药与雾化吸入两种不同给药途径的临床疗效差异较大[9]。本研究结果显示,雾化吸入组的临床疗效显著优于全身用药组,与上述研究结果一致。
随着MP致病机制研究的深入,有研究指出MMP是一种免疫相关性疾病,其可诱发机体变态反应,引起气道变态反应性炎症,同时可刺激机体释放多种炎症因子,引发炎症反应,从而导致患儿肺组织严重损伤甚至诱发全身多器官功能障碍[15]。其中,IL-6、TNF-α为典型的促炎因子,IL-10为典型的抗炎因子,均具有免疫调节活性。MP感染后免疫系统被激活,刺激T淋巴细胞、单核巨噬细胞等大量分泌IL-6,IL-6可调动TNF-α诱导中性粒细胞趋化、增殖,进而导致肺组织广泛损伤,甚至诱发机体多器官功能障碍[16-17];且高水平IL-6还可在促进B细胞大量合成的同时,抑制T细胞活性,从而引发机体的免疫损伤[18]。有研究显示,MPP患儿的血清IL-6、TNF-α水平明显高于健康儿童,且其水平与机体感染及损伤程度呈正相关[19-20]。IL-10可抑制单核巨噬细胞、T淋巴细胞等免疫细胞的活性,在降低机体免疫反应的同时,拮抗促炎因子作用,限制炎症扩散[21]。研究发现,MPP患儿的血清IL-10水平明显高于健康儿童,且其水平随炎症反应的减轻而降低[22-23]。本研究结果显示,治疗后,两组患儿的IL-6、IL-10、TNF-α水平均降低,且治疗第5天雾化吸入组高于全身用药组(P<0.05),治疗第10天雾化吸入组低于全身用药组(P<0.05),说明GC雾化吸入与全身用药均能减轻患儿的炎症反应,由于全身用药组第5天停药致使其治疗后期药物浓度较低,而持续用药的雾化吸入组虽然治疗初期药物浓度不及全身用药组,但始终维持在同一水平,药效发挥稳定,对炎症反应的调节作用也相对稳定[24]。
免疫球蛋白是体液免疫反应中的重要活性物质,其中分泌型IgA是机体黏膜防御系统的重要免疫球蛋白,可发挥免疫屏障作用[25];IgG在抗感染中具有主导作用,约占所有免疫球蛋白的75%,可对抗大部分病原微生物,其水平在机体感染后逐渐升高并在机体恢复期达到高峰[26];IgM是机体感染后最早产生的免疫球蛋白,在感染初期即可快速升高[27]。冉江帆[28]的研究显示,MPP患儿血清IgA水平明显低于健康儿童,而IgG、IgM水平明显高于健康儿童。GC可通过抑制淋巴细胞功能,IL-6、TNF-α等相关炎症因子释放以及中性粒细胞、单核巨噬细胞等炎症细胞聚集而减轻免疫反应及肺组织损伤。本研究结果显示,治疗后,两组患儿的IgA、IgG水平均升高,且雾化吸入组各时点均高于全身用药组(P<0.05);而IgM水平降低,且治疗第5天雾化吸入组高于全身用药组(P<0.05),治疗第10天雾化吸入组低于全身用药组(P<0.05)。可见,GC雾化吸入及全身用药均可有效调节机体免疫功能,减轻MPP患儿炎症反应程度。全身用药虽可早期快速减轻患儿的炎症反应,但用药过程中存在停药期,且对机体自身免疫功能抑制作用更强,故后期效果较持续用药的雾化吸入差,而雾化吸入后GC可直接沉积于肺组织通过与气道黏膜上皮细胞激素受体结合抑制局部炎症反应,同时还可扩张气道平滑肌,进而改善患儿呼吸功能[24]。另外,GC还可抑制机体自身防御机制,通过促进胃蛋白酶及胃酸的分泌破坏胃黏膜保护屏障等途径诱发胃部不适、口腔溃疡等不良反应,且全身用药不良反应发生率明显高于局部用药[29]。本研究结果显示,雾化吸入组的总不良反应发生率明显低于全身用药组。
综上所述,GC雾化吸入可有效降低MPP患儿的炎症反应、调节免疫功能和不良反应发生率,临床疗效持续且稳定,显著优于快速起效但无法维持强效抗炎作用的GC全身用药。但本研究未设置雾化吸入与全身用药联合应用的对照组,全身用药早期快速下调炎症因子的表达水平联合雾化吸入的长期作用效果是否能显著提高MPP的治疗效果有待进一步研究。

