配合饲料和冰鲜饵料对拟穴青蟹养殖的影响
周 凡,彭 建,陈丽芝,线 婷,王芳芳,王 政,陈刘浦,贝亦江,阮贇杰,丁雪燕*
(1.浙江省水产技术推广总站,浙江 杭州 310023;2.浙江省三门县水产技术推广站,浙江 三门 317100;3.浙江大学新农村发展研究院,浙江 杭州 310058)
青蟹,隶属于甲壳纲、十足目、梭子蟹科,青蟹属;因其肉质鲜美、营养丰富,兼有滋补强身功效,素有“海上人参”之称[1-2]。据《2019年中国渔业统计年鉴》,全国青蟹养殖产量达15.77×104t,主要分布在广东(6.06×104t)、福建(3.63×104t)、浙江(2.54×104t)、广西(1.95×104t)、海南(1.38×104t)等沿海省份[3],是重要的海水养殖经济蟹类。传统青蟹养殖基本是投喂冰鲜饵料,这种粗放型“以鱼养蟹”的模式对海洋渔业资源和环境影响较大,且冰鲜饵料常携带寄生虫和病菌,易导致水体污染和病害暴发,造成养殖效益不稳定。因此,在青蟹养殖中示范与推广使用配合饲料,对于推动青蟹养殖业的可持续健康发展和转型升级具有重要意义。
本试验选择浙江沿海养殖的拟穴青蟹(Scyllaparamamosain)及池塘蟹-虾-贝的混养模式[4],对比分析了配合饲料和冰鲜饵料对拟穴青蟹肌肉营养组成、消化酶活性、水质指标、环境微生物菌以及养殖效益的影响,旨在为配合饲料在青蟹养殖业中的推广应用提供参考。
1 材料与方法
1.1 试验对象与饲料
养殖试验在浙江省三门县金屿水产养殖专业合作社进行。选取养殖池塘2口,其中一口池塘投喂冰鲜饵料(1.2 hm2),设为对照塘,另一口池塘投喂青蟹膨化配合饲料(0.8 hm2),设为试验塘。青蟹膨化配合饲料由宁波天邦股份有限公司生产,基本营养组成为粗蛋白42.3%、粗脂肪8.6%、粗灰分13.9%、水分10.2%;饲料粒径2.2 mm,水中稳定性2 h以上。
本试验所用的拟穴青蟹幼蟹规格整齐,附肢健全,初始体质量30 g,放养量1 200只/667 m2;脊尾白虾(ExopalaemoncarinicaudaHolehuis)虾苗放养密度为0.2 kg/667 m2。缢蛏(Sinonovaculaconstricta)和泥蚶(TegillarcagranosaLinnaeus)苗种投放量分别为10 kg/667 m2和38 kg/667 m2。
1.2 养殖试验
投喂管理:养殖期间,每日投喂两次,冰鲜饵料塘日投饲率从15%~30%(甲壳宽<8 cm)减少到8%~12%(甲壳宽>8 cm);配合饲料塘日投饲率与冰鲜饵料塘比为1∶4左右。饲料散投在池塘四周的固定滩面,上午06:00~07:00,投喂量占30%,下午17:00~18:00,投喂量占70%;每次投喂量以2 h内摄食完毕为宜,视青蟹的生长、摄食和天气等情况适当调整。养殖饲喂周期5个月。
日常管理:池塘水位以保持在1 m左右,高温期提高至1.2~1.5 m;3~4 d换水一次,日换水量20%~30%;养殖前、后期水温在15℃以上时采用EM菌+芽孢杆菌+红糖培水。池塘养殖每天早晚各巡池一次,检查闸门、堤坝、防逃等设施和水色、水位,观察青蟹的活动和摄食情况,及时清除残饵和死蟹。养殖期间未爆发疾病,也无缺氧、翻塘等现象发生。
1.3 试验分析
1.3.1 生物样品采集与分析
养殖5个月后,使用笼捕法从每个池塘随机采样10只青蟹,游标卡尺逐一测量形体数据,并用电子天平称重;打开甲壳,分离雌蟹的肝胰腺与卵巢;同时取其头胸甲覆盖下方的躯干部肌肉,均分成3份,用于常规营养成分检测。在冰盘上分离胃和肠道组织,用冰冻双蒸水冲洗组织内壁,匀浆器中加入样品和9倍去离子水,高速冷冻离心机(3 000 r·min-1)离心10 min,所得上清液置于-20℃冰箱中保存,用于消化酶活性检测。
肌肉常规成分参照AOAC(2006)方法测定[5]:水分采用105℃烘干法、粗蛋白用凯氏定氮法(N×6.25)、粗脂肪用索氏乙醚浸提法、粗灰分用550℃马福炉灼烧法。磷含量采用GB/T 6437—2002标准测定。消化酶活性测定使用试剂盒(南京建成生物工程研究所)。酶液蛋白浓度采用考马斯亮蓝法进行测定;胃蛋白酶活性定义为每mg组织蛋白在37℃每min分解蛋白生成1 μg氨基酸为1个酶活单位;胰蛋白酶活性定义为在pH 8.0和37℃条件下,每mg蛋白中含有的胰蛋白酶每min使吸光度变化0.003为1个酶活力单位;脂肪酶活力定义为在37℃时每g组织蛋白在反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活单位;淀粉酶活力定义为每mg组织蛋白在37℃与底物作用30 min,水解10 mg淀粉定义为1个酶活单位。
1.3.2 形态学指标计算
拟穴青蟹的肝胰腺指数(HSI)和性腺指数(GSI)计算公式如下:
肝胰腺指数(HSI,%)=(肝胰腺湿重/蟹体湿重)×100;
性腺指数(GSI,%)=(性腺湿重/蟹体湿重)×100。
1.3.3 底泥和水样采集与分析
在养殖高温期,利用5点采样法采集样品,即选取两个养殖塘对角线的交点以及对角线上与交点等距的4个点作为采样点。每个点使用2.5 L有机玻璃采水器取距离水面40 cm处的水样,均匀混合作为供试水样;池塘沉积物也按照5点采样方式采集,沉积物利用沉积物柱状采集器收集10 cm左右处的塘底沉积物。样品均于4℃保存,DNA提取在24 h内完成。过滤后的水样,参考海洋监测规范(GB 17378—2007),测定包括氨氮、亚硝酸盐氮、硝酸盐氮、活性磷酸盐和总有机碳等常规水质指标。
取采集的两个池塘水样各100 mL,经0.22 μm无菌纤维素滤膜过滤后用无菌剪刀剪碎滤膜,用于DNA提取;取采集的两个池塘的沉积物样各500 mg,分别提取DNA。上述水体、沉积物的总DNA提取均使用Power Soil DNA试剂盒(Mo Bio Laboratories,Carlsbad,CA,USA),按照试剂盒说明书进行。将提取的细菌总DNA作为模板,设计含有bar-code的16S DNA的V3~V4可变区扩增引物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)引物扩增细菌16S rRNA的V3~V4区。PCR扩增的程序参考Deng等[6]的方法。PCR扩增产物使用琼脂糖2%凝胶电泳检测质量后,用Gene JET凝胶提取试剂盒(Thermo Scientific,Waltham,MA,USA)进行纯化。使用Illumina Hi Seq平台对定量的DNA进行16S rDNA扩增子测序(参考NCBI数据库,序列号PRJNA561204)。
通过UCHIME Algorithm与数据库Gold database对测序数据进行去杂质控,得到有效数据。利用Uparse(V8.1.1861)对所有样品的全部Effective Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs。根据Silva数据库将检测到的OTU进行分类分析。以OTU的物种分类谱系结果为依据,在门和属的分类水平对各样本进行丰度分析。
1.4 数据处理
试验数据表示为平均数±标准差(Mean±SD),经SPSS 16.0软件进行T检验分析,并采用Tukey’s多重比较检验均值的差异显著性,显著性水平P为0.05。
2 结果
2.1 两种饲料对青蟹生长指标的影响
对养成的拟穴青蟹抽样分析,发现两种饲料组养成的青蟹在形体学指标(全甲宽、甲长、体高)以及平均体质量均无显著差异(P>0.05);肝胰腺指数和性腺指数以冰鲜饵料组略高,但无统计学差异(P>0.05)(表1)。
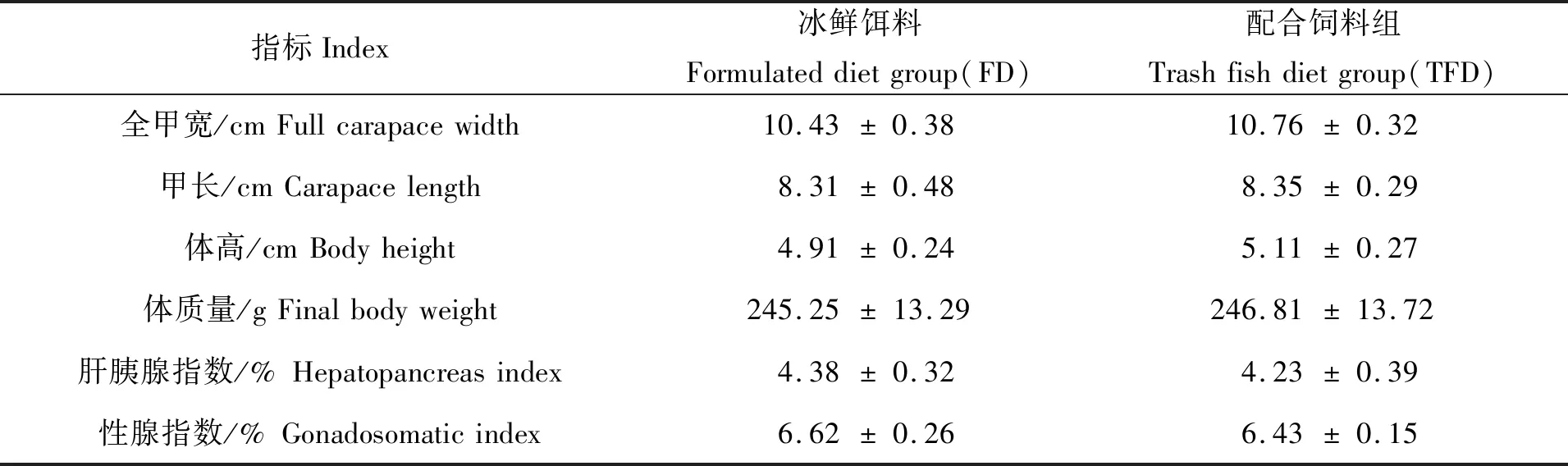
表1 两种饲料对青蟹生长指标的影响
2.2 两种饲料对青蟹肌肉常规营养组成的影响
两种饲料养成的拟穴青蟹肌肉常规营养组成见表2。冰鲜饵料组的青蟹肌肉中水分含量(78.14%)要高于配合饲料组(76.89%)(P>0.05);配合饲料组的青蟹肌肉粗蛋白含量(20.12%)则显著高于冰鲜饵料组(18.73%)(P<0.05)。两组青蟹的肌肉粗脂肪和粗灰分含量无显著性差异(P>0.05)。
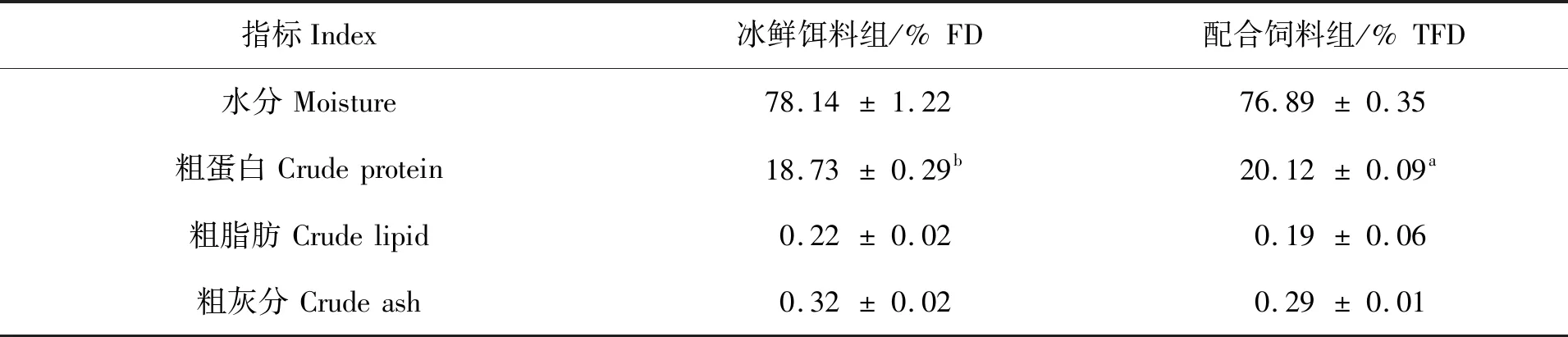
表2 两种饲料对青蟹肌肉常规营养组成的影响
2.3 两种饲料对青蟹消化酶活性的影响
试验青蟹胃和肠道消化酶活性测定结果如表3所示。配合饲料组的青蟹胃蛋白酶活性显著高于冰鲜饵料组(P<0.05),但胃淀粉酶活性显著低于冰鲜饵料组(P<0.05)。胃脂肪酶活性2组间无显著差异(P>0.05)。肠道消化酶活性,冰鲜饵料组的青蟹肠蛋白酶活性显著高于配合饲料组(P<0.05),脂肪酶和淀粉酶活性则相对稳定,不受饲料处理的影响(P>0.05)(表3)。
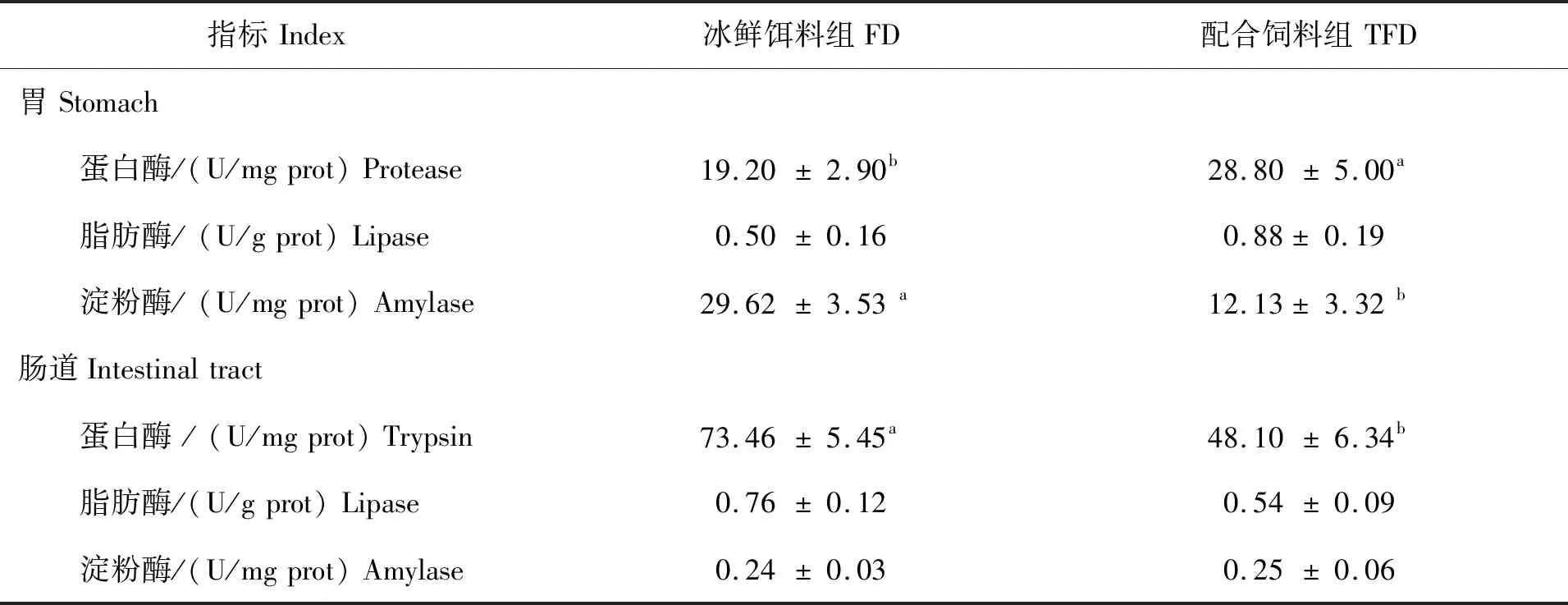
表3 两种饲料对青蟹消化酶活性的影响
2.4 两种饲料投喂对池塘水质和微生物组成的影响
表4所示为两个试验池塘水质指标测定结果。氨氮、亚硝酸盐氮、硝酸盐氮、磷酸盐和总有机碳等5项水质指标均为冰鲜饵料组的池塘高于配合饲料组的池塘;但各组指标之间无显著性差异(P>0.05)。
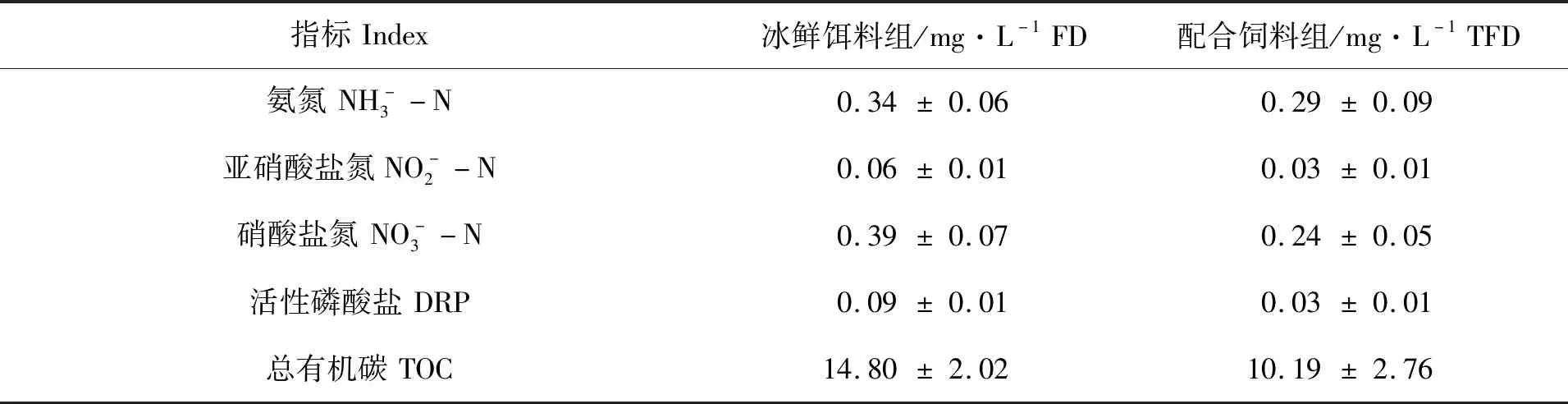
表4 两个饲料组的池塘水质指标
图1显示了试验样品中在门水平(a)和属水平(b)下最丰富的10个菌群。在门水平上(图1-a),水体和沉积物样品中菌群以变形菌门(Proteobacteria)为主,底泥中平均占61.9%、水体中平均占40.1%;其次为水体中的蓝藻门(Cyanobacteria)和拟杆菌门(Bacteroidetes),以及沉积物中的拟杆菌门(Bacteroidetes)(图1-a)。此外还有放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、螺旋体菌门(Spirochaetae)为前10最丰富门。在属的水平上(图1-b),聚球藻属(Synechococcus)、Sulfurovum属、脱硫叶菌属(Desulfobulbus)、Phaeodactylibacter属、白念珠菌属(Candidatusaquiluna)、Marinicella属、Salinihabitans属、假交替单胞菌属(Pseudoalteromonas)属、海命菌属(Marivita)和奥文氏菌属(Owenweeksia)为前10最丰富属。
分析两个池塘中采集的水样和底泥样品中菌群在属水平上的平均相对丰度,发现水样中有海命菌属等7种微生物菌的平均相对丰度具有显著差异,且均为对照塘的菌群平均相对丰度显著高于试验塘(P<0.05)(表5)。底泥样品中,测得有9种微生物在属水平上的平均相对丰度具有显著差异,其中,试验塘底泥除了双歧杆菌属的平均相对丰度高于对照塘以外(P<0.05),其他如地杆菌属等8种微生物的平均相对丰度均显著低于对照塘(P<0.05)。

表5 属水平上水样和底泥中具有显著性差异的菌群的平均相对丰度
在所有养殖动物起捕完毕后,对两个池塘的生产效益的分析结果如表6所示。两个饲料组的青蟹产量相当;但配合饲料组的脊尾白虾产量和贝类总产量分别比对照塘高出18.2%和4.0%。配合饲料组每667 m2水产品总产量为374 kg,比冰鲜饵料组总产量353 kg增加5.9%。养殖成本方面,配合饲料组的每667 m2饲料成本为1 615元,相比于冰鲜饵料组的2 250元,每667 m2饲料成本下降28.2%;配合饲料组总成本为10 720元/667 m2,比冰鲜饵料组总成本(11 655元/667 m2)减少8.0%。配合饲料组每667 m2利润6 210元,冰鲜饵料组4 355元,配合饲料组增收1 855元/667 m2(表6)。

表6 两个饲料组的池塘养殖效益分析
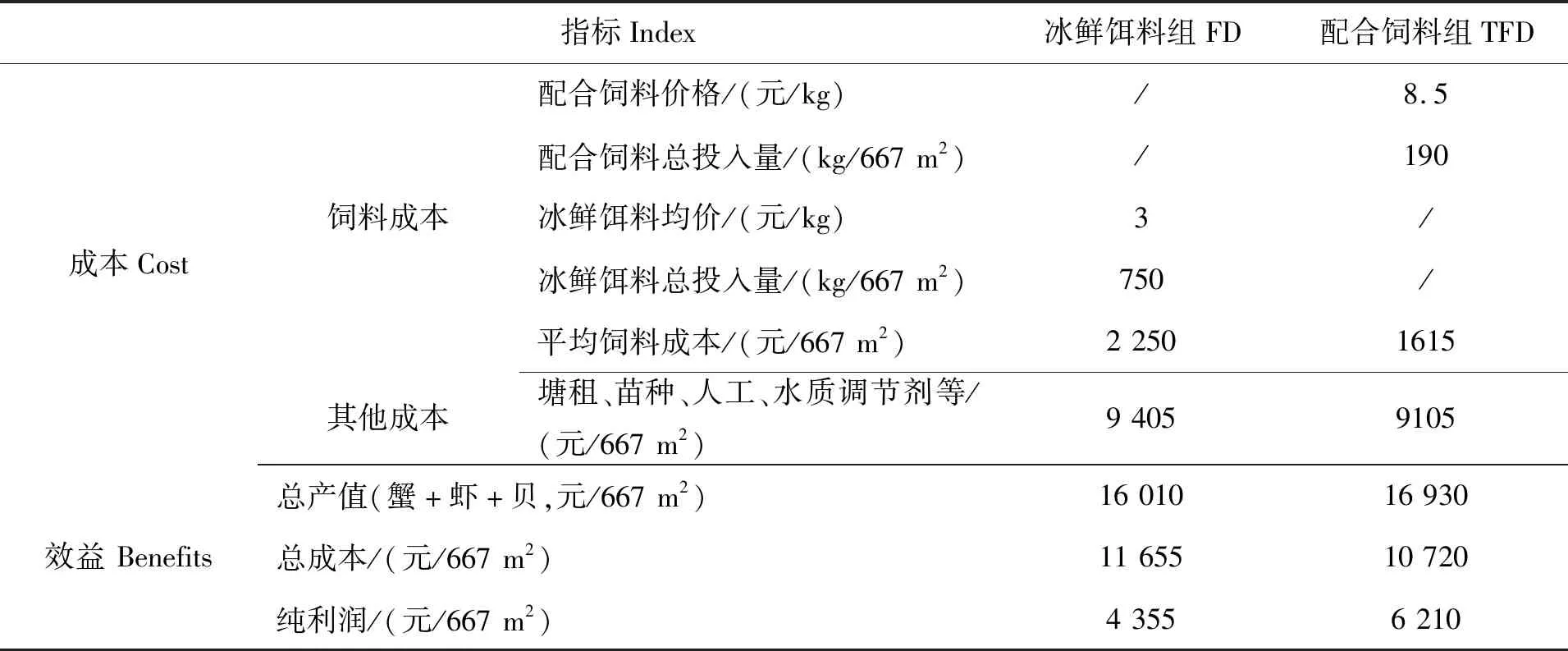
续表6
3 讨论
近年来已有关于青蟹配合饲料营养需求的研究[7-9],但对生产实践中应用效果的报道还较少。2016年以来,在浙江省渔业主管部门支持下,全省水产技术推广系统围绕青蟹、大口黑鲈(Micropterussalmoides)、大黄鱼(Larimichthyscrocea)等海、淡水主导品种,开展了配合饲料替代冰鲜饵料养殖的联合推广行动。其中,青蟹配合饲料的示范推广打破了青蟹传统养殖配合饲料“零应用”的局面,取得了明显成效。本试验的结果表明,拟穴青蟹池塘混养模式下使用配合饲料养殖,抽样青蟹的个体规格和性腺发育等与投喂冰鲜饵料无显著差异,青蟹产量基本保持稳定,混养的脊尾白虾和贝类产量有明显增加,养殖综合效益提升明显。
研究表明,饲料类型及其营养水平会影响水产动物机体的营养组成。本试验观察到青蟹摄食膨化饲料后,肌肉水分含量有所降低,蛋白质含量显著增加;对大口黑鲈(M.salmoides)[10]、乌鳢(Channaargus)[11]、大黄鱼(L.crocea)[12]等鱼类以及中华绒螯蟹(Eriocheirsinensis)[13]的研究发现,相比于投喂冰鲜饵料,投喂配合饲料养成的水产品肌肉品质有所改善。
虾蟹类的消化酶活性取决于其自身的消化生理特性和所摄食的饵料,其中饵料营养素的质和量是影响其消化酶分泌与活性强弱的关键因素[14-15]。研究报道,青蟹主要由胃分泌消化蛋白质、淀粉和纤维素的酶,肠道也能分泌一部分淀粉酶和少量其他酶类,但主要功能为吸收营养[16]。本试验结果显示,摄食配合饲料的拟穴青蟹胃蛋白酶活性显著高于冰鲜饵料组,在三疣梭子蟹(Portunustrituberculatus)[17]、中华绒螯蟹[18]和日本对虾(Penaeusjaponicus)[19]的研究中也有相似报道。本试验还发现摄食冰鲜饵料后青蟹肠道胰蛋白酶活性较高,脂肪酶在两个组织中的活性差异大不,胃的淀粉酶活性则明显高于肠道。消化酶活性变化的原因可能与两种饵料的营养组成以及配合饲料的加工工艺等因素有关,拟穴青蟹的消化酶分泌做了适应性调节。
养殖池塘水质指标对于水产动物的生长和健康状况起到关键影响[20],海水养殖尾水的无机氮和活性磷酸盐含量超标又是造成近海海域污染的主要因素之一[21-22];加强养殖过程的投入品源头和养殖过程管控对海水养殖可持续发展具有重要意义。本试验观察到投喂配合饲料的试验塘的氨氮、亚硝酸盐氮、硝酸盐氮、活性磷酸盐和总有机碳等水质指标均低于投喂冰鲜饵料的对照塘,表明在基本相同的养殖管理下,投喂配合饲料对于改善养殖水质,从而减轻水体有害物质对养殖生物的胁迫效应具有积极作用。
微生物群落结构是反映养殖系统状态改变和水体健康程度的重要指标[23];分析菌群中的优势菌群和相对丰度的变化,对维持和调控养殖生态系统,促进养殖生物的生长和抗病力具有重要的意义[24]。本试验观察到变形菌门和蓝藻门是池塘水体中最丰富的两个菌群门类。变形菌门是海洋或陆地上的高盐湖泊中最主要的细菌类群之一[25],被认为是水产养殖中的共生菌[26]。蓝藻细菌则是诱发养殖水体蓝藻暴发的重要菌群,会引起水产动物中毒与缺氧死亡[27]。本试验中,投喂冰鲜饵料的池塘水体中检测到相对较高的无机养分水平可能更有利于蓝藻生长。同时,水样中在属水平上相对丰度具有显著性差异的7种菌群也均出现在投喂冰鲜饵料的池塘;其中,海命菌属、热带单胞属、海洋柄菌属和海洋杆菌属均属于变形菌门。变形菌门是一种多功能菌群,具有脱氮除磷、降解有机质和降低化学需氧量的功能,在污染严重的废水中具有较高的丰度[28];另有研究发现,水产动物肠道菌群多样性降低、变形菌门细菌增多会引发肠道炎症反应[29]。奥文氏菌属和Rubidimonas属于拟杆菌门,拟杆菌门的细菌与DNA、脂类和蛋白质等有机物质的转换密切相关,对这些有机物质的吸收和利用是水体环境中碳循环的重要组成部分[30];冰鲜饵料组的池塘水样中拟杆菌表现出较高的相对丰度可能与该池塘需降解复杂有机物,特别是多糖和蛋白质(如动物性饵料和藻类等)的活性有关。差异菌群可通过其代谢活动影响营养元素的物质循环,决定水质的状况,从而影响水生动物的生存状态和健康状况。池塘的底质可作为氨、硫化物和活性磷酸盐的“培养基”,是池塘中涉及有机物和养分循环最活跃的微生物转化场所[31],但本试验中冰鲜饵料组和配合饲料组的池塘底泥中占比在前10位的菌群在属水平上的相对丰度上并无显著差异。
综上,投喂配合饲料对于提高拟穴青蟹池塘养殖效益、改良养殖环境方面具有积极作用,表明了在青蟹生产实践中应用配合饲料替代冰鲜饵料的可行性;试验结果为促进青蟹健康养殖模式的转型发展提供了理论依据。

