子宫动脉栓塞术治疗有异常供血的剖宫产瘢痕妊娠临床研究
张 伟, 王莉杰, 王 觅
剖宫产瘢痕妊娠(cesarean scar pregnancy,CSP)属一类特殊且高风险异位妊娠,其自然发展会使孕妇面临危及生命的出血、子宫破裂和子宫切除风险,尽管最终会有57%活产率,但其中63%产妇需要切除子宫[1]。因此一旦诊断为CSP应给出终止妊娠医学建议,并尽早清除妊娠物[2]。目前子宫动脉栓塞术(uterine artery embolization,UAE)辅助下各式妊娠物清除术,已逐渐成为早期CSP治疗的主流方案和常规策略[3-5]。为妊娠囊供血的靶动脉完全栓塞是UAE治疗成功与否的关键因素[6]。CSP主要供血血管为子宫动脉,目前对于其异常供血的报道并不多。本研究对有异常供血的CSP患者UAE治疗效果进行探讨,旨在提高临床疗效和认识,确保产妇安全。
1 材料与方法
1.1 一般资料
收集郑州市第一人民医院2012年6月至2019年6月间92例接受UAE术CSP患者临床和DSA影像资料。患者年龄20~42岁,中位年龄31岁;停经时间 34~118 d,平均(57.39±20.55) d;入院时 21例有下腹部疼痛,28例有阴道出血,48例无任何不适;经历1次剖宫产42例,2次47例,3次3例;2例既往有CSP病史,分别于3年、5年前接受UAE和清宫术;首次剖宫产至此次确诊CSP时间为10个月至18年,中位时间7年。患者入院时血清β-人绒毛膜促性腺激素(β-HCG)值为 465.20~134 583.41 mU/mL,均高于正常范围。患者CSP均由经腹和经阴道超声检查确诊,妊娠囊最大径为6~82 mm,中位值为32 mm;妊娠囊与膀胱间子宫肌层厚度为1~9 mm,48例≤3.0 mm;均无“子宫肌瘤”、“子宫腺肌病”诊断。所有患者入院1~3 d后接受UAE。
1.2 手术方法
经右股动脉引入5 F猪尾导管(美国Cook公司)至腹主动脉肾动脉水平,DSA造影了解髂内动脉开口部位置和卵巢动脉显影情况;5 F Cobra导管(美国Cook公司)送入左髂内动脉,造影显示子宫动脉开口部位置和走行;5 F Cobra导管或以同轴导管技术引入2.7 F微导管(日本Terumo公司)并送入子宫动脉,造影显示妊娠囊血供,经导管灌注甲氨蝶呤(MTX)35 mg,遂以 560~710μm 粒径明胶海绵颗粒(杭州艾力康医药科技公司)栓塞子宫动脉,直至动脉分支完全栓塞,主干内对比剂流动缓慢;复查左髂内动脉造影,明确有无其他血管参与妊娠囊供血,如有异常供血则超选择插管并栓塞;导管成襻后送入右髂内动脉,以上述方法行血管造影、药物灌注和栓塞。
1.3 分析方法
根据92例患者DSA影像分析,其中15例妊娠囊有除子宫动脉以外的异常供血(A组)(表1),77例无异常供血(B组)。比较两组UAE术后24 h血清β-HCG下降程度、术中大出血、输血率、UAE后住院时间、血清β-HCG转阴时间、UAE操作时间和月经恢复时间。根据UAE术后24 h血清β-HCG下降程度(与术前相比),分为下降幅度<20%组和≥20%组。参照Wang等[7]研究报道,术中大出血定义为清除妊娠囊术中有活动性出血,且出血量≥200 mL。
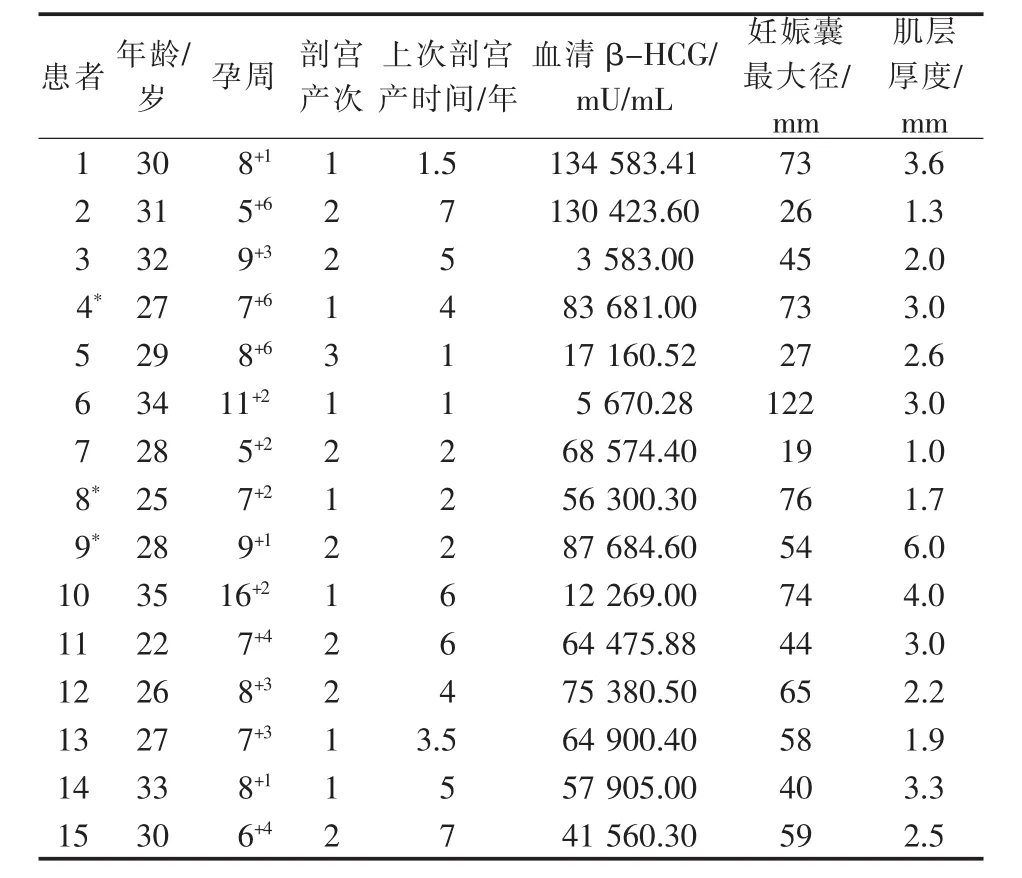
表1 15例妊娠囊有异常供血CSP患者一般资料
1.4 统计学方法
采用SPSS 19.0软件作统计学分析。正态性检验用Explore法,正态分布的计量资料以均数±标准差(x±s)表示,计数资料以例表示,A、B 两组间 UAE后住院时间、血清β-HCG转阴时间、UAE操作时间和月经恢复时间对比用独立样本t检验,术后24 h血清β-HCG下降程度、术中大出血、输血率对比用精确Fisher检验,P<0.05为差异有统计学意义。
2 结果
A、B组UAE术技术成功率均为100%。A组妊娠囊异常供血血管分布于左侧4例,右侧6例,双侧5例;20支异常供血血管中18支为膀胱动脉,1支为阴部内动脉,1支未能明确来源,其中16支成功完成超选择性插管并栓塞(图1),4支超选择性插管失败后改行髂内动脉前干栓塞。A、B组均未见卵巢动脉参与妊娠囊供血。89例于UAE术后1~13 d接受清除妊娠囊手术(表2),术中出血5~1 400 mL,无子宫切除事件发生,3例(B组)拒绝接受术后治疗,经门诊超声复查随访,均于3周内妊娠囊娩出,无阴道大出血等严重不良事件发生。A、B组间术中大出血、输血率、UAE操作时间差异有统计学意义(P<0.05),UAE 后 24 h血清 β-HCG 下降程度、UAE后住院时间、血清β-HCG转阴时间和月经恢复时间差异无统计学意义(P>0.05),见表3。

表2 UAE术后清除妊娠囊术式

表3 A、B组临床资料对比
3 讨论
Larsen和Solomon 1978年首次报道CSP以来,这种与剖宫产密切相关的宫内异位妊娠危害性越来越受到关注。世界各地剖宫产率上升导致CSP增加[8],我国高剖宫产率虽得到一定程度控制[9],但人口基数大、二孩政策放开及高龄孕产妇增加所面临CSP危害,日益显现。

图1 1例28岁CSP产妇成功完成超选择性插管和栓塞影像
3.1 UAE治疗CSP
CSP供血通常较普通肌层丰富,动脉在妊娠囊周围环状包绕病灶,妊娠囊周围血流信号及其分级是 CSP 产妇出血的风险因素[1,10-11],血流分级越高,妊娠囊血供越丰富,出血风险越高。一些研究为指导CSP治疗建立出血风险评分系统,均将妊娠囊血供丰富程度列为重要指标[7,12]。 CSP 终止妊娠、清除妊娠囊过程中最大风险是严重阴道出血,因此能否有效降低出血风险是CSP治疗关键和前提。
UAE治疗中超选择性子宫动脉灌注MTX可极大地提高局部血药浓度,有利于杀死胚胎并加速滋养叶细胞活性丧失,而明胶海绵颗粒栓塞子宫动脉可迅速阻断妊娠囊血流,为后续清除妊娠囊手术降低严重出血风险创造有利条件。鲁景元等[13]将492例CSP产妇分为高危组、低危组,根据是否UAE治疗分别分为UAE组和非UAE组,多因素logistic回归分析显示,治疗方法是CSP再发风险的独立预测因素,采用包含UAE在内的综合治疗方法可降低CSP再发风险。
由于子宫动脉上行支存在卵巢供血及栓塞、X线辐射可引起子宫内膜缺血缺氧和放射性损伤,UAE术对产妇生育功能的影响存在一定争议。但多数学者认为UAE术对卵巢功能影响很小,尤其是40岁以下产妇卵巢功能几乎不受影响[14]。魏丽坤等[15]研究报道138例CSP,根据治疗方式分为UAE+清宫术治疗组、清宫术治疗组、腹腔镜治疗组,其中50例有再生育要求,37例在随访时间内获自然妊娠42次;认为CSP治疗后自然妊娠率较满意,且个体化治疗方式对自然妊娠率无显著影响。
3.2 CSP妊娠囊异常供血与UAE治疗
有关CSP UAE术后清宫术中出血相关因素分析,可归结为妊娠囊直径>5 cm[16-17]、Ⅱ型 CSP[16]、孕龄[18]、妊娠囊与膀胱间子宫肌层厚度[18]、介入治疗与清宫术时间间隔延长等因素[19]。异常供血血管未得到栓塞是原发性肝癌肝动脉化疗栓塞治疗失败的重要原因,虽然目前并无大型研究证实CSP妊娠囊异常供血与阴道大出血间是否存在关联,但对异常供血加以注意、提高认识很有必要。
An 等[6]研究报道 4 例(4/23)患者 UAE 术后 3周妊娠囊仍持续生长,遂行子宫切除术。这虽无直接依据,但作者提示卵巢动脉可能参与了妊娠囊供血。徐玉静等[20]应用数字化三维模型分析5例CSP血供,发现2例由双侧子宫动脉和卵巢动脉共同供血,3例仅由子宫动脉供血。叶斌等[21]报道CSP侧支动脉发生率为23.6%(34/144),其中76.5%(26/34)侧支动脉起自髂内动脉;认为前置胎盘、盆腔炎症、人流手术史及子宫肌瘤或腺肌症,是CSP侧支动脉形成的危险因素。本研究中CSP异常供血发生率为16.3%(15/92),异常供血来源多为膀胱动脉(90%,18/20),A、B 组间术中大出血、输血率、UAE 操作时间差异有统计学意义,A组上述3项指标均高于B组。由于本研究样本量小,难以对此进行相关因素研究,但对研究结果进行分析有以下提示:①有异常供血的CSP患者往往妊娠囊血供丰富、直径较大(A组15例中12例直径>30 mm,术中大出血3例均>50 mm),栓塞后易于出现侧支循环建立,因此术中妊娠囊供血血管尽管已栓塞,仍需警惕清除妊娠囊术中大出血,术前需做好应对预案;②A、B组中5例清除妊娠囊术中大出血患者清宫时间均为UAE术后5~10 d,为避免止血效果降低,建议UAE后72 h内完成清除妊娠囊手术操作;③有异常供血的CSP患者UAE操作过程会显著延长,因此出于对产妇卵巢功能的保护及术者放射线防护,有必要通过适当缩小透视光圈、低剂量透视和造影、应用路图功能等方式减少放射线剂量和照射时间;④一侧UAE结束后再行髂内动脉造影旨在评估子宫动脉栓塞程度,同时需关注有无异常供血血管,尤其是膀胱动脉和阴部内动脉,并注意多角度造影观察,以避免因正位像血管重叠导致遗漏需栓塞的靶血管。
成功的UAE术不仅要栓塞子宫动脉,还要栓塞包括妊娠囊异常供血支在内的血管,以降低出血风险。UAE术在有异常供血的CSP治疗中取得了满意效果,但需要注意的是,UAE术后续清除妊娠囊手术过程中仍有大出血可能,需要加以重视,也需要对此开展进一步研究。

