股静脉入路脑静脉窦内支架成形术治疗特发性颅内高压伴静脉窦狭窄13例
白卫星, 贺迎坤, 康晓雨, 袁龙涛, 王晓雪, 李天晓, 许予明
特发性颅内压增高(idiopathic intracranial hypertension,IIH)是一类非器质性颅内压升高疾病,腰椎穿刺时脑脊液压力升高,脑脊液成分正常,也称假脑瘤综合征或良性颅内压增高。近年研究表明,IIH患者多伴有脑静脉窦狭窄(cerebral venous sinus stenosis,CVSS)。对于药物治疗无效及拒绝外科脑脊液分流或视神经鞘开窗术患者,脑静脉窦内支架成形术成为替代治疗方案。本研究回顾性分析采用股静脉入路脑静脉窦内支架成形术治疗13例IIH伴CVSS患者的效果,现报道如下。
1 材料与方法
1.1 一般资料
回顾性分析2012年12月至2017年6月在河南省人民医院确诊为IIH伴局限性CVSS并经脑静脉窦内支架成形术治疗的13例患者临床资料。其中男5 例,女 8 例;年龄 14~75 岁,平均(39.82±0.70)岁。病程1个月至8年,平均(12±9)个月。主要临床症状为头痛(12例)、视力下降或视物模糊(10例)、搏动性耳鸣(2例)。13例患者眼底检查均有明显视神经乳头水肿,入院后均接受腰椎穿刺术测量颅内压,并留取脑脊液接受常规、生化检查。患者纳入标准:①MRI、MRV显示有CVSS,脑实质正常;②常规腰穿刺压力>250 mmH2O(1 mmH2O=0.009 8 kPa), 脑脊液成分正常;③眼底检查见双侧视盘水肿;④DSA明确CVSS,且动静脉循环时间延长,静脉排空延迟;⑤神经系统检查正常。排除标准:①MRI或MRV提示明确占位性病变或静脉窦血栓形成;②内科保守治疗症状好转;③儿童患者有明显侧支循环建立;④有明确出血倾向。
1.2 手术操作
13例患者术前3~7 d均接受常规双联抗血小板聚集治疗(口服阿司匹林100 mg/d、氯吡格雷75 mg/d)。手术在全身麻醉下进行,术中静脉给予肝素70 U/kg,之后每小时追加1 000 U;经右侧股动脉置入5 F鞘,4 F造影导管置入颈内动脉;右侧股静脉置入6 F血管长鞘,长鞘在4 F导管和泥鳅导丝配合下引入患侧颈内静脉;沿长鞘引入6 F Navien指引导管(美国Medtronic公司)至乙状窦,造影明确CVSS位置后,用连接压力传感器的2.7 F Progreat微导管(日本Terumo公司)检测狭窄段两端压力差,压力差超过 10 mmHg(1 mmHg=0.133 kPa)则释放Precise支架(美国Cordis公司)于狭窄处,再次检测支架两端压力梯度。
术后继续按原剂量口服阿司匹林和氯吡格雷。术后第4日经腰椎穿刺测定脑脊液压力,并行眼底及视力、视野检查。6个月后复查脑脊液压力及支架内是否通畅,根据影像学复查情况确定是否停用氯吡格雷,维持阿司匹林1年。
1.3 术后随访
术后随访患者临床症状改善情况,检查眼底及视力、视野,影像学检查(CTV或DSA)等。
1.4 统计学分析
采用SPSS 20.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,治疗前后压力差和颅内压力比较用配对t检验,P<0.05为差异有统计学意义。
2 结果
术前13例患者均经眼底照相证实视神经乳头水肿,颅内压力为平均(371.5±84.7) mmH2O;全脑血管造影均明确为横窦-乙状窦交界处狭窄,其中1例为左侧横窦优势(左侧狭窄),9例为右侧横窦优势(右侧狭窄7例,左侧狭窄2例),1例双侧均势(双侧横窦-乙状窦狭窄),2例双侧均势(右侧狭窄);狭窄近端和远端压力梯度差为平均(20.67±5.63)mmHg。
13例患者均成功完成脑静脉窦内支架成形术,共植入支架14枚,支架均置于压力梯度差最大狭窄处。术后即刻测得狭窄近端和远端压力梯度差为平均(4.72±1.87)mmHg,CVSS 完全消失;术后第 4 日,腰穿刺测得颅内压为平均(225.6±45.7)mmH2O;复查眼底照相(将眼科检查记录作为随访资料)显示,视神经乳头水肿均较术前明显改善或消失。术后12例头痛患者症状较术前均减轻,2例搏动性耳鸣患者症状消失,8例视物模糊患者症状明显好转,2例视力下降患者症状改善不明显。所有患者均未出现严重手术相关并发症,2例术后出现短暂性支架植入侧偏侧头痛,于3 d内消失。
术后随访CTV 9例,全脑血管造影4例,脑静脉窦均通畅,支架位置良好,无支架内再狭窄。随访期间所有患者原症状无复发,均未出现新的神经功能缺损症状。典型病例见图1。
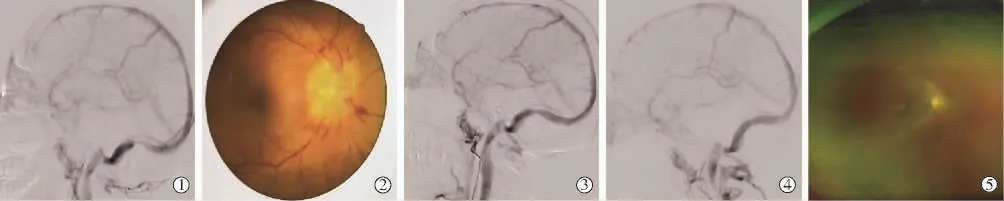
图1 IIH伴CVSS患者脑静脉窦内支架成形治疗过程
3 讨论
100多年前IIH即被认为是一种疾病。随着认识不断深入,IIH诊断标准也渐完善。目前认为,排除已知继发性因素后,IIH确诊需满足以下条件[1]:①视神经乳头水肿;②神经系统检查正常;③神经影像学检查示脑实质正常,无脑积水、占位性病变,MRI或MRV无异常脑膜强化或静脉窦血栓形成;④脑脊液成分正常;⑤腰椎穿刺测得颅内压升高(侧卧位>250 cmH2O)。IIH发病率较低(1/10万~3/10万),临床上主要表现为头痛、视力丧失、搏动性耳鸣等[2]。其特点是在无脑积水和中枢神经占位性病变情况下颅内压升高,腰椎穿刺时脑脊液压力升高,脑脊液成分正常。IIH在肥胖的年轻女性中较多见。IIH可能与静脉高压和脑脊液吸收受损等因素有关,但确切发病机制尚不清楚[2]。影像学研究显示IIH患者多伴发CVSS。相关研究表明,IIH患者中高达93.1%伴有CVSS[3-4]。IIH或由固有的腔内阻塞,如明显的蛛网膜颗粒,或由肿胀的脑组织外源性压迫所致。两者病理机制不同,但普遍认为无论是外源性还是内源性原因,CVSS是关键环节。
颅内压与颅内静脉和静脉窦内压力处于动态平衡状态,而横窦是静脉流出的主要通道,若横窦对血流阻力大,则会引起IIH。因此CVSS尤其是横窦狭窄引起的静脉窦压力升高,越来越被认为是IIH发病 机 制 相 关 因 素[5]。 Farb 等[4]研 究 分 析 IIH 患 者CVSS发生率,发现与正常对照相比,90%以上IIH伴CVSS患者同时有横窦狭窄。其他一些研究也报道有类似结果[6-7]。本组13例患者均经全脑血管造影证实为优势侧横窦、乙状窦交界处狭窄。
脑静脉窦内支架成形术通过解除窦腔狭窄、改善血流和脑脊液回流状态缓解IIH症状。Higgins等[8]2002年首次报道双侧横窦狭窄介入治疗,认为治疗有效的关键,在于术前明确局限性狭窄处有明显的压力梯度变化。逆行性脑静脉窦内微导管造影及狭窄处测压,不仅能准确判定静脉窦形态学特点,而且通过量化窦内压力变化明确了狭窄程度[9]。既往研究表明,若药物保守治疗无效,则对压力梯度>10 mmHg患者可行脑静脉窦内支架成形术,以解除压力梯度。窦内微导管测压可更严格把控支架成形术指征[10-11]。一项meta分析结果显示,CVSS所致IIH患者支架成形术后临床症状缓解率,分别为头痛83%,视力78%,视神经乳头水肿97%[12]。本组13例患者均于术中经微导管检测狭窄处近端和远端压力梯度(均>10 mmHg),术中即刻恢复静脉窦解剖形态后压力差降至平均(4.72±1.87)mmHg,术后所有患者均取得良好疗效,主要临床症状在短时间内得到迅速改善,随访期间症状均未复发。目前脑静脉窦内支架成形术通常采用股静脉入路或颈静脉入路,本组患者全部接受股静脉入路,其穿刺相对容易,指引导管路径相对平直,支撑力较强,支架易送达窦内狭窄处,与颈静脉入路相比术中操作相对容易,耗时较短。
IIH主要临床表现之一是长时间视神经乳头水肿伴继发性视神经萎缩导致的视力丧失,10%~20%患者发生这种情况[13]。有研究报道,脑静脉窦内支架植入术改善或解决了88%患者视神经乳头水肿情况[14]。一项meta分析纳入18个中心20篇文献,共474例IIH患者,脑静脉窦内支架成形术后患者乳头水肿总改善率为93.7%[15]。有研究报道显示,84.5%IIH患者在支架成形术后有明显的主观视力改善或恢复,这与既往研究一致;结果较差患者中4例(7.0%)症状未改变,5例(8.8%)永久性失明,这些患者术前均有严重视力障碍[16]。本组13例患者中术前视力下降或视物模糊10例,其中2例术后视力无明显改善,考虑与术前视力下降程度较重且时间较长相关。
本组患者术后随访中均显示脑静脉窦通畅,支架位置良好,无支架内或支架邻近位置再狭窄。Saber等[17]报道对24项脑静脉窦支架植入术473例IIH患者临床结果、支架存活和支架邻近狭窄率进行meta分析,结果显示术后支架邻近狭窄率达14%,这可能是导致重复手术和预后不良的原因。因此,仍需进一步研究评估抗血小板药物在预防支架植入术后再狭窄中的效果。
有少量病例报道提示脑静脉窦内支架成形术后出现硬脑膜动静脉瘘(dural arteriovenous fistula,DAVF)[18]。 考虑与以下因素相关:①脑静脉窦内支架植入后,支架网孔阻塞引流静脉,可能导致静脉淤积和血栓形成;②支架植入过程中操作和支架本身刚度很可能损伤窦内结构,导致DAVF形成;③支架植入后局部炎性反应增强。尽管目前该并发症报道较少,但仍应关注。本组患者随访中未发现DAVF,但仍需远期随访。
综上所述,脑静脉窦内微导管测压指导股静脉入路支架成形术治疗IIH伴CVSS患者相对安全,操作技术难度可把控,可行性高。但仍需大样本远期随访数据进一步研究。

