颅内未破裂动脉瘤介入术后微缺血相关危险因素分析
樵凡原, 徐 睿, 张晓冬, 朱 继
颅内动脉瘤破裂后致残率、致死率高[1]。随着医疗水平的提高,颅内未破裂动脉瘤(unruptured intracranial aneurysms,UIA)检出率和血管内介入治疗比例逐渐升高。然而,UIA介入术后常出现急性微缺血病变[2]。已有研究证实UIA介入术后MRI-弥散加权成像(DWI)检测到的微缺血阳性病变(DWI阳性)与症状性缺血性并发症有关[2-3]。虽然大多数颅内微缺血患者无明显症状,但微缺血是认知衰退和痴呆的原因之一[4-5]。本研究旨在分析目前本中心UIA介入术后患者DWI阳性病变发生率,并探讨微缺血可能的危险因素。
1 材料与方法
1.1 一般资料
收集2018年3月至2019年2月行介入治疗的110例UIA患者临床资料,包括年龄、吸烟史、高血压史、糖尿病史、高脂血症、动脉瘤位置和大小、是否为宽颈动脉瘤(瘤颈<4 mm为窄颈,反之为宽颈)、支架辅助栓塞、术前1 d血小板抑制情况、手术时长。
患者纳入标准:①经CTA、DSA诊断为颅内动脉瘤;②术后3 d内完善头部MRI检查;③签署知情同意书。排除标准:①伴发全身感染性疾病、严重脏器功能障碍,存在其他手术禁忌证;②夹层动脉瘤、假性动脉瘤、颅内多发动脉瘤;③妊娠并发颅内动脉瘤;④伴有颅内外动脉狭窄;⑤术中急性血栓形成、动脉瘤破裂。本研究获得医院伦理委员会审查批准。
1.2 治疗方法
所有介入手术均由同一位神经外科医师在全身麻醉下经股动脉入路完成。患者术前1 d均完善全套血栓弹力图(thromboela-stogram,TEG)检查,其中包含未服用双抗时花生四烯酸(AA)%和二磷酸腺苷(ADP)%;术前2 h接受双抗血小板治疗(阿司匹林300 mg,氯吡格雷300 mg)。手术时全身肝素化(1 mg/kg)处理,1 h后减量为前次用量50%,直至减量为10 mg/h维持。若术中仅以单纯弹簧圈栓塞动脉瘤,术后予以鱼精蛋白中和肝素;若术中应用支架辅助栓塞动脉瘤,则术后不中和肝素。术后急查凝血象,若结果达到输血指征,予以血浆改善凝血功能。若为支架辅助栓塞动脉瘤,需根据术前TEG血小板抑制情况,予以低分子肝素皮下注射抗凝治疗。若出现阿司匹林和/或氯吡格雷抵抗(AA<50%和/或ADP<30%),予以低分子肝素4 000 U/12 h;若阿司匹林和氯吡格雷均敏感(AA≥50%和ADP≥30%),则予以低分子肝素2 000 U/12 h;3 d后改为双抗治疗(阿司匹林100 mg/d,6个月;氯吡格雷75 mg/d,6周)。若未予支架辅助栓塞,则术后不应用低分子肝素和双抗治疗。
1.3 观察指标
根据ORG10172急性脑卒中治疗试验(TOAST)研究组分类所示小动脉闭塞影像学特征,将DWI检测到的直径≤15 mm高信号病变,定义为微缺血病变。术后3 d内行头部3-T MRI-DWI检查,根据DWI有无急性微缺血病变分为DWI阳性组和DWI阴性组,观察比较两组患者微缺血发生率。所有MR图像均由神经放射科医师和神经外科医师共同审查。
1.4 统计学分析
采用SPSS 23.0软件进行数据统计分析。计量资料用t检验,计数资料以均数±标准差(x±s)表示,并作χ2检验或Fisher精确检验;多因素logistic回归分析介入术后发生微缺血的独立危险因素。检验水准为 α=0.05。
2 结果
110例UIA患者中有56例(50.9%)出现微缺血病变(DWI阳性)(图1),54例为 DWI阴性。 单因素分析结果显示,高血压史、瘤体直径大、氯吡格雷抵抗和支架辅助栓塞患者术后微缺血发生率更高(P<0.05);DWI阳性组、DWI阴性组间患者间年龄、吸烟史、糖尿病史、高脂血症、阿司匹林抵抗、瘤颈大小、动脉瘤位置和手术时长差异无统计学意义(P>0.05),见表1。多因素logistic回归分析结果显示,高血压史(OR=2.909,P=0.015,95%CI=1.233~6.862)、瘤体直径大(OR=2.590,P=0.033,95%CI=1.078~6.222)、氯吡格雷抵抗(OR=4.369,P=0.010,95%CI=1.419~13.456)和支架辅助栓塞(OR=3.474,P=0.045,95%CI=1.029~11.724)为微缺血独立危险因素,见表2。
3 讨论
UIA介入术后MRI-DWI显示微缺血病变,被认为由微栓子栓塞所导致,可能与微小血栓、碎片化粥样硬化斑块、气泡,或在导管插入和/或对比剂注射,或0.9%氯化钠溶液冲洗时释放或引入的亲水性涂层材料有关[6-7]。选择MRI-DWI检查明确急性微缺血,是因为这种成像技术对急性缺血性脑卒中诊断具有很高的灵敏度和特异度。既往研究表明UIA介入术后颅内微缺血对认知功能有负面影响[8],也有研究表明UIA介入术后老年男性微缺血患者有进展成症状性脑缺血趋势[3]。尽可能寻找出微缺血病变危险因素,有利于降低UIA介入术后微缺血发生率。
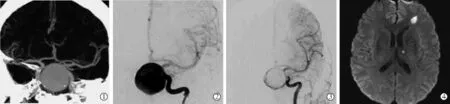
图1 1例UIA患者介入术后出现微缺血病变影像

表1 两组患者基线资料比较

表2 微缺血危险因素logistic回归分析结果
本研究通过回顾性分析发现UIA介入术后微缺血发生率高,110例患者中有56例(50.9%)出现微缺血病变。之前一系列研究计算出UIA介入术后DWI阳性率均值为 49.7%(10%~70.9%)[3],本组患者微缺血发生率与之相符。本研究多因素logistic回归分析发现DWI阳性病变与高血压史、动脉瘤瘤体直径大、氯吡格雷抵抗和支架辅助栓塞有关。既往多项研究所证实的UIA介入术后微缺血发生的危险因素颇具争议,仅有部分与本研究相符。
本研究证实动脉粥样硬化危险因素中,高血压史是微缺血发生的独立危险因素,而吸烟史、糖尿病史、高脂血症并非微缺血危险因素。这可通过高血压患者高风险血管状态导致微栓子清除受损来解释[3]。高血压患者常伴有颅内外动脉粥样硬化、血管迂曲及脑小动脉玻璃样变性,其微栓子形成风险高而清除能力下降,更易导致微缺血发生。还需要进一步研究并验证,术前控制血压水平是否会降低微血栓栓塞并发症发生率。
既往研究证实颅内动脉瘤直径≥7 mm、瘤颈≥4 mm 均与微缺血有关[2,9]。 从血流动力学而言,直径较大的动脉瘤瘤体内更易形成湍流,可增加血栓形成风险。当填塞弹簧圈时,其内血栓脱落,微小栓子经动脉-动脉栓塞远端血管,导致微小梗死,且较大直径瘤体体积大,弹簧圈填塞体积也随之增加,很难达到致密栓塞,如此填塞瘤体后会明显改变血流动力学,更易形成血栓。此外,较大直径动脉瘤常为宽颈动脉瘤,会明显增加支架辅助栓塞概率[10]。本研究未证实宽颈动脉瘤与微缺血有关,可能源于以瘤颈≥4 mm定义宽颈动脉瘤,并分析宽颈动脉瘤与窄颈动脉瘤对微缺血的影响,未分析瘤颈/瘤体≥1∶2宽颈动脉瘤与微缺血相关性。本研究表明支架应用与单纯弹簧圈栓塞相比会增加微缺血发生率。Hahnemann等[11]研究报道支架辅助栓塞是UIA介入术后微缺血独立危险因素。一项研究报道经颅多普勒监测颅内动脉瘤介入栓塞术后微栓子信号发生率,发现支架辅助栓塞患者微栓子阳性率显著高于单纯弹簧圈栓塞患者,提示支架辅助栓塞是颅内动脉瘤栓塞术后微栓子产生的主要危险因素[12]。支架在血管腔内相当于为血小板提供附着点,支架金属丝也很容易损伤血管内皮,导致内皮下胶原纤维暴露,激活内源性凝血系统,有利于微小栓子形成,导致微缺血发生。也有研究发现支架类型会影响微缺血发生率,这可能是不同类型支架与血管腔贴壁程度和金属覆盖率引起的[3,11,13]。
本研究表明术前1 d患者ADP抑制率<30%,即氯吡格雷抵抗更易发生微缺血。有研究证实ADP抑制率与UIA介入术后血栓栓塞并发症有关,增加ADP抑制可能降低血栓栓塞并发症风险[14]。充分抑制血小板可减少血栓栓塞并发症发生,尤其是在支架植入术后,但充分抑制血小板反应性可增加出血并发症风险,尤其是颅内出血。因此,血小板抑制也必须平衡血栓栓塞和出血并发症风险。本研究也发现ADP抑制率与UIA介入术后微出血相关。需要通过更多监测血小板抑制率研究确定这种治疗的安全范围,有助于降低血栓栓塞和出血并发症风险。
既往研究显示手术时间长是UIA介入术后微缺血发生的危险因素[11],而本研究表明手术时长与术后微缺血无相关性。这可能是术前抗血小板方案、术中抗凝方案、介入材料及术后抗栓方案不同的缘故。
本研究缺陷在于:①基于回顾性研究特点,围手术期抗凝方案和抗血小板治疗尚无标准化方案;②缺乏对术前DWI序列的采集,因此不能完全排除某些DWI损伤可能由其他原因引起,包括术前诊断性血管造影;③不同类型支架对围手术期并发症发生率有很大影响。
综上所述,UIA介入术后微缺血发生率高,有高血压史、瘤体直径大、氯吡格雷抵抗和支架辅助栓塞患者发生率更高。应重视具有危险因素患者,予以针对性治疗,可能会降低微缺血发生率,但需要进一步研究证实。

