一例猪流行性腹泻病毒与葡萄球菌混合感染的病原学诊断
段世宇,王 娜,杨 琦,3*,王开功,3,程振涛,3,文 明,3,周碧君,3*
(1. 贵州大学动物科学学院,贵州贵阳550025; 2. 贵州大学动物疫病研究所,贵州贵阳550025;3. 贵州省动物疫病与兽医公共卫生重点实验室,贵州贵阳550025)
腹泻是生猪养殖中常见的疾病症状,引起腹泻的病因较多,主要有病原性和生理性两大因素,其中由病毒感染引起的腹泻传播速度快,危害最为严重,是目前研究学者广泛关注的焦点。猪病毒性腹泻常表现高发病率和高死亡率,即便是腹泻耐过,猪仍可表现体质虚弱、抵抗力低下、生长迟缓等状态[1,2]。常见病毒主要有猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)、猪轮状病毒(Porcine rotavirus,PoRV),感染后均能引起猪腹泻、呕吐、脱水、精神沉郁等临床表现,尤其对哺乳仔猪的危害最为严重,同群或同圈仔猪发病率可高达100%[3]。此外,这3种病毒引起腹泻的临床症状和病理变化非常相似,且在临床上常存在多重感染,与葡萄球菌、链球菌、大肠杆菌等细菌继发或混合感染[4]。因此,单从临床症状和病理变化很难进行鉴别诊断,需要借助实验室检测进行确诊。2019年10月,贵州省毕节市某猪场6日龄左右仔猪出现精神萎靡、食欲减退、水样腹泻、呕吐等临床症状,发病率90%(90/100),10日内病死率100%(90/90)。发病后该猪场曾使用抗生素药物进行治疗无明显效果,仍持续出现仔猪脱水消瘦死亡。本实验通过对送检的2头典型病猪进行病理剖检观察、细菌分离鉴定、相关病毒RT-PCR检测进行诊断,为类似病例的临床诊疗提供参考。
1 材料
1.1 病料来源该场送检的2头发病仔猪,无菌采集肠道内容物、肝脏作为检测病料。
1.2 主要试剂营养琼脂培养基、营养肉汤培养基、鲜血营养琼脂培养基(购自杭州微生物试剂有限公司);犊牛血清(购自浙江天航生物科技有限公司);琼脂糖、核酸染料Golden view(购自SANTAIBIO公司);DL 2 000 DNA Marker、2×TaqPCR MasterMix、TIANamp Bacteria DNA Kit细菌DNA提取试剂盒(购自天根生化科技有限公司);PEDV RNA提取试剂盒、TGEV RNA提取试剂盒、PoRV RNA提取试剂盒(购自北京世纪元亨动物防疫有限公司);反转录试剂盒[购自宝生物工程(大连)有限公司];HiFiScript cDNA Synthesis Kit试剂盒(购自康为世纪生物科技有限公司);药敏纸片(购自河北利华药业有限公司);NaCl、Tris、硼酸、EDTA-2Na、NaOH(均为国产分析纯)。
2 方法
2.1 临床症状与剖检病理观察观察2头病猪的精神状态、体质状况、腹泻情况等临床表现;剖检观察其组织器官的病理变化情况。
2.2 细菌分离培养、镜检无菌取肝脏病料,分别接种于鲜血琼脂培养基,37 ℃培养24~48 h,观察菌落生长情况。挑取单个菌落在普通琼脂培养基上划线,37 ℃恒温箱培养24 h,挑取单个菌落接种于10 mL营养肉汤培养基,在155 r/min转速下37 ℃过夜培养,得到细菌的纯培养物。取纯培养物进行革兰氏染色镜检。
2.3 生化试验将分离纯化菌株接种于精氨酸、甘露醇、木糖醇、甘露糖、木糖、葡磷胨水、山梨醇、N-乙酰葡铵等16种生化试验管中,37 ℃培养48 h,观察并记录结果,参考生化试验对照表判定反应结果。结合镜检和生化试验结果,初步鉴定分离菌类型。
2.4 分离菌PCR检测根据初步鉴定的分离菌类型按GenBank中此类细菌的保守序列设计1对特异性引物(P1:5’-CACCTGAAACAAAGCATCCTA-3’;P2:5’-TATACGCTAAGCCACGTCCAT-3’。预扩增片段231 bp),送上海英潍捷基公司合成。无菌取细菌纯培养物1.2 mL,按照细菌DNA提取试剂盒说明书提取DNA,以提取的细菌DNA为模板进行PCR扩增。总反应体系25 μL:2×TaqMix 12.5 μL,上、下游引物(10 μmol/L)各1.0 μL,DNA模板2.0 μL,RNase Free H2O 8.5 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。1.2%琼脂糖凝胶电泳观察结果。
2.5 药物敏感试验将纯化细菌接种于普通琼脂培养基,放置相应药敏纸片,37 ℃培养12~16 h,测量各药物抑菌圈直径大小。
2.6 相关病毒RT-PCR核酸检测分别根据GenBank中 PEDVM基因(GenBankID:LY490763.1)、TGEVS基因(GenBankID:DI107744.1)、PoRVVP7基因(GenBankID:JQ343835.1)的保守序列各设计1对特异性引物,送上海英潍捷基公司合成,引物序列信息见表1。采集送检仔猪肠道内容物,按PEDV RNA提取试剂盒、TGEV RNA提取试剂盒、PoRV RNA提取试剂盒说明书分别提取3种病毒RNA。以提取的病毒RNA为模板,按HiFiScript cDNA Synthesis Kit试剂盒说明书进行RNA反转录,分别合成上述3种病毒基因cDNA。以3种cDNA作为模板,分别进行RT-PCR扩增。总反应体系25 μL:2×TaqMix 12.5 μL,上、下游引物(10 μmol/L)各1.0 μL,cDNA模板2 μL,RNase Free H2O 8.5 μL。反应条件见表2。最后1.2%琼脂糖凝胶电泳观察结果。

表2 3种病毒RT-PCR反应条件
3 结果
3.1 临床症状与病理变化发病仔猪表现精神萎靡,被毛粗乱,极度消瘦,水样腹泻,伴有运动失调。剖检可见:腹股沟淋巴结出血,肠壁扩张,肠道充气肿胀,内有黄色稀粪。其他脏器未见明显异常。
3.2 细菌分离培养鉴定结果接种肝脏病料的鲜血琼脂培养基上长出圆形、边缘整齐、表面光滑、隆起、湿润的白色菌落,呈不透明的α溶血现象。纯化细菌经革兰氏染色镜检,可见呈葡萄串状排列的革兰氏阳性球菌。分离菌符合葡萄球菌的生化特性(见表3)。分离菌PCR扩增出231 bp目的条带(见图1),为葡萄球菌特异性片段。综合鉴定分离菌为葡萄球菌。

表3 分离菌生化试验结果
3.3 药物敏感性试验由表3可见:分离菌对盐酸多西环素、硫酸安普霉素、泰乐菌素药物高度敏感,可作为治疗药物使用。
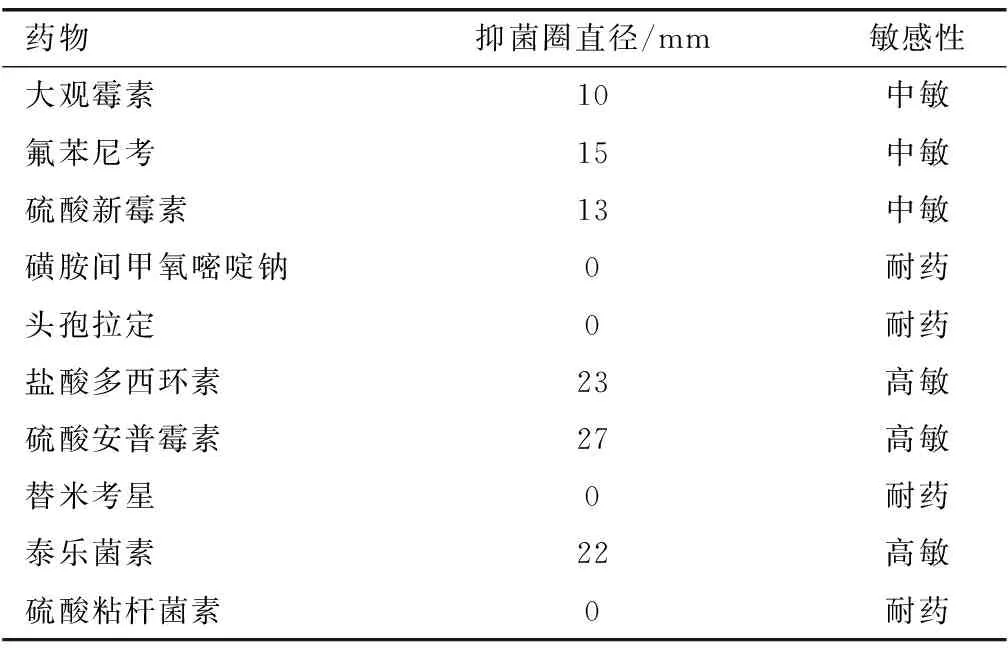
表3 分离菌药物敏感性试验结果
3.4 相关病毒RT-PCR核酸检测结果
3.4.1PEDV核酸检测由图2可见:2份检测样品RT-PCR扩增均出现651 bp目的条带,提示存在PEDV感染。
3.4.2TGEV核酸检测由图3可见:2份检测样品RT-PCR扩增未出现859 bp目的条带,表明无TGEV感染。
3.4.3PoRV核酸检测由图4可见:2份检测样品RT-PCR扩增未出现1 062 bp目的条带,表明无PoRV感染。
4 结论
通过对发病仔猪临床症状和剖检病变观察,细菌分离培养鉴定、生化试验、PCR检测,以及相关病毒RT-PCR核酸检测,综合诊断为猪流行性腹泻病毒与葡萄球菌混合感染。
5 讨论
5.1近年来,猪病毒性腹泻的流行暴发日益增多,发病率和死亡率较高,给我国养猪业造成很大的经济损失[5,6]。PEDV、TGEV、PoRV是常见的引发仔猪病毒性腹泻的病原,临床症状均主要以水样腹泻、呕吐、脱水和消瘦为特征,仅根据临床症状难以进行鉴别诊断[7,8]。随着我国养猪业规模化、集约化发展,猪场多种病原混合或继发感染现象较严重。胡兴义等[9]对贵州地区2013—2015年引起仔猪病毒性腹泻的原因进行流行病学调查,结果显示PEDV的阳性检出率为63.54%,是引起仔猪病毒性腹泻的主要病原,其次是PoRV和TGEV,且出现PEDV与其他2种病毒的混合感染。刘贺[10]2016年9月对某规模化猪场腹泻死亡病例进行细菌分离鉴定和病原RT-PCR检测,结果表明引发腹泻死亡的原因是PEDV和大肠杆菌混合感染。胡兴义等[11]对贵阳市某猪场腹泻病猪通过实验室检测,结果为猪流行性腹泻与链球菌混合感染。本实验检测结果表明,引发该猪场仔猪腹泻的原因是PEDV和葡萄球菌混合感染。由于目前尚无治疗PEDV的特效药物,疫苗免疫接种仍是预防该病最主要的手段。建议猪场淘汰发病猪,病死猪深埋或焚烧处理,对圈舍进行严格消毒处理,同时选择相应疫苗和合理的免疫程序加强对PEDV的免疫。
5.2猪葡萄球菌病是猪的常见疾病,猪感染后常表现渗出性皮炎与败血性关节炎[12],特别是猪抵抗力下降时更易感染。猪葡萄球菌极易产生耐药性,临床上应选择敏感性较强的药物合理交替使用,防止或减少耐药性的产生[13~15]。本实验分离的葡萄球菌对盐酸多西环素、50%硫酸安普霉素、泰乐菌素敏感性最高,对磺胺间甲氧嘧啶钠、头孢拉定、替米考星、硫酸粘杆菌素产生耐药,建议该猪场选择高敏感药物进行治疗。

