去甲氧柔红霉素联合阿糖胞苷治疗急性髓系白血病患者的效果观察
段永涛, 刘接班, 李瑞花
(陕西省咸阳市中心医院 血液内科, 陕西 咸阳, 712000)
急性髓细胞白血病(AML)也称为急性非淋巴细胞白血病或急性粒细胞白血病,是由造血干细胞或祖细胞克隆导致的血液疾病,主要特征表现为髓系异常的幼稚细胞增生以及正常造血细胞的受损[1]。目前AML经典治疗思路为“诱导缓解、巩固治疗联合维持治疗”,先通过化疗使患者病情完全缓解,再依照患者状态继续给予数个疗程的化疗以彻底消除其体内的残留病灶[2]。目前随着化疗方案的不断改进,以及新型药物和造血干细胞移植的发展,AML患者生存率及生存时间都得到了大幅改善。蒽环蒽醌类抗生素联用阿糖胞苷方案是治疗AML的标准诱导缓解方案,柔红霉素是常用的抗肿瘤药,但其缓解期较短[3]。去甲氧柔红霉素是美国食品与药品管理局于1990年正式批准用于急性髓系白血病联合化疗的药物,是柔红霉素类似药物,与柔红霉素比较,其脂溶性较高,易被细胞摄取,半衰期长,可发挥较好的细胞杀伤作用[4]。本研究采用去甲氧柔红霉素联合阿糖胞苷治疗AML, 分析该治疗方案的疗效与安全性,报告如下。
1 资料与方法
1.1 一般资料
回顾性分析本院2014年7月—2016年1月收治的60例AML患者的临床资料,将采用去甲氧柔红霉素联合阿糖胞苷治疗的31例患者设为A组,将采用柔红霉素联合阿糖胞苷治疗的29例患者设为B组。A组男17例,女14例; 年龄15~71岁,平均(55.40±3.37)岁; FAB分型包括M0型6例, M2型10例, M4型8例, M5型7例。B组男16例,女13例; 年龄16~72岁,平均(55.97±3.41)岁; FAB分型包括M0型7例, M2型8例, M4型8例, M5型6例。2组一般资料比较无显著差异(P>0.05)。
纳入标准: ① 患者符合世界卫生组织急性髓系白血病诊断标准[5]; ② 患者初发急性髓系白血病,并于本院进行初治; ③ 患者年龄12~80岁; ④ 患者美国东部肿瘤协作组(ECOG)体能状况评分为0~2分; ⑤ 患者临床资料完整。排除标准: ① 复发或已经采取过治疗措施者; ② 合并严重的脏器功能障碍者; ③ 合并肺病感染等一系列严重的并发症者; ④ 合并严重伴发疾病者,如未能控制的糖尿病; ⑤ 慢性粒细胞白血病急性病变者; ⑥ 合并恶性肿瘤病史或接受过放疗与化疗者; ⑦ 妊娠或哺乳期妇女。
1.2 化疗方案
若化疗前白细胞计数≥50×109/L, 则先给予羟基脲口服,以降低血液中白细胞数量,减轻细胞负荷,预防肿瘤溶解综合征的发生。所有患者化疗前后均行血常规、心肌酶学、心电图、骨髓穿刺、肝肾功能以及胸部 CT和B超等检查。化疗期间每1~2 d进行血常规复查,每周复查肝肾功能2次。
A组诱导治疗标准方案: 第1~3天静脉注射柔红霉素(意大利Actavis Italy S.P.A, 注册证号H20130940)30~50 mg/(m2·d); 第1~7天静脉滴注阿糖胞苷(意大利Actavis Italy S.P.A, 注册证号H20100594)100 mg/(m2·d)。B组第1~3天静脉注射去甲氧柔红霉素(意大利Actavis Italy S.P.A, 注册证号H20130686)8~12 mg/(m2·d); 第1~7天静脉滴注阿糖胞苷100 mg/(m2·d)。
2组患者化疗过程中均给予营养支持与补液,同时进行胃黏膜保护,给予止吐、护肝、碱化、水化治疗。血尿酸升高者,给予碳酸氢钠降尿酸处理。监测患者血常规变化情况,血红蛋白(Hb)水平<60 g/L者给予悬浮红细胞输注以纠正贫血状态,血小板(PLT)水平<10× 109/L或存在出血倾向者给予血小板输注以提高血小板水平,停化疗后48 h出现粒细胞缺乏可给予皮下注射粒细胞集落刺激因子,对出现感染者给予抗感染治疗。
1.3 评价指标
① 疗效标准: 比较2组患者治疗1个疗程后的临床疗效,分为完全缓解、部分缓解、未缓解。治疗前存在染色体异常者于治疗后恢复正常,分子水平完全缓解,形态学完全缓解,外周血白细胞分类中无白血病细胞,评定为完全缓解; 骨髓幼稚细胞占5%~25%, 较治疗前下降大于50%或幼稚细胞小于5%, 评定为部分缓解; 骨髓象、血象以及临床3项均不能达到上述标准[3], 评定为未缓解。② 血液学与非血液学不良反应。参照世界卫生组织抗癌药物常见不良反应分级标准,评价2组患者不良反应发生情况。③ 生存分析。比较2组患者无进展生存期、总生存期。无进展生存期是指患者治疗开始直至疾病进展、复发、死亡、随访结束或者失访的时间,总生存期是指治疗开始到死亡、随访结束或失访的时间。
1.4 统计学分析
采用SPSS 20.0进行统计学分析。非正态分布计量资料比较采用秩和检验,计数资料比较釆用卡方检验,总生存期和无进展生存期釆用Kaplan-Meier生存曲线,P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效比较
A组治疗总有效率为93.55%, 显著高于B组的72.41%(P<0.05)。见表1。
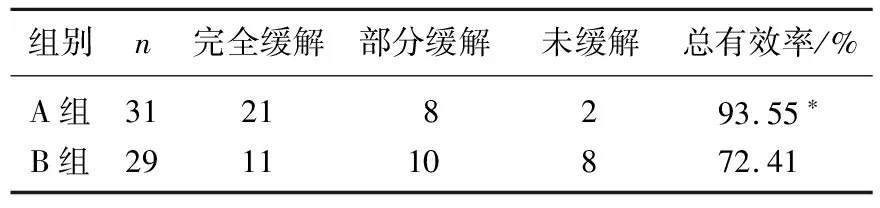
表1 2组患者临床疗效比较
2.2 2组化疗后血液学毒性比较
2组患者均出现了较为严重的骨髓抑制,所有患者都出现了Ⅲ~Ⅳ期血液学毒副作用,但2组血液学毒性比较无显著差异(P>0.05)。见表2。
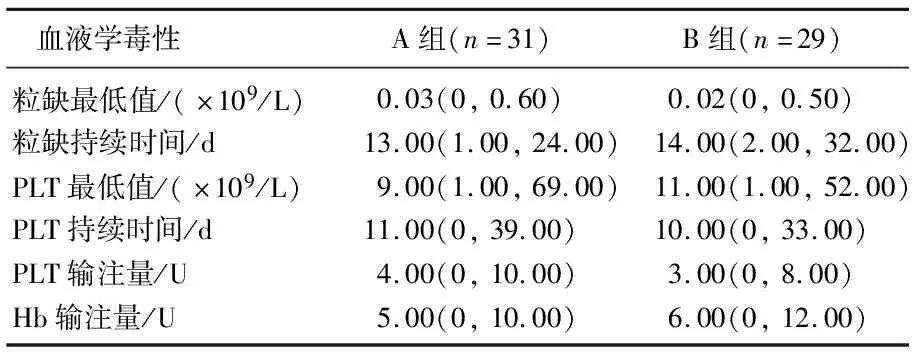
表2 2组化疗后血液学毒性比较
2.3 2组化疗后非血液学不良反应比较
2组化疗后非血液学不良反应如恶心呕吐、口腔感染、肠胃炎、肝肾功能受损、上呼吸道感染、泌尿系统感染、皮肤感染、肺部感染、败血症等发生率比较无显著差异(P>0.05)。见表3。
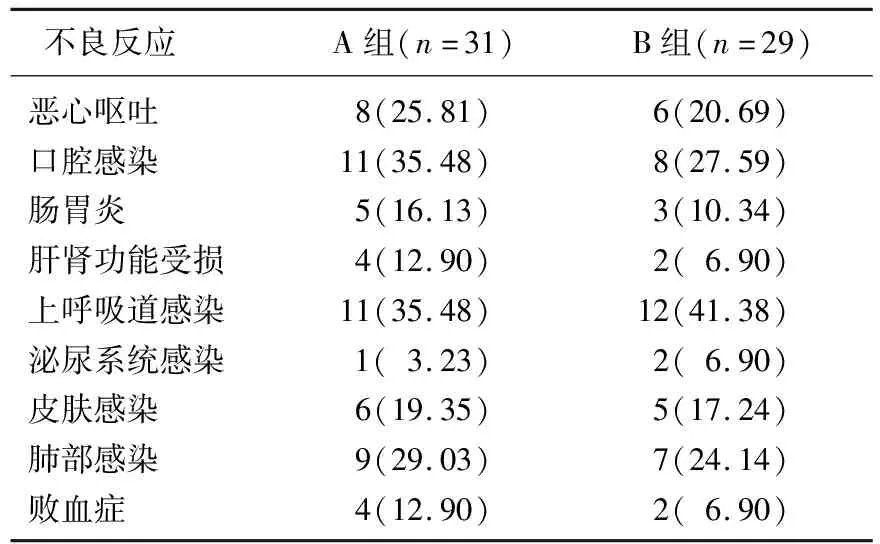
表3 2组化疗后非血液学不良反应比较[n(%)]
2.4 2组3年生存情况比较
A组3年中位总生存时间为30个月(95%CI为23.70~32.00), B组3年中位总生存时间为28个月(95%CI为22.70~30.20); A组3年中位无进展生存时间为26个月(95%CI为21.60~30.40), B组3年中位无进展生存时间为25个月(95%CI为19.70~30.30)。A组3年总生存率为48.39%, 无进展生存率为35.48%, B组3年总生存率为38.71%, 无进展生存率为29.03%, 2组比较差异无统计学意义(P>0.05)。见图1。
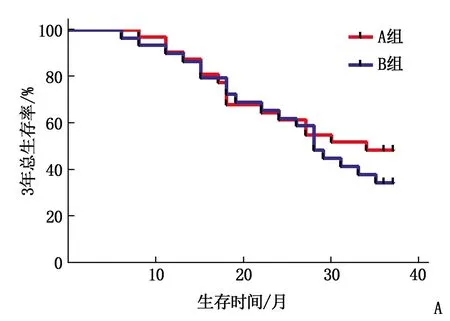
A: 2组3年总生存率比较; B: 2组3年无进展生存率比较。
3 讨 论
AML主要特点为髓系造血干细胞的异常增殖、分化受阻、凋亡抑制,正常造血细胞的生长被限制,其他组织器官遭到浸润破坏[6]。AML主要与物理、化学、生物、遗传以及其他恶性血液病的转化有关[7]。
蒽环类抗生素已成为临床恶性血液系统肿瘤的首选治疗药物之一,该类药物通过抑制肿瘤细胞的DNA及RNA合成,抑制有丝分裂过程,导致肿瘤细胞凋亡[8-9]。去甲氧柔红霉素是柔红霉素蒽环结构第4个碳元素去除-OCH基团衍生而成,其对类脂具有较强的亲和力,比柔红霉素具有更高的脂溶性,可快速穿透细胞膜,在细胞中的浓度较血浆浓度高,在患者细胞内的浓度可达到柔红霉素2倍以上,能够迅速透过血脑屏障[10-12]。去甲氧柔红霉素生物活性以及血浆半衰期均较长,对白血病细胞具有更强的杀伤力[13]。去甲氧柔红霉素是周期性的非特异性药物,与其他的蒽环类药物不存在交叉耐药性,与阿糖胞苷等联合应用具有协同作用[14-15]。去甲氧柔红霉素代谢产物具有强烈的细胞毒作用,其在肝脏中代谢为伊达比星醇,伊达比星醇较去甲氧柔红霉素的活性更强,半衰期长,表现为持续性的抗肿瘤效应,其他蒽环类药物代谢产物抗肿瘤作用较母药明显降低[16]。
本研究中, AML患者经过1个疗程的诱导缓解治疗后, A组总有效率显著优于B组,提示去甲氧柔红霉素联合阿糖胞苷的用药方案更适合AML患者的诱导缓解治疗,与孙爱宁等[17]研究结果相符。本研究结果表明, 2组患者主要血液方面毒副作用均为重度骨髓抑制,患者外周血象出现不同程度全血细胞减少现象。本研究2组血液学不良反应无显著差异, 2组患者均出现了不同程度的胃肠道反应、皮肤黏膜出血、心脏损害、肝脏毒性等不良反应,但组间比较无显著差异。2组患者毒副反应在化疗结束后或经过相应对症处理后均有效缓解。李亮[18]研究表明,去甲氧柔红霉素联合阿糖胞苷治疗可有效延长AML患者中位生存时间,患者疾病复发率显著低于柔红霉素联合阿糖胞苷用药方案。去甲氧柔红霉素不仅具有较强的亲脂性,易透过细胞膜,还能耐受药物外排,杀伤微小残留病灶细胞,降低复发率。
综上所述,去甲氧柔红霉素联合阿糖胞苷治疗AML疗效显著,但用药期间存在明显的骨髓抑制反应,不良反应发生率较高,与采用柔红霉素治疗患者的3年总生存率与无进展生存率无显著差异。

