关于仰视、俯视读数误差的分析
◇ 甘肃 景成刚
化学实验中因仰视、俯视读数导致实验出现误差的情况分析是教学和考试的重点之一.解答这类问题,首先要会画仰视读数、正确读数、俯视读数示意图,先夸张一点画出仪器中液体的凹液面,水平观察且视线与凹液面相切是正确读数方法,从下往上看且视线与凹液面相切是仰视,从上往下看且视线与凹液面相切是俯视.不同仪器中仰视、俯视读数导致实验误差不同,具体分析如下.
1 容量瓶
容量瓶瓶颈上只有一条刻度线,定容时如果仰视刻度线,得到溶液的体积偏大,所配制溶液浓度偏小;如果俯视刻度线,得到溶液的体积偏小,所配制溶液浓度偏大.
例1某浓硫酸试剂瓶上的标签如图1 所示,根据标签上的有关数据回答下列问题:
(1)该试剂中H2SO4的物质的量浓度为mol·L-1.
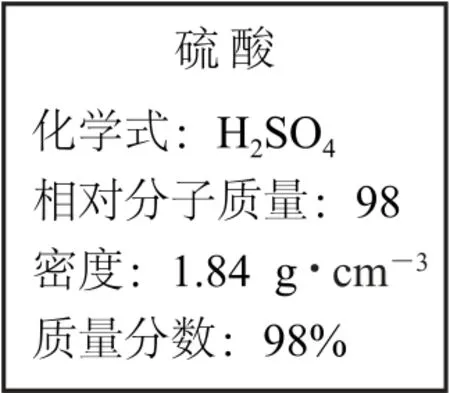
图1
(2)某同学欲配制920 mL物质的量浓度为0.30mol·L-1的稀硫酸,首先选择量程为mL的容量瓶,然后经理论计算需要量取mL上述浓硫酸(计算结果保留小数点后1位).
A.浓硫酸稀释后未冷却即转移
B.容量瓶使用前内壁沾有水珠
C.加蒸馏水时,不慎超过了刻度线
D.某同学观察时俯视液面
分析量筒内倒出的液体就是液体的体积,量筒不用洗涤,如果洗涤并将洗涤液转移到容量瓶中,所配溶液浓度偏高;浓硫酸溶于水放热,未冷却立即转移到容量瓶中并定容,定容后冷却至室温,溶液体积会缩小,造成所配溶液浓度偏大.
(1)H2SO4的物质的量浓度为
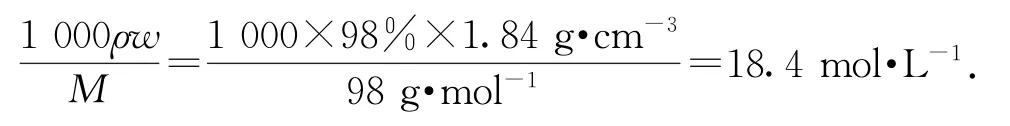
(2)配制920mL物质的量浓度为0.30mol·L-1的稀硫酸,需要选用1000 mL 的容量瓶,根据物质的量守恒,所需浓硫酸的体积为

(3)浓硫酸稀释后未冷却即转移,导致溶液体积偏小,浓度偏大,选项A 错误;容量瓶使用前内壁沾有水珠对实验结果无影响,选项B错误;加蒸馏水时,不慎超过了刻度线,导致溶液体积偏大,浓度偏小,选项C正确;俯视液面,导致溶液体积偏小,浓度偏大,选项D 错误.答案为C.
2 滴定管
滴定管是精密仪器,0刻度在滴定管的上面,如果开始时仰视,滴定终点俯视,测得溶液体积偏大;如果开始时俯视,滴定终点仰视,测得溶液体积偏小.
例2酸碱中和滴定是中学化学重要实验,下列有关滴定操作的说法正确的是( ).
A.用25mL酸式滴定管进行中和滴定时,用去盐酸的体积为21.7mL
B.用已知浓度的盐酸测定未知浓度的NaOH 溶液,洗净酸式滴定管后直接取标准盐酸进行滴定,则测定结果偏低
C.用已知浓度的KOH 溶液滴定未知浓度的盐酸,用含有NaOH 杂质的固体KOH 配制标准溶液,测定结果偏高
D.用未知浓度的硝酸滴定标准的NaOH 溶液时,读数时滴定前仰视,滴定终点俯视,测定结果偏高
分析关于滴定管仰视、俯视读数的误差分析,最好的办法就是自己画示意图,读出来的数据偏小,计算的浓度就偏小;读出来的数据偏大,计算的浓度就偏大.滴定管读数要精确到0.01mL,选项A 错误;滴定管没有润洗,滴定管中残留的水使标准液稀释,浓度减小,消耗标准液体积增大,则测定结果偏高,选项B错误;相同质量的NaOH 和KOH,NaOH 中和盐酸的量多,KOH 固体中混有NaOH,消耗KOH 溶液的量减小,测定结果偏低,选项C 错误;若滴定前仰视读数,滴定至终点俯视读数,导致读数偏小,依据可知测定结果偏高,选项D正确.
总之,仰视、俯视读数误差的分析,最好的方法是首先了解仪器的构造,画出容器中液体的凹液面,再画仰视、俯视线,最后分析误差.
——以“NaOH标准溶液的标定”微课教学为例

