猪圆环病毒抗原表位肽免疫层析试纸条的研制
杨 礼
(甘肃农业大学应用技术学院,甘肃 临洮 730500)
1 材料和仪器
1.1 材料
PVC衬板、NC膜、玻璃纤维和吸水纸均购自GE公司;蔗糖、吐温20、氯金酸和氯化钠购自SIGMA公司;金黄色葡萄球菌A蛋白 (Staphylococal Protein A,SPA)、 聚 乙烯吡咯烷酮(Polyvinylpyrrolidone,PVP)、柠檬酸三钠、牛血清白蛋白(Bovine Serum Albumin,BSA)和海藻糖购自BD公司;纯净水购自娃哈哈公司;SPA免疫兔血清纯化后的IgG和猪圆环病毒抗原表位肽由本实验室保存。
1.2 仪器
4 ℃离心机和纳米粒度仪均购自马尔文(Malvern)公司,型号分别为MGLD4-2A和ZNE3600。
2 方法
2.1 胶体金颗粒的制备
2.1.1 玻璃器皿的清洁
玻璃表面少量的污染会干扰胶体金颗粒的生成,一切玻璃器皿应该绝对清洁,使用前经过酸洗和硅化。硅化过程一般是将玻璃容器浸泡于5%二氯二甲硅烷的氯仿溶液1 min,室温干燥后蒸馏水冲洗,再干燥备用。
2.1.2 胶体金溶胶制备
胶体金颗粒的直径与制备时加入的柠檬酸三钠的数量密切相关,保持其他条件恒定,只改变加入的柠檬酸三钠的数量,可制得不同颜色的胶体金,也就是不同粒径的胶体金(表1)。胶体金的光散射性与溶胶颗粒的大小密切相关,一旦颗粒大小发生变化,光散射性也随之发生变异,有肉眼可见的显著颜色变化。

?
在硅化后的锥形瓶中加入100 mL水,置于磁力搅拌器上加热,同时加入1 mL 1%的氯金酸水溶液,加热至沸,调整至一定转速后边搅拌边逐滴加入2 mL 1%的柠檬酸三钠水溶液,继续煮沸15 min;胶体金溶液的颜色由蓝变紫,再由紫变红,冷却后用蒸馏水定容至初始体积,置4 ℃保存。
2.1.3 胶体金颗粒大小测量
取50 μL制备好的胶体金,放入纳米粒度仪内测定胶体金颗粒的大小。
2.2 金标SPA(抗原)最佳标记条件的确定
2.2.1 SPA最佳标记量的确定
⑴将SPA溶解稀释成0.2 mg/mL;
⑵取96孔板,每孔加入100 μL的胶体金;
⑶ 将 1 μL~ 20 μL 0.2 mg/mL的SPA分别加入每孔并混匀,静置15 min;
⑷每孔加入20 μL 10% NaCl溶液,放置10 min,颜色保持红色的为最小蛋白用量,在此基础上加20%为最佳标记量。
2.2.2 SPA与胶体金最佳标记pH确定
⑴取96孔板,每孔加入100 μL的胶体金;
⑵每孔加入已确定的SPA的最佳标记量 ;
⑶每孔分别加入2 μL、4 μL、6 μL、8 μL、10 μL、12 μL、14 μL和15 μL的0.1 mol/L K2CO3并混匀,静置15 min;
⑷每孔加入20 μL的10% NaCl溶液,放置10 min;
⑸颜色仍保持红色的为最佳量,测定pH,即为SPA与胶体金的最佳标记pH。
2.3 SPA-胶体金重悬液的制备
2.3.1 重悬液的配制
按下面的方法配制重悬液。
⑴取5 g蔗糖、0.121 g三羟甲基氨基甲烷(Trishydroxymethylaminomethane,Tris)、500 μL吐温20、2 g BSA、3%海藻糖和0.5% PVP,溶于100 mL双蒸水中,过滤备用。
⑵取5 g蔗糖、0.121 g Tris、500 μL吐温20和2 g BSA,溶于100 mL双蒸水中,过滤备用。
2.3.2 SPA-胶体金重悬液量的确定
在1 mL胶体金溶液中按最佳标记量加入SPA,加入一定体积的0.1 mol/L K2CO3调节至最佳pH,室温下计时放置30 min,每隔5 min震荡一次。加入5% BSA至终浓度为1%,室温下计时放置20 min,每隔5 min震荡一次;4 ℃,2 000 r/min离心10 min,弃沉淀;收集上清液,4 ℃,10 000 r/min离心30 min;离心后,上清无色透明最好(图1)。小心吸去上清,将沉淀分别溶于100 μL、150 μL和200 μL的重悬液中,制成不同重悬液的标记胶体金溶液。

图2 金标垫成品图
2.4 样品垫的预处理
⑴取0.6 g Tris、1 g吐温20、1 g PVP和1 g BSA溶于100 mL水中,过滤备用。
⑵取20 mmol/L聚丁烯(Polybutylene,PB)、1%吐温20、1% BSA和2.5%蔗糖溶于100 mL水中,过滤备用。
将玻璃纤维膜切成4 mm左右的样品条,然后分别浸泡于两种处理液中,室温晾干或烘干。
2.5 金标垫的制备
SPA-胶体金重悬液混匀后分别涂抹于未做任何处理的玻璃纤维纸条上,吸附比例为10 μL/cm~50 μL/cm。自然干燥或烘干(图2)后避光保存。

图2 金标垫成品图
2.6 猪圆环病毒抗原表位肽与兔抗SPA IgG浓度的确定
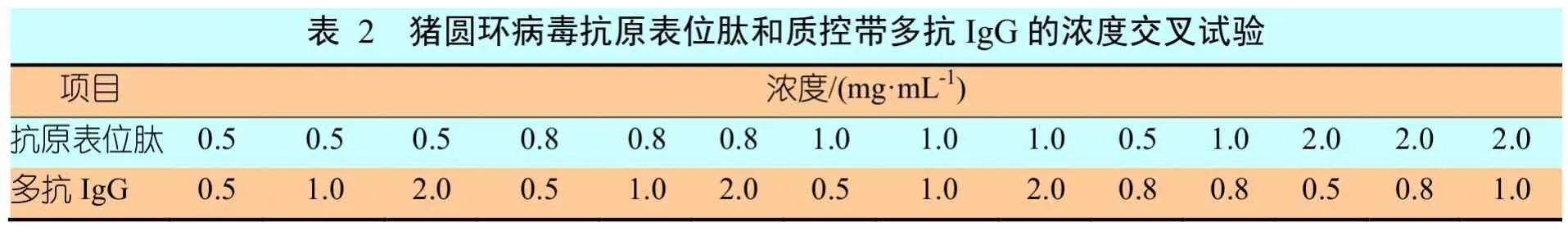
为建立质控带和检测带,将不同浓度猪圆环病毒的抗原表位肽与兔抗SPA IgG通过交叉试验(表2),分别以1 μL/cm的速度喷于硝酸纤维素膜上,制成试纸条,观察显色,测定两者反应的最佳浓度。
?
⑴纯化后的猪圆环病毒抗原表位肽的包被浓度分别为0.5 mg/mL、0.8 mg/mL和1 mg/mL;
⑵兔抗SPA IgG的包被浓度分别为0.5 mg/mL、1 mg/mL和 2 mg/mL;
2.7 猪圆环病毒抗原表位肽免疫层析试纸条的制备
在确定了胶体金的制备条件、标记物最适浓度、检测带优势抗原表位肽浓度和质控带多抗IgG浓度的基础上,制备猪圆环病毒抗原表位肽免疫层析试纸条。试纸条的构造主要包括PVC衬板、NC膜、吸收垫、样品垫、金标垫、检测带和质控带(图3)。具体制备过程如下:
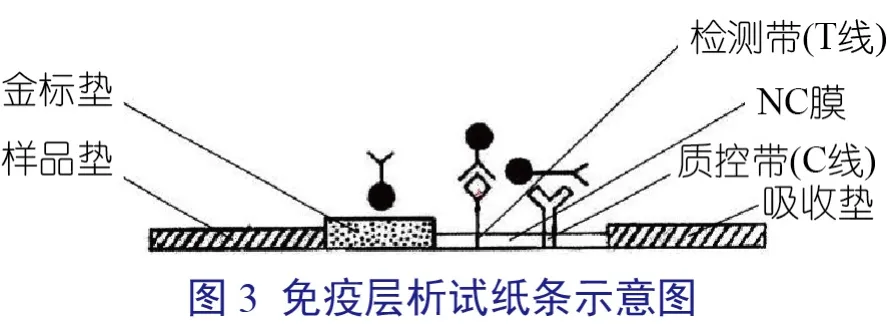
⑴将优势抗原表位肽和兔抗SPA IgG用超纯水稀释为步骤2.6所测得的最佳浓度。按1 μL/cm的速度将两种蛋白喷于硝酸纤维素膜上,分别形成检测带和质控带。
⑵在PVC底板上分别将预处理的玻璃纤维纸制成的样品垫、检测带和质控带以及金标垫和吸收垫按图3装配(各部分略有重叠即可)。以纵向剪切,裁成宽为4 mm的条状成品,即为试纸条成品。
2.8 试纸条的检测原理及结果判定
如果血液样品中含有PCV2抗体,将该血清适度稀释后加在本试纸条的样品垫上,该液体随后会沿着试纸条进入金标蛋白释放垫中,血液样品中含有的PCV2抗体与金标垫上标记胶体金的SPA结合形成相应的复合物,前行与包被的PCV2优势抗原表位肽结合后形成红色线条,即在检测带形成红色条带,继续前行,未与抗原结合的抗体携带SPA与已包被的兔抗SPA IgG抗体形成红色线条,即在质控带形成红色条带。如果质控带不出现红色条带,则说明该试纸条失效。如果被检血液样品中不含有PCV2相关抗体,则检测带不会出现红色条带,但质控带必定会出现红色条带。
2.9 血清样品的稀释度测定
将阴性血清和阳性血清倍比稀释,在已确定的抗原最佳标记量和最佳pH、质控带检测线浓度、重悬液配方及用量以及样品垫的预处理方式等条件下,制作免疫层析试纸条,分别取1∶100、1∶200、1∶500、1∶800、1∶1 000稀释的阴性血清和阳性血清进行检测。
2.10 自制试纸条与市售成品试纸条的对比
将制好的试纸条与市售成品试纸条进行效果比对。
3 结果与分析
3.1 胶体金颗粒大小测定结果
胶体金颗粒大小测定结果如图4及表3。
由图4和表3可得:所制胶体金颗粒直径大约在10 nm~14 nm之间,符合我们的要求。

3.2 标记抗原的最佳标记量和最佳pH
由图5可得,第3孔仍保持红色,即最小蛋白浓度为6 μg/mL,在该基础上加20%,则SPA的最佳标记量为7 μg/mL。
由试验可知,pH为6.0时,为最佳标记pH。
3.3 重悬液的最适量

?

由试验可知,当重悬液按照5 g蔗糖、0.121 g Tris、500 μL吐温20、2 g BSA、3%海藻糖和0.5% PVP溶于100 mL双蒸水的方法配制,加入量为200 μL时,效果最佳。效果如图6。
3.4 猪圆环病毒抗原表位肽与兔抗SPA多抗IgG浓度
交叉试验表明抗原表位肽的包被浓度为1 mg/mL,多抗IgG的浓度为1 mg/mL时,效果最佳。

图6 加入适量重悬液效果图
3.5 样品垫的预处理
样品垫按照标题“2.4 样品垫的预处理”中的“(2)取20 mmol/L聚丁烯(polybutylene,PB)、1.5 mL 1.0%吐温20、1 mL 1.0% BSA和3 g 2.5%蔗糖溶于100 mL水中”配制处理后,效果良好。
3.6 待检血清样品的稀释度测定
检测结果表明,阴性血清和阳性血清在1∶100稀释的条件下,试纸条显色最强,颜色最鲜明,即检测效果最好。
3.7 自制试纸条与市售成品试纸条的对比
将制成的试纸条装入现成的盒子中,加入100 μL的1∶100稀释的阳性血清,对比效果如图7。

自制试纸条质控带和检测带均显色良好,几种市售成品试纸条检测带显色较淡或假阴性较强。故本试验所制试纸条检测效果明显相对较好。
4 讨论
胶体金免疫层析技术是一种将胶体金标记技术和蛋白质层析技术结合的免疫检测技术[6]。其原理为:将各种已知反应试剂分点固定在层析试纸条上,检测样品加在试纸条的一端,使其通过毛细管作用在层析试纸条上泳动,样本中的检测物与层析试纸条中的反应试剂发生特异性结合反应,形成的复合物被富集或固定在层析试纸条上的特定区域(检测带和质控带),通过标记免疫技术显色[7]。具有操作方便和不需要任何仪器、体积小、易于判断、灵敏度高、特异性好以及速度快等特点[8]。如今该技术已广泛应用于动物检疫工作中,如猪瘟、猪繁殖与呼吸综合征和猪细小病毒病等传染病的病原微生物抗原和抗体检测,也可用于一些违禁和超量使用激素残留的检测[9]。
目前,PCV2的诊断方法主要为PCR、免疫组化、原位杂交、免疫过氧化物酶单层试验(IPMA)和间接免疫荧光(IIF),这些方法主要用于检测抗原。PCV2的抗体检测主要手段为酶联免疫吸附试验(ELISA)等,ELISA包括竞争ELISA、间接ELISA和抗原捕获ELISA等。IIF和IPMA较为经典,但对操作要求很高,不便于大量样品的检测,ELISA操作简单可靠,特异性好,但需要借助昂贵的仪器[10]。
本次试验将兔抗SPA IgG和纯化猪圆环病毒抗原表位肽作为质控带和检测带标记于硝酸纤维素膜上,并与样品垫、金标垫和吸水纸组装成免疫层析检测试纸条。经验证,该试纸条不同批次间和同一批次内重复性较好,具有较好的灵敏度、特异性和稳定性,能够准确检测猪血清样品中的抗体水平,可以进一步评价猪圆环病毒病疫苗的免疫效果。将自制试纸条与市售试纸条进行对比较,自制试纸条的检测结果明显好于市售试纸条。
参考文献:(10篇,略)

