水碱连续提取黄皮疣柄牛肝菌粗多糖的理化性质及抗氧化活性研究
,*
(1.滇西应用技术大学普洱茶学院,云南普洱 665000;2.普洱茶研究院,云南普洱 665000;3.云南农业大学食品科学技术学院,云南昆明 650201)
黄皮疣柄牛肝菌(Leccinellumcrocipodium(Letellier.)Watliag),子实体中等。菌盖直径4~7.5 cm,菌盖边缘幼时微内卷,呈土黄色、橘黄色、褐黄色,后期呈龟裂状花纹,因此滇中地区又称其为黄癞头[1]。黄皮疣柄牛肝菌味道鲜美,富含蛋白质、膳食纤维、矿物质等营养成分[2-3]以及多糖、多酚等生物活性成分[4-5],深受人们的青睐。
水提多糖法是一种传统的提取方法,因该提取方法无毒无害,且操作简单成本低,适合大规模生产。目前对黄皮疣柄牛肝菌多糖的研究主要集中在热水提取多糖上。岳万松[6]研究发现,通过热水法提取的黄皮疣柄牛肝菌多糖具有一定的抗氧化活性。常用的热水提取法不能溶出胞内多糖和细胞壁结合多糖[7-8],碱性溶液在提取过程中能够更好地破坏细胞壁中纤维素和半纤维素之间的氢键[9],使得不溶性多糖从细胞壁当中释放出来,转化为可溶性多糖。Khatua等[10]研究表明碱提红菇粗多糖具有较好的抗氧化活性。热水提取多糖后的残渣未能得到充分利用便丢弃,既增加了环境的负担,而且降低了开发利用的价值,研究表明[11-14],通过热水提取多糖后剩余的残渣,可以通过碱液提取进一步提取剩余多糖。为将黄皮疣柄牛肝菌中所含多糖提取最大化,本实验先采用水提法,提取黄皮疣柄牛肝菌粗多糖,剩余残渣;而后又采用碱提法对残渣中的多糖进行提取,并且考察了两种粗多糖的理化性质及抗氧化活性,为黄皮疣柄牛肝菌多糖的进一步研究提供参考。
1 材料与方法
1.1 材料与仪器
黄皮疣柄牛肝菌鲜菌 云南易门康源菌业有限公司;葡萄糖、氢氧化钠、四硼酸钠、硫酸钡、明胶、硫酸钾、无水碳酸钠、无水乙醇、苯酚、抗坏血酸、水杨酸、硫酸亚铁、铁氰化钾、氯化铁、NaH2PO4·2H2O、Na2HPO4·12H2O 天津市风船化学试剂科技有限公司;盐酸 西陇化工股份有限公司;浓硫酸 云南杨林工业开发区汕滇药业有限公司;咔唑、D-半乳糖醛酸 山东西亚化学工业有限公司;三氯乙酸 天津市科密欧化学试剂有限公司;牛血清蛋白、考马斯亮蓝G-250 昆明杰辉生物有限公司;磷酸 成都市科龙化工试剂厂;没食子酸 上海晶纯生化科技股份有限公司;福林酚 北京索来宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、吩嗪硫酸甲酯(PMS)、氯化硝基四氮唑蓝(NBT)、烟酰胺腺嘌呤二核苷酸(NADH) Sigma公司;所用试剂 均为分析纯。
Heidolph Didital旋转蒸发仪 德祥科技有限公司;FD-1B-50型冷冻干燥机 北京博医康实验仪器有限公司;UV-2450型紫外分光光度计 岛津仪器(苏州)有限公司;FST-PF-UP普利菲尔实验室超纯水机 上海富诗特仪器设备有限公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器有限公司;HWS28型电热恒温水浴锅 上海一恒科技有限公司;FW135型粉碎机 天津泰斯特仪器有限公司;Mettler-Toledo Pl1502型分析天平 上海微川精密仪器有限公司;Mettler-Toledo MS104TS分析天平 上海微川精密仪器有限公司。
1.2 实验方法
1.2.1 黄皮疣柄牛肝菌粗多糖提取 将黄皮疣柄牛肝菌鲜菌除杂后清洗干净切片,于-80 ℃预冻处理,放入冷冻干燥机进行真空升华干燥,然后打磨成粉过80目筛,真空包装备用。采用水提醇沉法从黄皮疣柄牛肝菌子实体中提取得到水提粗多糖(LPS),再用碱提醇沉法从菌渣中提取得到碱提粗多糖(LPJ)。
水提粗多糖:采用热水法提取黄皮疣柄牛肝菌多糖:取适量冻干粉,按液料比34∶1 (mL/g)充分混匀,51 ℃下水浴3.1 h,提取液经4000 r/min离心10 min,沉淀备用。取上清液,50 ℃旋转蒸发浓缩至原体积的1/5,冷却后边搅拌边缓慢加入4倍体积浓缩液的无水乙醇,置于4 ℃冰箱静置过夜。4000 r/min离心10 min弃上清,沉淀用适量去离子水溶解,于-80 ℃预冻处理,放入冷冻干燥机进行真空升华干燥。
碱提粗多糖[15-16]:水提后的黄皮疣柄牛肝菌残渣用水浸洗后,按照20∶1的液料比用0.3 mol/L NaOH浸提2.5 h,4000 r/min离心10 min取上清,用0.5 mol/L HCl调至中性,在50 ℃下旋转蒸发浓缩至原体积的1/5,冷却后边搅拌边缓慢加入4倍体积浓缩液的无水乙醇,置于4 ℃冰箱静置过夜。4000 r/min离心10 min弃上清,沉淀用适量去离子水溶解,于-80 ℃预冻处理,放入冷冻干燥机进行真空升华干燥。
1.2.2 黄皮疣柄牛肝菌粗多糖理化性质
1.2.2.1 多糖得率 水提粗多糖(LPS)称重,计算得率。

碱提粗多糖(LPJ)称重,计算得率。

1.2.2.2 多糖含量测定 采用苯酚-硫酸法[17]绘制葡萄糖标准曲线,回归线性方程为y=0.0096x-0.0035,R2=0.9998,其中y代表490 nm波长下的吸光值A,x代表葡萄糖浓度(μg/mL)。
样品测定,分别称取一定量的LPS与LPJ,配制成浓度为0.1 mg/mL的多糖溶液。离心取上清。平行三次测定吸光值。按照标准曲线回归方程计算LPS与LPJ多糖含量。
1.2.2.3 糖醛酸含量测定 采用咔唑-硫酸比色法[18-20]绘制糖醛酸标准曲线,回归线性方程为y=7.3957x+0.0005,R2=0.9988,其中y代表523 nm下的吸光值A,x代表糖醛酸浓度(mg/mL)。
样品测定:精密称取LPS与LPJ,分别配制成浓度为1 mg/mL的多糖溶液,平行三次测定吸光值,按照标准曲线回归方程计算样品中糖醛酸含量。
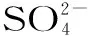
样品测定:分别取LPS与LPJ,以1 mol/L的盐酸配制成2.5 mg/mL的多糖溶液。于100 ℃水浴8 h,4000 r/min离心20 min取上清。平行三次测定吸光值,按照标准曲线回归方程计算LPS与LPJ硫酸根含量。
1.2.2.5 蛋白质含量测定 采用考马斯亮蓝法(bradford法)[24-25]绘制蛋白质标准曲线,回归线性方程为 y=0.0071x-0.0020,R2=0.9978,其中y代表595 nm下的吸光值A,x代表蛋白质标准溶液浓度(μg/mL)。
样品测定:分别配制LPS与LPJ为0.1 mg/mL多糖溶液,平行三次测定吸光值,按照标准曲线回归方程计算LPS与LPJ蛋白质含量。
1.2.2.6 总酚含量测定 采用Folin-Ciocalteau法[26-28]绘制总酚标准曲线,回归线性方程为y=8.6886x+0.0046,R2=0.9996,其中y代表765 nm下的吸光值A,x代表没食子酸标准溶液浓度(mg/mL)。
样品测定:分别配制LPS与LPJ为0.1 mg/mL多糖溶液,平行三次测定吸光值,按照标准曲线回归方程计算LPS与LPJ的总酚含量。
1.2.3 不同提取方法所得多糖体外抗氧化活性测定 通过测定LPS与LPJ清除DPPH自由基的能力、清除羟基自由基的能力、清除超氧阴离子自由基的能力、清除ABTS阳离子自由基的能力及还原能力,评价LPS与LPJ体外抗氧化活性。
1.2.3.1 清除DPPH自由基能力的测定 用去离子水溶解LPS与LPJ,分别配制LPS与LPJ为不同浓度的多糖样品溶液(0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0 mg/mL);配制浓度为0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0 mg/mL的VC溶液。参照姜美云等[29-32]的方法,配制0.1 mmol/L DPPH-乙醇溶液,避光保存。将1 mL多糖样品与2 mL DPPH-乙醇溶液漩涡混合后避光30 min,使其充分反应。分光光度计用无水乙醇调零,测定波长517 nm下的吸光值。平行测定三次,取平均值。DPPH自由基清除率计算公式如下:
其中,A1指多糖样品与DPPH-乙醇混合溶液的吸光值;A2为多糖样品溶液与不含DPPH的无水乙醇混合液的吸光值;A0为去离子水替代样品溶液与DPPH-乙醇混合溶液的吸光值。VC溶液对DPPH自由基的清除同上,作为阳性对照。
1.2.3.2 清除羟基自由基能力的测定 配制不同浓度的多糖溶液及VC溶液参照1.2.3.1。参照Gong等[31-33]的方法,将1 mL的多糖溶液与1 mL FeSO4(6 mmol/L),1 mL H2O2(6 mmol/L)混合,37 ℃孵育10 min,再加入1 mL 水杨酸-乙醇溶液(6 mmol/L)混匀,37 ℃孵育30 min。用分光光度计在510 nm下测定吸光值。平行测定三次,取平均值。羟基自由基清除率计算公式如下:
其中,A1指样品与反应溶液混合的吸光值;A2为样品与去离子水(替代H2O2)混合的吸光值;A0为去离子水替代样品溶液与反应溶液混合的吸光值。VC溶液对羟基自由基的清除同上,作为阳性对照。
1.2.3.3 清除ABTS阳离子自由基能力的测定 配制不同浓度的多糖溶液及VC溶液参照1.2.3.1。参照Yu等[30,34]的方法,7 mmol/L ABTS溶液与2.45 mmol/L过硫酸铵混合避光氧化12 h。ABTS混合液用pH=7.4的PBS稀释至在734 nm波长下,吸光值为0.80±0.02。2 mL ABTS混合液与1 mL多糖样品混合,室温放置6 min,在734 nm波长下测吸光值。平行测定三次,取平均值。ABTS阳离子自由基清除率计算公式如下:
其中,A1指样品与反应溶液混合的吸光值;A2为样品与PBS(代替反应溶液)混合的吸光值;A0为去离子水(替代样品溶液)与反应溶液混合的吸光值。VC溶液对ABTS阳离子自由基的清除同上,作为阳性对照。
1.2.3.4 清除超氧阴离子自由基能力的测定 配制不同浓度的多糖溶液及VC溶液参照1.2.3.1。参照文献[30-32]方法,采用NADH-NBT-PMS体系测定黄皮疣柄牛肝菌多糖清除超氧阴离子自由基能力,1 mL多糖样品溶液与1 mL 557 μmol/L NaDH-Na、1 mL 45 μmol/L PMS、1 mL 108 μmol/L NBT混匀,于25 ℃下温浴5 min,以去离子水进行调零。在波长510 nm下测定吸光值。平行测定三次,取平均值。超氧阴离子自由基清除率计算公式如下:
其中,A1指样品与反应溶液混合的吸光值;A2为样品与去离子水(代替反应溶液)混合的吸光值;A0为去离子水(替代样品溶液)与反应溶液混合的吸光值。VC溶液对超氧阴离子自由基的清除同上,作为阳性对照。
1.2.3.5 还原力的测定 配制不同浓度的多糖溶液及VC溶液参照1.2.3.1。参照文献[30-31]方法,1 mL多糖液与2 mL 0.2 mol/L磷酸缓冲液(pH=6.6)、2 mL铁氰化钾(1%)混合,在50 ℃下孵育20 min,加入2.5 mL 10%的三氯乙酸,3000 r/min离心10 min,在上清液中加入2 mL去离子水、0.4 mL 0.1%的氯化铁溶液,在50 ℃下孵育10 min,在700 nm波长下测吸光值。平行测定三次,取平均值。

表1 LPS与LPJ的理化性质Table 1 Physical and chemical properties of LPS and LPJ
1.3 数据处理
每个样品设3个平行,所得结果以均数±标准差表示,采用GraphPad Prism 5作图软件和SPSS 19.0软件进行数据统计分析及绘图制作。
2 结果与分析
2.1 LPS与 LPJ
按照1.2.1的方法得到LPS与LPJ,如图1所示。LPS呈海绵状,颜色呈浅咖色;LPJ呈蓬松粉末状,颜色呈黄褐色。LPS在50 ℃热水中可溶解;LPJ在40 ℃热水中即可溶解,LPJ相比LPS溶解性能好。

图1 LPS与LPJFig.1 LPS and LPJ
2.2 LPS与LPJ得率及理化性质比较
如表1所示,LPS得率与LPJ得率相比差异显著(P<0.05),说明相比碱提法,水提法能提取更多的黄皮疣柄牛肝菌多糖。此外,LPS多糖含量、糖醛酸含量、硫酸根含量、总酚含量显著高于LPJ(P<0.05)。LPS与LPJ蛋白质含量差异不显著(P>0.05),说明LPS和LPJ在提取过程中均含有大量蛋白质。
2.3 LPS与LPJ体外抗氧化活性研究
2.3.1 DPPH自由基清除效果 VC、LPS、LPJ清除DPPH自由基的能力如图2所示,VC为阳性对照。LPS与LPJ均表现出一定清除DPPH自由基的能力,且表现出浓度依赖的特征。DPPH自由基清除率随着LPS与LPJ的浓度增大而逐渐增大。当多糖浓度在4 mg/mL时,LPS、LPJ对DPPH自由基清除率分别为87.55%±0.51%、54.31%±2.72%,均低于VC对DPPH自由基清除率:96.84%±0.13%。LPS与LPJ的IC50值分别为0.217 mg/mL与3.158 mg/mL,LPS清除DPPH自由基的能力高于LPJ。
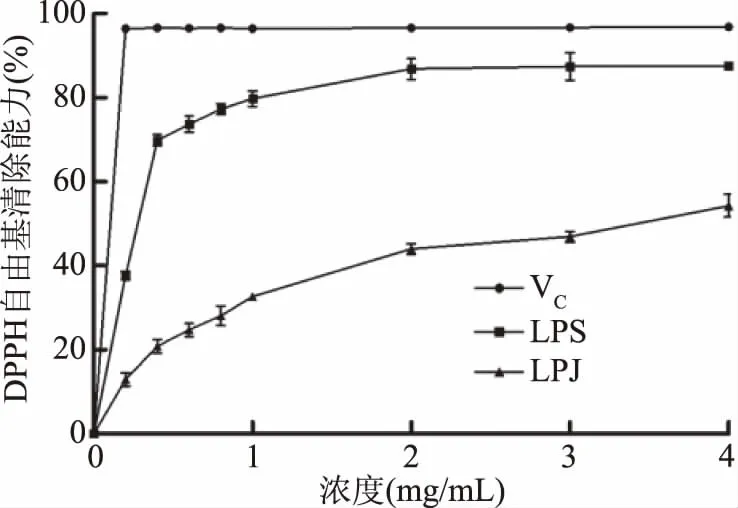
图2 VC和两种黄皮疣柄牛肝菌多糖的DPPH自由基清除能力Fig.2 DPPH radical scavenging activity of VC and the twopolysaccharides from Leccinellum crocipodium(Letellier.)Watliag
2.3.2 羟基自由基清除效果 VC、LPS、LPJ清除羟基自由基的能力如图3所示,VC为阳性对照。在0~4 mg/mL浓度范围内,随着多糖浓度的升高,多糖清除羟基自由基的能力逐渐增强。阳性对照组VC的IC50值为0.284 mg/mL,LPS的IC50值为2.327 mg/mL。LPJ浓度为4 mg/mL时,对羟基自由基清除率小于50%,因此LPJ在所测试范围内不能计算IC50值。当多糖浓度在4 mg/mL时,LPS、LPJ对羟基自由基清除率分别为54.53%±1.61%、46.50%±0.64%,均低于VC对羟基自由基清除率:98.71%±0.06%。LPS相比LPJ表现出较好的清除羟基自由基的能力。

图3 VC和两种黄皮疣柄牛肝菌多糖的羟基自由基清除能力Fig.3 Hydroxyl radical scavenging activity of VCand the twopolysaccharides from Leccinellum crocipodium(Letellier.)Watliag
2.3.3 ABTS阳离子自由基清除效果 VC、LPS、LPJ清除ABTS自由基的能力如图4所示,VC为阳性对照。LPS与LPJ在0~4 mg/mL浓度范围内,ABTS阳离子自由基清除率随着浓度的不断增加而增加,即ABTS阳离子自由基清除率与浓度呈依赖关系,LPS与LPJ的IC50值分别为0.413 mg/mL、1.081 mg/mL,均高于阳性对照组VC的0.074 mg/mL。当浓度为4 mg/mL时,LPS与LPJ对ABTS阳离子自由基清除率分别为81.56%±4.43%、68.79%±1.23%,均低于VC对ABTS阳离子自由基清除率。LPS与LPJ均具有一定的清除ABTS阳离子自由基的效果,且LPS优于LPJ。

图4 VC和两种黄皮疣柄牛肝菌多糖的ABTS阳离子自由基清除能力Fig.4 ABTS cationic radical scavenging activity ofVC and the two polysaccharides fromLeccinellum crocipodium(Letellier.)Watliag
2.3.4 超氧阴离子自由基清除效果 VC、LPS、LPJ清除超氧阴离子自由基的能力如图5所示,VC为阳性对照。LPS与LPJ在0~3 mg/mL浓度范围内,超氧阴离子自由基清除率随着浓度的不断增加而增加,当浓度为3 mg/mL时,LPS与LPJ对超氧阴离子自由基清除率分别为89.16%±2.42%、85.94%±2.98%,均低于VC对超氧阴离子自由基清除率:99.19%±0.11%。当多糖浓度大于3 mg/mL时,LPS与LPJ清除能力有所下降。LPS与LPJ的IC50值分别为0.119、0.214 mg/mL,均高于阳性对照组VC的0.001 mg/mL。LPS与LPJ清除超氧阴离子自由基的趋势相同,且在0~3 mg/mL浓度范围内,LPS清除能力略高于LPJ。

图5 VC和两种黄皮疣柄牛肝菌多糖的超氧阴离子自由基清除能力Fig.5 Superoxide anion radical scavenging activity ofVC and the two polysaccharides fromLeccinellum crocipodium(Letellier.)Watliag
2.3.5 还原力测定 吸光值大小反映还原力高低,吸光值越大还原力越强。如图6所示,LPS与LPJ还原力随着浓度的不断增加而增大,即还原力与浓度呈依赖关系。当LPS和LPJ浓度为4 mg/mL时,还原力吸光度值分别为1.41±0.02、1.16±0.01,LPS还原力与VC还原力1.41±0.003相当,LPJ还原力低于VC。这与LPS与LPJ的DPPH自由基、羟基自由基、超氧阴离子自由基、ABTS阳离子自由基清除效果一致。
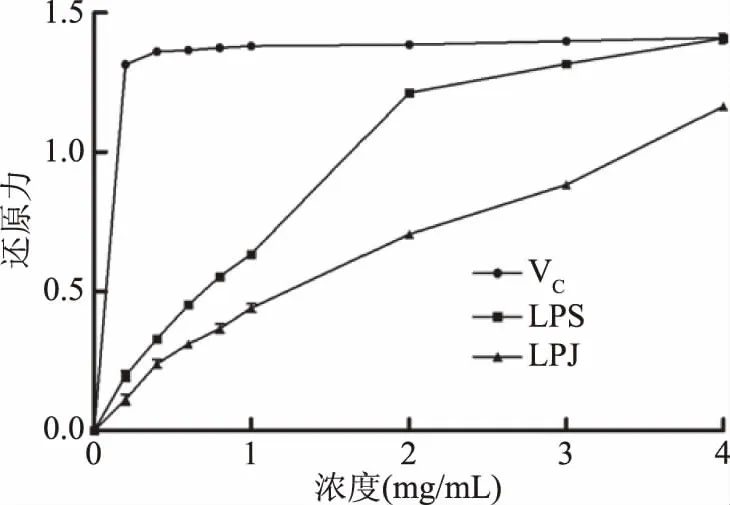
图6 VC和两种黄皮疣柄牛肝菌多糖的还原能力Fig.6 Reducing power of VCand the two polysaccharides fromLeccinellum crocipodium(Letellier.)Watliag
根据上述抗氧化指标分析可知,LPS相比LPJ抗氧化性较强,但均弱于阳性对照组VC。这可能是因为两种提取方式多糖含量,糖醛酸含量与硫酸根含量存在差异所致,据文献报道,多糖糖醛酸含量与自由基清除呈正相关[35];茶叶多糖中糖醛酸含量越高,抗氧化能力越强[36]。多糖中硫酸根的含量与其生物活性密切相关[37],而本实验研究发现LPS多糖含量、糖醛酸与硫酸根含量均高于LPJ,因此,LPS的抗氧化活性优于LPJ。
3 结论
LPS与LPJ得率分别为18.44%±1.30%与5.50%±0.69%,LPS得率明显高于LPJ。对LPS与LPJ理化性质进行研究,对比分析得出LPS多糖含量,糖醛酸含量,硫酸根含量均高于LPJ。LPS与LPJ抗氧化活性均随着浓度的增加而逐渐增强,结合DPPH自由基、羟基自由基、ABTS阳离子自由基和超氧阴离子自由基清除率、IC50值以及还原力吸光度大小比较分析可知,LPS与LPJ均具有一定的抗氧化活性,且LPS强于LPJ。黄皮疣柄牛肝菌多糖有望开发为新的天然抗氧化剂。

