MCP-1参与缬沙坦对阿霉素心脏毒性的预保护作用
胡丹,肖何柳 ,于勤
阿霉素(doxorubicin,Dox)属于蒽环类药物,是治疗乳腺癌、消化道肿瘤广谱、有效的一线化疗用药,但存在心脏毒性。研究表明Dox 累积剂量达400 mg/m2时,心力衰竭的发生率约5%,而累积剂量达550 mg/m2时,心力衰竭发生率高达17%[1]。其机制主要是由于蒽环类药物螯合铁离子后引起过氧化氢(H2O2)及超氧阴离子(O2-)的形成,导致心肌细胞膜脂质的过氧化,引起心肌损伤[2]。有研究发现AT1受 体 阻 滞 剂(angiotensin Ⅱ receptor antagonists,ARBs)缬沙坦对蒽环类药物的心脏毒性具有潜在的保 护 作用[3]。单核 细 胞趋化蛋 白 -1(monocyte chemoattractant protein-1,MCP-1)在心血管疾病的发生与发展过程中发挥着重要作用,但相关信号通路在其中的作用不清楚。基于此,本研究通过阿霉素诱导建立SD大鼠心肌损伤模型,探讨阿霉素诱导心肌损伤的免疫与细胞因子影响机制,观察免疫失调是否参与阿霉素诱导的心肌损伤,并为下一步的预防与干预提供依据。
1 材料与方法
1.1 材料 8 周龄雄性SPF 级 SD 大鼠30 只,体质量(180.2±10.3)g,购自大连医科大学SPF 级实验动物中心。动物饲养于大连大学附属中山医院层流级动物实验中心(室温21~25 ℃,湿度45%~55%),给予光照14 h,黑夜10 h,固体颗粒饲料喂养。阿霉素(浙江海正药业股份有限公司),以生理盐水配制成终浓度为2 g/L的注射液;缬沙坦胶囊(北京诺华制药有限公司),以生理盐水配制成终浓度为10 g/L;氯胺酮(江苏恒瑞医药股份有限公司);5%硫化钠溶液(成都科龙化工有限公司);2.5%戊二醛溶液、1%锷酸溶液(上海生工生物工程股份有限公司);MCP-1、调节激活正常T细胞表达和分泌因子(RANTES)、次级淋巴组织趋化因子(6Ckine)蛋白芯片检测试剂盒(美国R&D公司);MCP-1抗体、辣根过氧化物酶(HRP)标记二抗(英国Abcam 公司)。彩色超声诊断仪(GE LOGIQ P6)、超声探头(GE 11L)、台式低温高速离心机(德国Heraeus Biofuge Stratos);37 ℃恒温箱、透射电镜(日本JEDL公司),蛋白电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 实验动物分组及处理 30 只大鼠编号后按照随机数字表法分为3 组,对照组(Con 组)、阿霉素组(Dox 组)和缬沙坦+阿霉素组(Val+Dox 组),每组10 只。Dox 组以1.25 mL/kg体质量腹腔注射阿霉素,1 次/周,连续6 周,生理盐水(2 mL/kg体质量)每天灌胃1次;Val+Dox组:在Dox组给药基础上给予缬沙坦溶液(2 mL/kg 体质量)灌胃,每周均根据体质量重新调整药物;Con组均以生理盐水灌胃和腹腔注射,给药剂量同前。本实验方案经过大连大学附属中山医院伦理委员会讨论通过(批准号:20180926)。
1.2.2 超声心动图检测心功能变化 观察至第10周,氯胺酮(100 mg/kg)腹腔注射麻醉,5%硫化钠溶液脱毛,固定大鼠。采用GE LOGIQ P6 彩色超声仪(12.0 MHz 高频探头)选择胸骨左缘左室长轴切面M 型超声,测量左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)、左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)及左心室射血分数(left ventricular ejection fraction,LVEF),连续测定4个心动周期,取平均值。
1.2.3 蛋白芯片技术检测MCP-1、RANTES 及6Ckine 表达 采集3组大鼠下腔静脉血2 mL,1 000 r/min离心10 min,分离血清后利用蛋白芯片技术检测MCP-1、RANTES、6Ckine。从-80 ℃冰箱取出芯片,在室温下静置3 h 后编号。每个检测单元取50~200 μL血清样品,用2倍体积的U9缓冲液稀释后上样;4 ℃孵育过夜后清洗液洗膜3次;加入芯片二抗室温避光孵育60 min;清洗液清洗和干燥后,每孔加入1 mL 显色剂后化学发光成像。成像后将对应GAL 文件打开,使芯片图像与GAL文件的每个阵列对齐后读取并保存数据。
1.2.4 电镜下观察心肌组织病理变化 第10周处死大鼠后,取心脏,PBS 溶液冲洗3 遍,滤纸吸干称质量,留取大鼠左心室中段心肌组织,切成约1 mm×1 mm×1 mm 组织块,以2.5%戊二醛溶液固定,置于4 ℃冰箱保存1周,送电镜室检测。左心室心尖及心房组织放入-80 ℃冰箱保存,用于Western blot检测。
1.2.5 Western blot 检测MCP-1 蛋白表达 取适量心肌组织,研磨后加入裂解液制匀浆,置于冰上30 min,将匀浆移至离心管中,4 ℃、12 000 r/min 离心10 min,取上清。BCA 法蛋白定量后利用5%浓缩胶和15%分离胶进行SDS-PAGE电泳(每孔上样35 μg蛋白)。电泳结束后恒流150 mA×45 min将目的蛋白转移至PVDF 膜上。5%脱脂奶粉室温封闭1.5 h,加入MCP-1 一抗(1∶1 000)孵育1.5 h,洗膜后再加入稀释的二抗(1∶3 000)室温1 h后染色,用相同方法检测内参GAPDH蛋白表达,以MCP-1/GAPDH作为目的蛋白的相对表达量。
1.3 统计学方法 应用SPSS 20.0 进行统计分析,符合正态分布的计量资料使用均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠心功能变化 与Con组相比,Dox组和Val+Dox 组 LVEF、LVFS 明显降低,LVESD、LVEDD明显升高(P<0.05)。与 Dox 组相比,Val+Dox 组LVEF、LVFS明显升高,LVESD、LVEDD明显降低,差异有统计学意义(P<0.05)。见图1、表1。
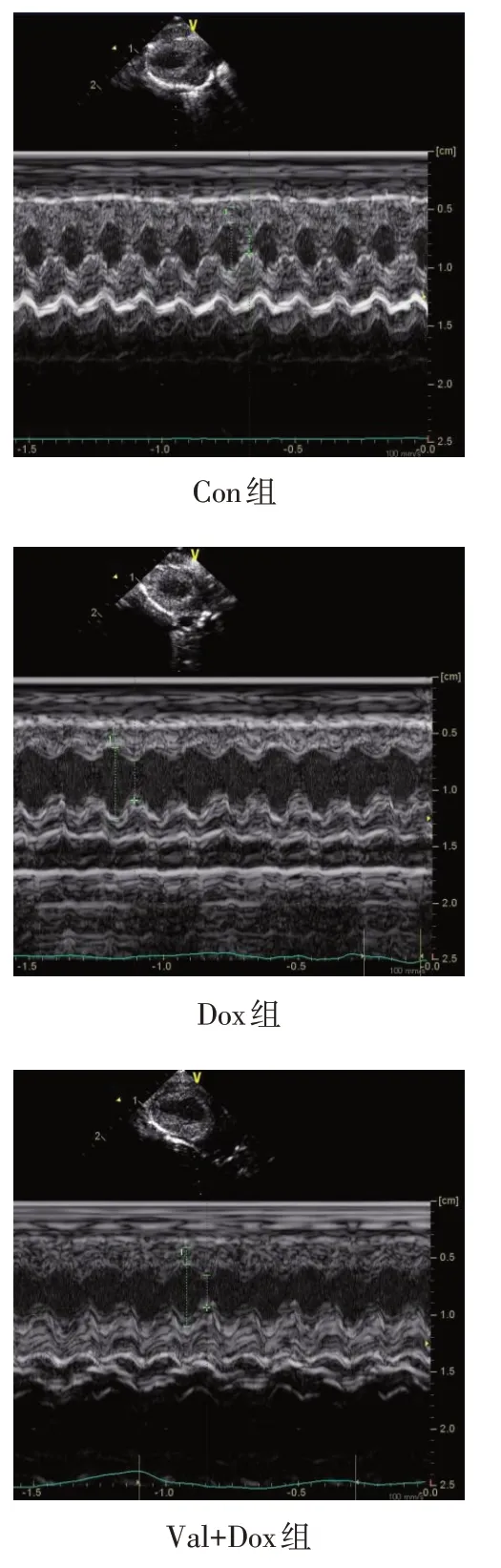
Fig.1 Heart echocardiography in three groups of rats图1 3组大鼠心脏超声心动图
Tab.1 Comparison of the echocardiographic measurements between three groups of rats表1 3组大鼠心功能指标比较 (n=10,)
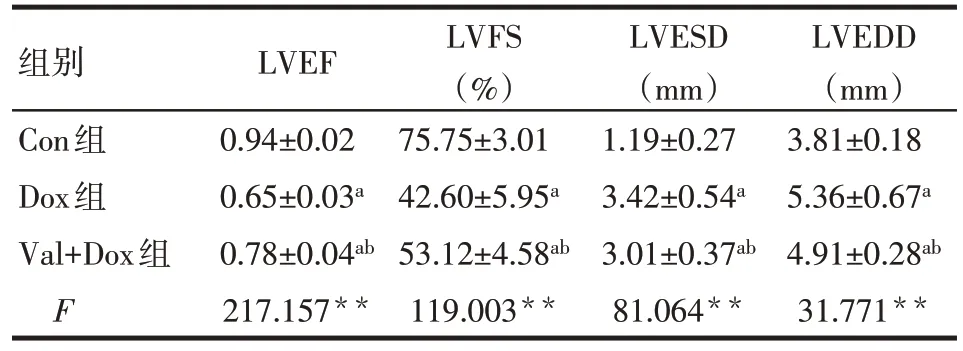
Tab.1 Comparison of the echocardiographic measurements between three groups of rats表1 3组大鼠心功能指标比较 (n=10,)
**P<0.01;a与Con组比较,b与Dox比较,P<0.05;表2同
组别Con组Dox组Val+Dox组F LVEF 0.94±0.02 0.65±0.03a 0.78±0.04ab 217.157**LVFS(%)75.75±3.01 42.60±5.95a 53.12±4.58ab 119.003**LVESD(mm)1.19±0.27 3.42±0.54a 3.01±0.37ab 81.064**LVEDD(mm)3.81±0.18 5.36±0.67a 4.91±0.28ab 31.771**
2.2 3 组大鼠血清 MCP-1、RANTES 和 6Ckine 变化 与 Con 组相比,Dox 组 MCP-1、RANTES 表达升高(P<0.05),分别上调约1.87倍、1.40倍和1.26倍;与 Dox 组相比,Val+Dox 组 MCP-1、RANTES、6Ckine表达显著下降(P<0.05),见表2。
Tab.2 Comparison of the MCP-1,RANTES and 6Ckine expression levels between the three groups表2 3组MCP-1、RANTES和6Ckine表达水平比较(n=10,)
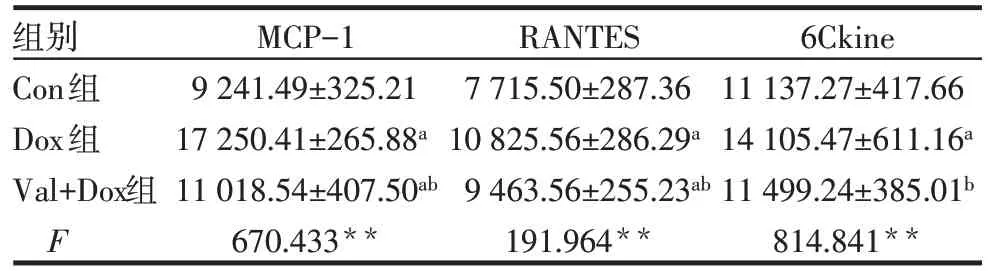
Tab.2 Comparison of the MCP-1,RANTES and 6Ckine expression levels between the three groups表2 3组MCP-1、RANTES和6Ckine表达水平比较(n=10,)
组别Con组Dox组Val+Dox组F MCP-1 9 241.49±325.21 17 250.41±265.88a 11 018.54±407.50ab 670.433**RANTES 7 715.50±287.36 10 825.56±286.29a 9 463.56±255.23ab 191.964**6Ckine 11 137.27±417.66 14 105.47±611.16a 11 499.24±385.01b 814.841**
2.3 3 组大鼠心肌超微结构变化 透射电镜下Con组大鼠心肌中未见自噬体,心肌细胞结构清晰,线粒体基质致密,无水肿;肌原纤维排列整齐均匀,肌节结构完整。Dox组大鼠心肌可见较丰富的呈现双层膜的自噬小体(黑色箭头示),心肌结构模糊,心肌纤维溶解,线粒体丰富但结构显示不清。Val+Dox 组大鼠心肌组织中的自噬小体减少,肌原纤维结构模糊不清,排列紊乱,与Con 组相比线粒体体积增大、增多,大小不等,但结构完整。见图2。
2.4 3 组大鼠心肌MCP-1 表达变化 与Con 组相比,Dox组MCP-1蛋白表达升高(P<0.05);与Dox组相比,Val+Dox 组MCP-1 蛋白表达降低(P<0.05)。见图3。
3 讨论

Fig.2 Ultrastructure findings of myocardial tissues in three groups of rats(×15 000)图2 3组大鼠电镜下心肌组织超微结构变化(×15 000)
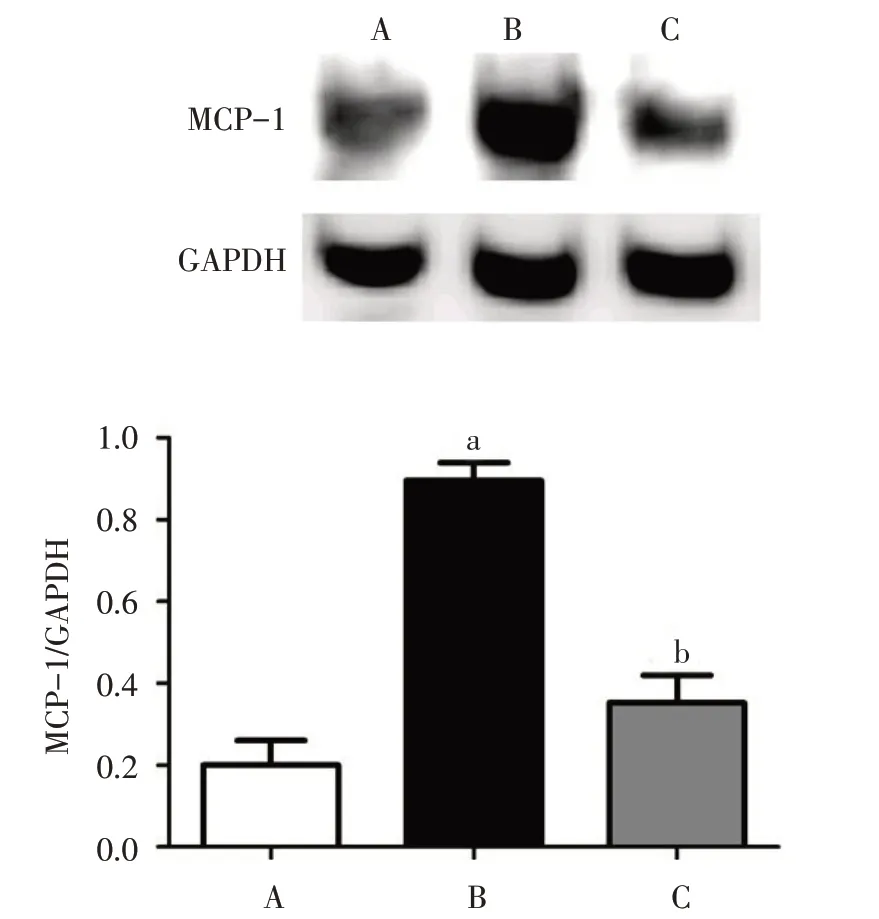
Fig.3 MCP-1 protein expressions in cardiac myocytes of the three groups detected by Western blot assay图3 Western blot检测3组心肌细胞MCP-1蛋白表达
Dox 作为临床上治疗恶性肿瘤的一线化疗药物和基础药物,因其严重的心脏不良反应而应用受限[3-5]。临床上常规化疗剂量可导致不可逆的心肌损害,心血管并发症也是目前癌症患者死亡的主要原因[6-7]。本课题组前期研究发现ARBs对蒽环类药物化疗导致的心脏毒性具有潜在保护作用,可以逆转心室和血管壁重构,促进心脏功能恢复,保护心肌细胞[8]。本研究中超声心动图检查显示Dox 组LVEF 及 LVFS 较 Con 组 均 显 著 降 低 ,LVEDD 及LVESD 均较 Con 组显著升高,提示 Dox 处理后 SD 大鼠左室收缩功能下降,结合相应电镜下的心肌改变,表明大鼠心力衰竭模型造模成功。Dox诱导的心肌损伤类似扩张型心肌病,导致收缩功能减退。而预防性应用缬沙坦后LVEF、LVFS较Dox组增大,LVEDD及LVESD 较Dox 组减小,表明预防性缬沙坦干预可有效减轻左心室收缩功能减退及病理性心室重塑。
心血管疾病的发生与发展过程中,炎性因子的参与发挥了重要的作用。MCP-1 属于CC 亚族类炎症趋化因子家族中的主要成员,其在人体多种组织细胞中均有表达。MCP-1 可减少并延迟巨噬细胞浸润,减少细胞因子的产生,减轻心脏重塑。有证据表明,MCP-1的短期表达可能有益于心脏功能的恢复[9]。在体外实验中,MCP-1 可保护新生小鼠心肌细胞免受缺氧诱导的凋亡[10];相反,过表达MCP-1的转基因小鼠慢性炎症可引起MCP-1 的持续高表达。随着模型动物的衰老,MCP-1升高水平更加明显,左室质量和心室功能障碍加重[11]。上述实验结果表明,MCP-1 在低剂量,短时间干预情况下可以在心脏修复中表现出保护性,但这种保护作用可能是由于MCP-1 诱导了保护性内质网(ER)应激伴侣的产生[12],长期暴露于 MCP-1 引起的持续 ER 应激下,保护作用会减弱,导致心血管疾病的发生。本研究发现Dox 诱导的大鼠血清中MCP-1 蛋白显著升高,大于蛋白组学公认的1.5 倍表达差异标准值[13],而RANTES、6Ckine 未达1.5倍标准值。进一步检测心肌中MCP-1 蛋白表达发现与血清检测结果一致,提示MCP-1 广泛参与了Dox 诱导大鼠的心肌毒性。本实验中,Val+Dox 组 MCP-1 表达较 Dox 组显著减少。笔者前期研究发现Dox 可使大鼠体内血管紧张素(Ang)Ⅱ显著增加[14]。此外,体内、外实验显示,AngⅡ可诱导MCP-1 表达增加[15]。由于缬沙坦能选择性作用于心脏AT1受体,使AngⅡ表达减少,笔者推测缬沙坦可能通过抑制Dox 诱导的AngⅡ升高所引起的MCP-1 表达增加,进而减轻Dox的心脏毒性。
综上所示,本研究从心脏超声结构、心肌超微结构和MCP-1的表达变化等方面观察了Dox诱导心肌损伤的病理生理改变。缬沙坦可以减少心肌MCP-1 炎性因子的表达,从而预防性保护阿霉素所致心肌损伤,提示免疫失调可能参与阿霉素心肌毒性作用,本研究进一步为缬沙坦减轻阿霉素心肌损伤提供了潜在机制和解释。

