基于转录组测序的EV71感染RD细胞的基因表达变化研究
程凯,曹丽,张鑫艳,郝晋芳,张晓延
肠道病毒71 型(enterovirus 71,EV71)是一种单股正链小RNA 病毒,5 岁以下儿童感染后可以出现手足口病(hand-foot-mouth disease,HFMD)[1]。该病症状主要有发热、手足口疱疹,少数患儿会出现中枢神经系统症状,如脑膜炎、脑炎、急性弛缓性肌无力、脊髓灰质炎、肺水肿等临床表现,甚至出现死亡[2]。HFMD 通常在每年夏季发生,且近些年冬春季发病率也明显上升,2008 年被列为国家法定传染病[3]。目前国内外学者从细胞凋亡[4]、自噬[5]、焦亡[6]等方面对EV71诱发HFMD的分子机制进行了研究,但确切致病机制尚不明确。本课题组前期研究已经证实EV71 可以引起人横纹肌肉瘤(rhabdomyosarcoma,RD)细胞和人胃黏膜上皮细胞系GES-1发生自噬和凋亡[5,7],但是这些变化的发生时间及影响因素尚缺乏明显的证据。本实验拟探究EV71 感染细胞后自噬和免疫应答相关基因表达发生改变的时间和具体靶点,以期为HFMD的治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞株和病毒株 RD 细胞株购于中国科学院细胞库,EV71 型病毒株由北京协和医学院病原生物学研究所赵振东教授课题组惠赠。
1.1.2 试剂及仪器 DMEM高糖培养基、胰酶、胎牛血清、二喹啉甲酸(BCA)试剂盒购自武汉博士德生物工程有限公司,兔源一抗微管相关蛋白1 轻链3(LC-3)、自噬相关基因5(Atg5)、病毒衣壳蛋白1(VP-1)购自CST公司,鼠源一抗雷帕霉素不敏感的mTOR伴侣蛋白(Rictor)购自GeneTex公司,兔源一抗β-actin 购自沈阳万类生物科技有限公司,辣根过氧化物酶(HRP)标记的山羊抗鼠和山羊抗兔二抗、十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAG)配制试剂盒购自上海碧云天生物技术有限公司,总RNA 提取试剂(TRIzol)购自Invitrogen公司,其他试剂均选自国内公司的分析纯。3111型CO2恒温培养箱购自美国Thermo Fisher 公司,Eon 微孔板酶标仪购自美国BioTek 公司,DMI3000B 倒置荧光显微镜购自德国Leica 公司,垂直电泳仪、电转仪、Universal Hood Ⅲ凝胶成像系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 RD 细胞培养于DMEM 高糖培养基(含10%胎牛血清,100 mg/L 链霉素和100 U/mL 青霉素)中,37 ℃、5%CO2饱和湿度的培养箱中,每2 d 细胞换液1 次,长满培养皿后传代。
1.2.2 病毒扩增 RD细胞培养至汇合度约90%,提前1 h换液,-80 ℃冰箱取出EV71病毒液,按1∶5加入细胞培养液中,十字混匀,37 ℃、5%CO2培养箱培养24 h。倒置显微镜下观察染毒细胞全部死亡后,收集上清于15 mL 离心管,4 ℃、4 000 r/min离心10 min,上清分装标记并冻存于-80 ℃冰箱。
1.2.3 病毒滴度测定 取生长状态良好的RD细胞,计数,接种至 96 孔板,每孔100 μL,含 5 000 个细胞。按10 倍倍比稀释病毒,每个浓度加1列,共11列,第12列加等量培养基作阴性对照。培养48 h后标记50%以上细胞致死的孔,按公式计算半数组织培养感染剂量(50%tissue culture infective dose,TCID50),按照卡波公式计算并换算感染复数(multiplicity of infection,MOI)。
1.2.4 不同时间和剂量病毒对细胞的作用 RD细胞接种至6 孔板,按 MOI=10、MOI=1、MOI=0.1 给各孔加病毒液,培养12 h 后收集细胞,提取总蛋白。通过蛋白免疫印迹(Western blot)技术观察VP-1 的表达量,并分析筛选合适的MOI。根据筛选结果以MOI=1 感染细胞,选择0、0.5、1、1.5、3、6、9、12 h共8组,倒置显微镜观察细胞形态和数量变化。
1.2.5 Western blot检测蛋白表达 收集各组细胞,加入含苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的蛋白裂解液,冰上裂解30 min,12 000 r/min离心15 min,BCA试剂盒测总蛋白质浓度。SDS-PAGE分离蛋白约2 h,转硝酸纤维素(NC)膜1 h,5%脱脂奶粉封闭2 h,一抗孵育4 ℃过夜。次日清洗3 次,用HRP 标记的二抗孵育2 h,加底物显色,凝胶成像系统扫描并分析结果。
1.2.6 总mRNA提取及测序 同1.2.4处理并收集细胞,分别加TRIzol,吹打均匀,经干冰运输至华大基因公司武汉公司进行转录组测序。提取出的RNA 经检测合格后,反转录成cDNA。末端连接接头,进行PCR 扩增,产物热变性成单链,建立单链环状DNA文库,CG测序仪测序。
1.2.7 高内涵细胞成像检测相关蛋白表达 提前1 d细胞换液并计数,将RD 细胞接种至96 孔板,每组设3 个复孔,按照MOI=1 选择不同时间进行干预。干预后吸净培养基,4%多聚甲醛固定30 min,磷酸盐缓冲液(PBS)清洗后用0.5%Triton-X100室温通透20 min,山羊血清封闭30 min。根据测序结果各孔按1∶5 000浓度比加适量Atg5、Rictor抗体,4 ℃过夜。次日PBS清洗后加荧光二抗,室温避光孵育1 h,4′,6-二脒基-2-苯基吲哚(DAPI)复染细胞核10 min,PBS 清洗后上机检测。
1.3 统计学方法 测序数据运用GO、KEGG 等软件进行分析,其他数据采用SPSS 22.0 软件进行分析。计量资料用均数±标准差()表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 EV71 感染对RD 细胞形态和功能变化的影响 倒置显微镜明场观察可见,培养中的RD细胞在接触EV71后0.5 h即可出现明显的空斑,3 h细胞由梭形贴壁生长逐渐变为圆形悬浮,与0 h组相比细胞数量明显减少(F=193.330,P<0.05)。9 h 圆形细胞约占总数的50%,12 h约占70%,提示病毒已经开始大量繁殖和释放,细胞死亡;而正常培养细胞生长状态良好,仍然维持梭形贴壁生长。见图1。
2.2 不同剂量和时间EV71 感染RD 细胞对蛋白表达的影响 EV71 感染RD 细胞12 h 后,病毒已经在细胞内有所复制,VP-1 表达量随MOI 增加而升高(F=7.133,P<0.05),见图2A、B。MOI=1 时已经可以看到明显的VP-1 条带,因此后续实验全部选择MOI=1进行细胞感染。在MOI=1时病毒感染后6 h、9 h、12 h,病毒在RD 细胞内已经开始表达VP-1,细胞内已经合成新的病毒,但3个时点间VP-1的表达量差异无统计学意义(F=0.201,P>0.05),见图2C、D;而细胞自噬相关蛋白LC-3Ⅱ/LC-3Ⅰ的变化出现在感染后9 h,高于0 h 组(F=12.005,P<0.01),见图2E、F。
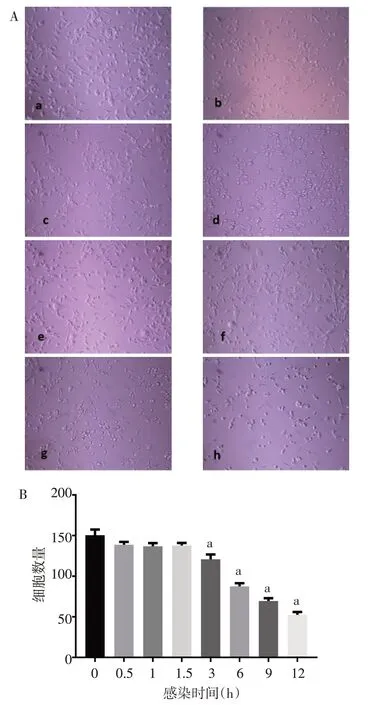
Fig.1 Morphological and quantitative changes of RD cells infected with EV71 at different time points图1 不同时间EV71感染RD细胞形态和数量变化
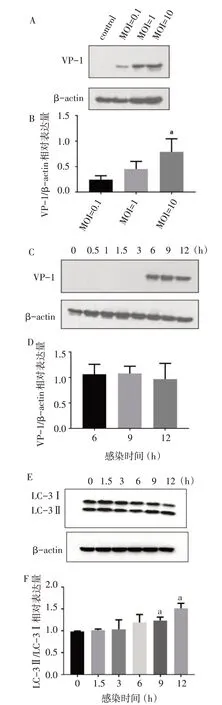
Fig.2 Effects of different doses and time points of EV71 on protein expression in RD cells图2 不同剂量和时间EV71对RD细胞蛋白表达的影响
2.3 EV71 感染RD 细胞对基因表达的影响 转录组测序结果显示,EV71 感染RD 细胞后0.5 h,细胞内上调基因294 个,下调基因34 个(图3A),感染后1 h 上调基因 29 个,下调基因 52 个(图 3B),1.5 h 上调基因707 个,下调基因 72 个(图 3C)。基因表达变化峰值出现在感染后3 h(图3D),上调基因1 199 个,下调基因126 个。在感染后6 h、9 h、12 h 基因表达变化略有下降,分别上调基因403、747、758 个,下调基因472、184、169 个(图3E~G)。感染病毒0.5 h 后已经有病毒侵入细胞,而3 h 病毒已经开始通过影响细胞基因表达而启动病毒复制。
2.4 EV71 感染RD 细胞对信号通路分子的影响 通过GO 富集和KEGG 信号通路分析发现,在EV71 感染RD 细胞3 h,细胞信号通路基因有216个发生变化(绿色),其中100 多个信号分子均参与细胞的自噬或凋亡。在组织系统相关基因中,内分泌系统、免疫系统和神经系统基因表达上调也比较明显(黄色),这与临床上常见的症状相吻合。见图4。
2.5 EV71 感染RD 细胞对自噬蛋白的影响 高内涵细胞成像结果显示,RD细胞在感染后细胞数量明显减少,病毒感染引起细胞产生病变和死亡。但细胞内平均荧光强度明显增加,随着病毒进入细胞,引起细胞内自噬蛋白Atg5(F=3.719,P<0.05)、Rictor(F=3.588,P<0.05)表达上调,见图5。
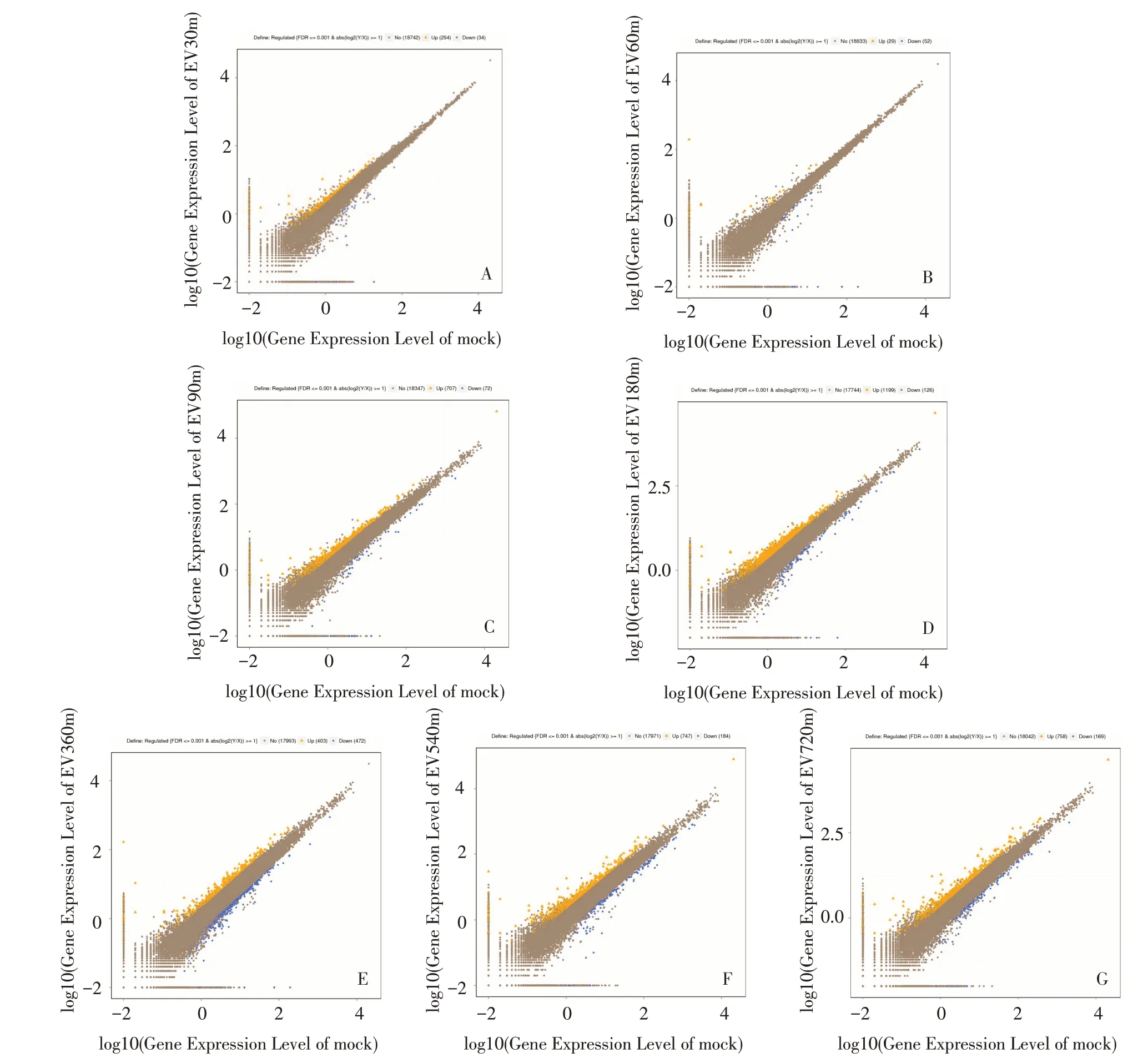
Fig.3 Gene expression changes at different time points of virus intervention图3 病毒干预不同时间点的基因表达变化
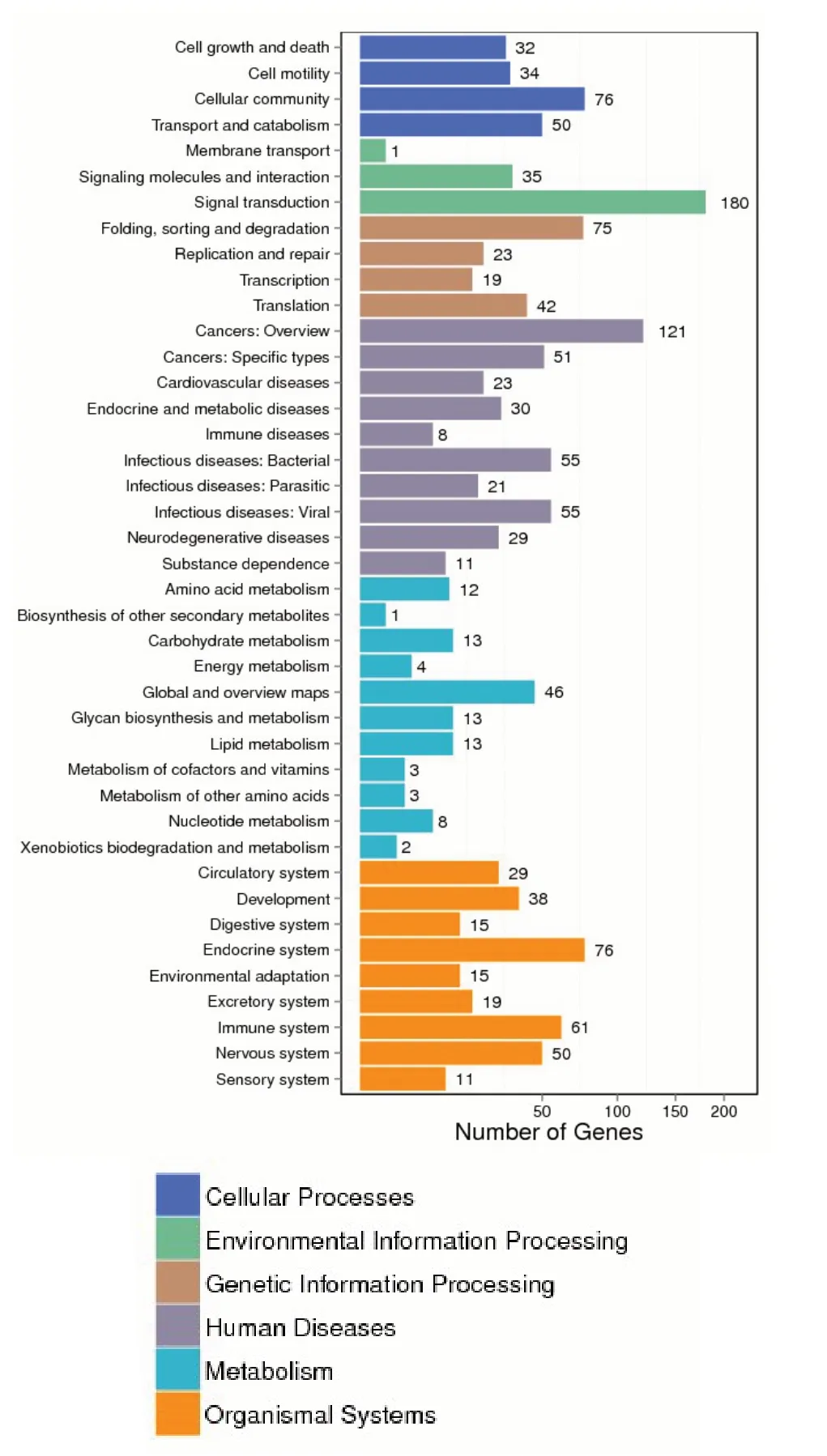
Fig.4 The GO enrichment and KEGG pathway analysis of differential expressed genes of RD cells 3 h after infection with EV71图4 GO富集和KEGG信号通路分析EV71感染RD细胞3 h后基因差异表达
3 讨论
3.1 EV71感染RD细胞6 h即出现病毒复制 结果显示,RD细胞在感染EV71后0.5 h即可见细胞状态变差,空斑形成增多;3 h细胞数量明显下降,说明此时病毒开始在细胞内完成RNA 复制,蛋白质合成、包装和释放。Western blot 结果显示,细胞在病毒感染后6 h才能翻译出结构蛋白VP-1。病毒感染细胞后病毒RNA释放进入被感染细胞、RNA复制负链互补RNA、翻译多聚蛋白质、剪切成4 个结构蛋白(VP1~4)和7 个非结构蛋白(2A、2B、2C、3A、3B、3C和3D)[8-9],包装病毒颗粒并释放。在此过程中,宿主细胞可以通过抑制自噬来增强病毒的复制[3],但是也可能是通过增强自噬实现对宿主细胞的免疫逃逸[5]。
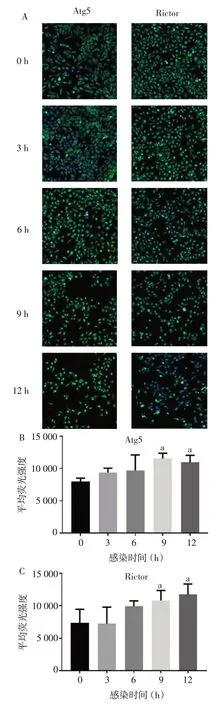
Fig.5 High content screening showed protein expression after virus infection图5 高内涵成像显示病毒感染后蛋白表达情况
3.2 EV71 感染RD 细胞3 h 出现信号通路分子变化 转录组测序结果显示,病毒感染后基因表达变化的峰值出现在3 h,上调基因1 199个,说明该时点是病毒复制和包装的关键点。上调的基因中信号转导相关216 个,其中大多数与自噬和凋亡有关。Shi等[10]证明EV71 通过引起宿主细胞发生凋亡进而引起病毒的释放。Yeganeh 等[11]认为 EV71 通过增强宿主细胞的自噬而引起免疫逃逸。为了明确自噬信号通路与病毒复制的关系,本研究进一步分析转录组测序数据。
3.3 EV71 感染RD 细胞通过自噬信号分子产生免疫应答 KEGG 信号通路富集分析显示,在病毒感染后3 h,与自噬相关的多个信号分子被激活,高内涵细胞成像结果也证实在感染后9 h 自噬蛋白Atg5和mTOR 伴侣蛋白Rictor 的表达上升。mTOR 通路是经典的自噬信号通路,与细胞内代谢调控相关,主要受胰岛素的激活,对机体能量代谢有重要的调节作用[12]。抑制mTOR 信号通路可以增强细胞自噬,是一种饥饿状态下细胞调节能量代谢的重要方式,病毒诱导的细胞自噬同时也可以引起mTOR通路的激活[13]。EV71在进入RD细胞后激活mTOR信号分子,增强细胞自噬,有助于细胞清除病毒,但病毒也可能通过激活细胞自噬产生对机体的免疫逃逸作用,有利于病毒在细胞内的复制与释放。
综上所述,EV71 感染后3 h 激活宿主细胞自噬信号通路,6 h 病毒衣壳蛋白合成,开始组装新的病毒,12 h宿主细胞自噬达峰值,新病毒释放。这种病毒感染过程与细胞自噬有可能是病毒免疫逃逸的一种机制,笔者会持续关注EV71感染后细胞自噬分子时间和空间的变化,以期发现EV71感染细胞后引起免疫应答的确切机制。

