η-Al2O3与-Al2O3在CS2催化水解反应中的性能比较
冯 昊,李金金,常宏岗,肖植煌,刘思琴,李 平*
(1.华东理工大学化学工程联合国家重点实验室,上海 200237; 2.中国石油天然气股份有限公司西南油气田公司天然气研究院,四川 成都 610213;3.国家能源高含硫气藏开采研发中心,四川 成都 610051)
二硫化碳(CS2)普遍存在于水煤气、焦炉气、炼厂气以及天然气等化学工业生产过程中[1-2]。CS2的存在不但会导致下游金属催化剂失活[3-5],其排放还会造成环境污染,危害人类健康。工业上脱除CS2最有效的方法是催化水解[3-9]。CS2水解催化剂主要有TiO2、Al2O3、ZnO和ZrO2等氧化物[6-9],以及活性炭负载型催化剂等[10]。Aboulaytd A等[9]研究发现,四种氧化物催化剂活性依次为ZrO2>Al2O3>TiO2>ZnO。常规Al2O3廉价易得、比表面积高,同时具有较好的催化活性,因此在工业CS2水解过程中得到广泛应用[3-9,11]。
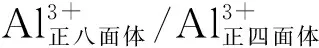
本文旨在对比η-Al2O3和γ-Al2O3在CS2催化水解反应中的性能差异,通过分析两者的形貌、比表面积以及表面酸碱性等特质,揭示影响不同Al2O3材料对CS2水解催化作用的关键因素。
1 实验部分
1.1 催化剂制备
η-Al2O3前驱体湃铝石的制备:取一定量的 Al2(SO4)3·18H2O配制成不同浓度的溶液,以5.0 mL·min-1速率向Al2(SO4)3溶液中滴加氨水,至溶液终点pH值为一定值时停止,滴加过程中持续搅拌并控制温度为30 ℃,沉淀产物在原溶液中老化一定时间,随后离心分离沉淀并用去离子水多次洗涤,再于110 ℃下干燥12 h,冷却取出后研磨得到湃铝石,标记为B-x-y-z,其中B表示湃铝石,x表示终点pH值,y表示铝离子浓度,z表示老化时间。
γ-Al2O3前驱体勃姆石的制备:取一定量的 Al2(SO4)3·18H2O和NaAlO2分别配成57 g·L-1Al2(SO4)3溶液和64 g·L-1NaAlO2溶液,各自以1.0 mL·min-1和1.2 mL·min-1速率同时滴加到烧杯中形成沉淀,过程温度为65 ℃、pH=8.0,沉淀产物于原溶液中老化1 h后过滤,用去离子水及乙醇交替洗涤,滤饼于200 ℃下干燥12 h后得到勃姆石。
η-Al2O3和γ-Al2O3的制备:分别将得到的湃铝石和勃姆石以1 ℃·min-1速率从室温升至500 ℃,焙烧6 h后自然降至室温即得。
1.2 样品表征
采用Rigaku D/max2550VB/PC型X射线衍射仪分析样品的晶体结构,CuKα,λ=0.154 32 nm,工作电压40 kV,工作电流100 mA,扫描范围2θ=10° ~ 80°(部分样品至90°),扫描速率2°·min-1,再将样品的衍射结果与JCPDS标准卡片对比。
采用美国Micromeritics 公司ASAP2020型全自动物理吸附仪对样品比表面积、孔径分布进行分析。样品经200 ℃脱气8 h,于-196 ℃液氮环境下进行N2的等温吸附和脱附测试,采用BET方程计算比表面积,用BJH方法计算孔径分布。
采用美国FEI公司Nova NanoSEM 450型场发射扫描电子显微镜分析样品形貌,电镜分辨率为1.8 nm@3kV。
采用自制吸附仪对样品进行NH3-TPD和CO2-TPD测试,分析其表面酸、碱位特性。样品经Ar气吹扫后在室温下吸附NH3或CO2,随后以10 ℃·min-1的速率升温至800 ℃,同时用热导检测器(TCD)检测记录脱附NH3或CO2的浓度信号,得到脱附曲线。
1.3 CS2水解反应
CS2水解反应在连续式固定床反应器上进行,反应压力为大气压,反应温度(200~450) ℃。CS2和H2O采用在一定温度下鼓泡的方式,由N2携带进入反应器床层,两种原料气的浓度由鼓泡器温度和N2流量调变,气时空速为(9 000~18 000) h-1。产物组成由气相色谱仪在线取样检测,采用PQ填充柱和TCD检测器,H2为载气,流量为 30 mL·min-1,分析时柱箱温度由90 ℃程序升温至200 ℃。样品气体出峰顺序为:N2(0.47 min)、CO2(0.85 min)、H2O(1.90 min)、H2S(1.98 min)、COS(3.05 min)和CS2(9.35 min)。
CS2转化率以反应器进出口气体中CS2的浓度差为依据进行计算,并与出口气体中的CO2、H2S及COS等成分进行物料衡算,确认实验中的CS2转化系由催化反应引起,非吸附所致。
2 结果与讨论
2.1 湃铝石制备因素考察
湃铝石是制备高纯度η-Al2O3的重要前驱体,而湃铝石本身通常需要自行制备。本实验以硫酸铝与氨水为原料制备了湃铝石,并对其沉淀过程中的溶液终点pH值、铝离子浓度及沉淀老化时间等关键因素进行考察,图1(a) 、(b) 和(c)分别为不同终点pH值、铝离子浓度以及老化时间得到的湃铝石样品XRD图。

图1 不同制备条件下湃铝石样品的XRD图Figure 1 XRD patterns of bayerite samples using different preparation conditions
通过图1(a)可以看出,终点pH值为9.0时得到的产品晶相组成主要为拟薄水铝石(PDF#21-1307),提高终点pH至10.0时产品中出现了湃铝石成分(PDF#20-0011),同时仍含有一定量的拟薄水铝石,当终点pH值升高至11.0时产品中几乎不含有拟薄水铝石,再继续升高则会出现一定量的诺水铝石相(PDF#72-0623),因此在终点pH值为11.0条件下得到的湃铝石样品纯度最高。由图1(b)中14.0、38.2等处分别归属于拟薄水铝石和诺水铝石晶相的特征峰可以看出,铝离子浓度对湃铝石样品纯度的影响主要体现在这两种杂质的含量上,其中B-11-0.1-12样品在这几处出峰最不明显,说明杂质含量最少,因此湃铝石的纯度最高。从图1(c)则可以看出老化时间对湃铝石样品纯度的影响,与铝离子浓度对其影响类似,老化时间为12 h得到的样品B-11-0.1-12中拟薄水铝石和诺水铝石的含量都最少,而减少或延长老化时间会使拟薄水铝石或诺水铝石的含量增多,因此有一个最佳的老化时间。根据以上分析,选用B-11-0.1-12样品用于η-Al2O3的制备。
2.2 η-Al2O3和γ-Al2O3的表征
图2分别为η-Al2O3、γ-Al2O3及其前驱体样品的XRD图。由图2可见,η-Al2O3与γ-Al2O3在XRD图上差别不明显。从两者JCPDS卡片上标准数据可知,编号分别为#04-0875的η-Al2O3与#10-0425的γ-Al2O3两者在19.3、31.9、37.4、39.7、46.0、60.9、66.7和85.0这八处的特征峰位置几乎全部重叠,仅在79.1°处存在微弱差异,前者在此位置有一小峰而后者没有。也有研究者指出,η-Al2O3在46.0附近的衍射峰是单峰,而γ-Al2O3为双峰;此外,在19.3处,η-Al2O3的衍射峰较尖锐,而γ-Al2O3的峰较弥散[19]。图2中η-Al2O3与γ-Al2O3两者衍射峰的差异都吻合所述特征,说明制备的两种氧化铝样品具有不同的晶相。

图2 η-Al2O3、γ-Al2O3及其前驱体样品的XRD图Figure 2 XRD patterns of η-Al2O3,γ-Al2O3 and their precursors
图3为η-Al2O3和γ-Al2O3样品的N2物理吸附-脱附等温曲线,其比表面积、孔容和平均孔经数据见表1。从图3可以看出,η-Al2O3呈现H3型滞后环形状,表明存在狭缝孔结构,而γ-Al2O3的滞后环为H2型,说明具有“墨水瓶”形孔结构,因此两者的织构也大不相同。从表1可以看出,η-Al2O3和γ-Al2O3的比表面积较为接近,但γ-Al2O3的孔容是η-Al2O3的两倍,其平均孔径也略大于后者。
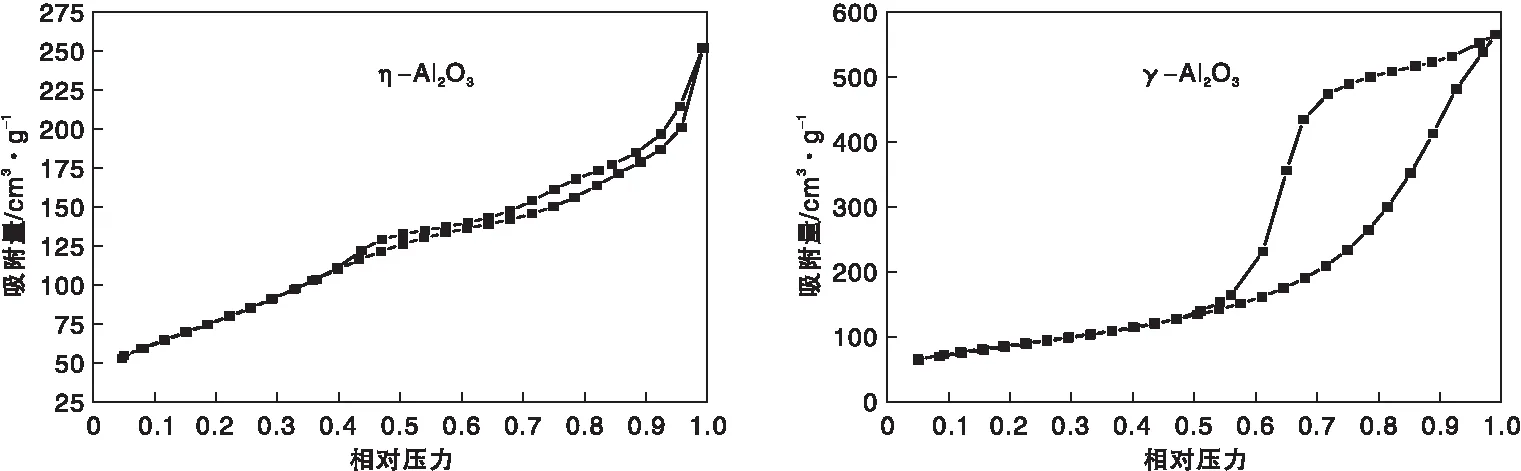
图3 η-Al2O3和 γ-Al2O3样品的N2物理吸附-脱附等温曲线Figure 3 N2 adsorption-desorption isotherms of η-Al2O3 and γ-Al2O3 samples

表1 η-Al2O3和γ-Al2O3的比表面积、孔容以及平均孔径
图4为η-Al2O3和γ-Al2O3样品的扫描电镜照片。从图4可以看到,η-Al2O3表面呈现不规则的小颗粒堆积状,而γ-Al2O3表面则具有疏松多孔网络结构,两者在表面形貌上差异显著。

图4 η-Al2O3和γ-Al2O3样品的扫描电镜照片Figure 4 SEM images of η-Al2O3 and γ-Al2O3 samples
图5为η-Al2O3和γ-Al2O3样品的NH3-TPD曲线。由图5可见,在低温(100~200) ℃范围内,-Al2O3和γ-Al2O3都有较大的NH3脱附峰,表明两种样品都存在大量的弱酸位。同时,-Al2O3样品在(300~400) ℃之间有一峰形宽大的脱附峰,而γ-Al2O3样品在相同温度区间的脱附峰较弱,反映出-Al2O3表面上的中等强度酸性位尤为丰富。此外在(600~700) ℃区域,-Al2O3和γ-Al2O3还具有较明显的脱附峰,说明两者都还存在强酸位,且数量相当。
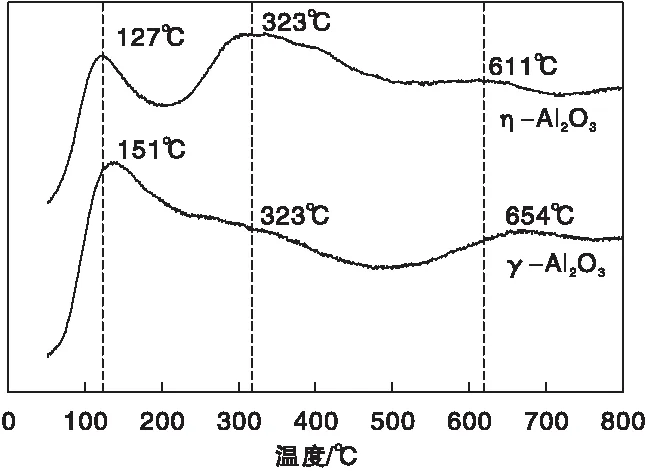
图5 η-Al2O3和γ-Al2O3样品的NH3-TPD曲线Figure 5 NH3-TPD curves of η-Al2O3 and γ-Al2O3 samples
图6为η-Al2O3和γ-Al2O3样品的CO2-TPD曲线。从图6可以看出,-Al2O3和γ-Al2O3的碱强度分布比较相似,两者在低温(50~100) ℃与高温(600~700) ℃两处均有CO2脱附峰,前处表示弱碱位,后处为强碱位,因低温处的峰面积都大于高温处,因此在数量上两者的弱碱位要多于强碱位,其中-Al2O3上不同碱强度的数量对比更为显著,其强碱位的数量更少。同时,与γ-Al2O3相比,-Al2O3上低温CO2脱附峰的峰顶温度偏向更低温,表明其弱碱位的碱性也更弱。
图6 η-Al2O3和γ-Al2O3样品的CO2-TPD曲线Figure 6 CO2-TPD curves of η-Al2O3 and γ-Al2O3samples
2.3 η-Al2O3和γ-Al2O3上CS2水解反应性能
在反应气体体积组成为φ(CS2)=0.55%,φ(H2O)=13.26%,φ(N2)=86.19%时,空速分别为9 000 h-1与18 000 h-1条件下,η-Al2O3和γ-Al2O3催化剂上CS2转化率随床层温度的变化曲线如图7所示。从图7可以看出,在相同空速下,CS2转化率均随反应温度的升高呈现出上升趋势,而相同温度下,η-Al2O3上的CS2转化率始终高于γ-Al2O3。在空速9 000 h-1下,330 ℃时η-Al2O3上的CS2转化率就超过了97%,而在γ-Al2O3上需温度达415 ℃时转化率才超过97%;当空速为18 000 h-1及床层温度为415 ℃时,η-Al2O3上的CS2转化率可达92.0%,γ-Al2O3上则为83.8%,充分说明了η-Al2O3具有比γ-Al2O3更优异的催化CS2转化性能。
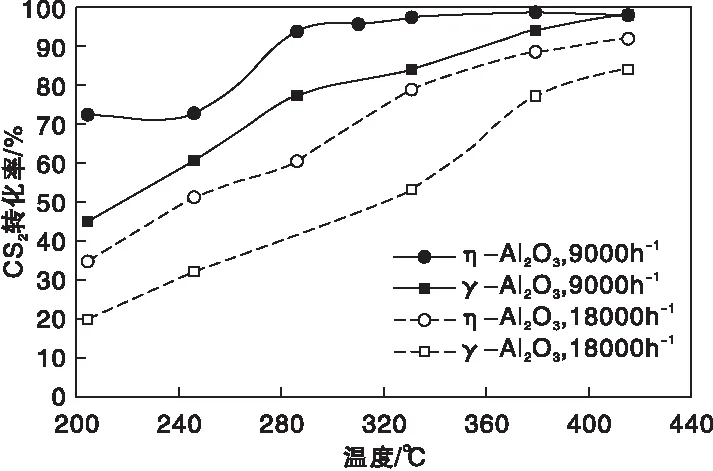
图7 η-Al2O3和γ-Al2O3催化剂上不同空速下CS2转化率随床层温度的变化曲线Figure 7 CS2 conversion versus bed temperature over η-Al2O3 and γ-Al2O3 catalysts under different GHSV
图8为η-Al2O3和γ-Al2O3催化剂上CS2水解转化率随其体积分数的变化曲线,测试时H2O的体积分数保持为13.26%,N2为平衡气,反应床层温度为310 ℃,空速为9 000 h-1。
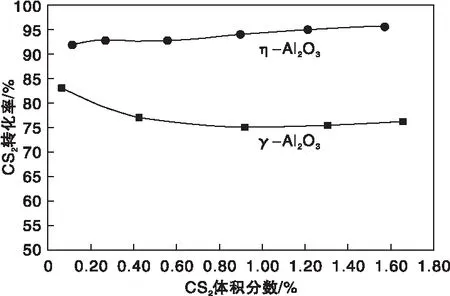
图8 η-Al2O3和γ-Al2O3催化剂上CS2水解转化率随其体积分数的变化曲线Figure 8 CS2 conversion versus CS2 volume fraction over η-Al2O3 and γ-Al2O3 catalysts
由图8可知,随着CS2体积分数的增加,η-Al2O3上CS2转化率有所上升,而在γ-Al2O3上则呈现下降趋势,特别当CS2体积分数较低时下降较为明显。后者的表现行为与文献[11]报道的规律一致,反映出η-Al2O3催化剂对CS2水解的作用机制与γ-Al2O3不尽相同。
2.4 构效关系探讨
关于CS2水解的催化作用机制,文献中已有诸多讨论,但至今并未形成统一的认识[3-4]。一般认为,CS2水解是碱催化的反应,在Al2O3上碱性的-OH位是催化活性中心,因此,添加碱金属和碱土金属能增加Al2O3上碱性位的数量,从而提高对CS2的水解活性。如王晓鹏[20]研究发现,采用浸渍方法在Al2O3上负载K2O后,在300 ℃时催化CS2水解的活性明显增强,进一步对K2O负载前后的Al2O3进行CO2-TPD测试,发现未负载的Al2O3上存在两个脱附峰,分别位于(50~150) ℃与(200~400) ℃,高温脱附峰面积是低温峰的近6倍,负载K2O后低温脱附峰的面积增加了近5倍,而高温脱附峰变化不大,由此认为低温脱附峰所代表的弱碱中心在催化水解中发挥着重要作用,而碱强度并非越高越好。但也有研究者发现,添加较多的Na2O可使Al2O3催化剂上的CS2水解转化率降低[21]。此外,催化剂的孔隙结构与比表面积对水解活性也有影响,所以当比较具有不同织构的催化剂时,往往难以将活性变化归结于单一因素[3-4]。
结合本实验η-Al2O3与γ-Al2O3的结构表征结果与两者催化CS2水解的活性变化规律来看,虽然η-Al2O3的孔容与孔径均小于γ-Al2O3,但由于CS2水解涉及的各种反应物、中间体及产物的分子尺寸都不大,且反应温度较高,因此产生与孔径及孔容有关的扩散阻碍问题的可能性较小[22],同时由于η-Al2O3与γ-Al2O3的比表面积相当,所以主导两者活性差异的因素唯有表面酸碱位的数量及强度。与η-Al2O3相比,γ-Al2O3虽然弱碱位数量与之接近,但强碱位数量则多出数倍,同时总酸性位较少。正如文献指出,催化剂表面上的强碱位会对水解产物CO2和H2S产生强吸附[20],由此阻碍水解反应的进行,这可能是γ-Al2O3的水解活性低于η-Al2O3的原因之一。值得一提的是,本实验表示两种氧化铝弱碱位的CO2低温脱附峰位于(50~100) ℃范围内,其实被认为是物理吸附所致[23],而CS2水解反应的温度区域选取为(200~450) ℃,显然两者的温度区间并不匹配,低温吸附位可能难以成为较高温下反应时的有效活性中心。
另一方面,如图8所示,在相同温度及水量下,CS2在η-Al2O3与γ-Al2O3催化剂上反应时的浓度效应明显不同,前者表现为一级或以上响应,而后者低于一级。据文献[3-4]报道,Al2O3催化剂上CS2水解一般符合一级反应动力学规律,遵循Eley-Rideal机理,即气相或弱吸附的CS2与已吸附的水分子之间发生反应。结合本文实验结果推测,在反应温度下,由于η-Al2O3上较多酸中心以及较少碱中心的存在,CS2在绝大多数部位上的吸附可能都比较弱,所以反应极可能遵照Eley-Rideal机制;而在γ-Al2O3上,由于大量强碱中心的存在导致CS2极易被强吸附,从而在表面上快速形成饱和吸附层,使得反应降低对CS2浓度的依赖性,表现为随着CS2浓度增加,反应转化率下降,并且CS2与产物的强吸附还导致γ-Al2O3的催化活化能力受限,这可能是γ-Al2O3活性逊色于η-Al2O3的重要原因。
3 结 论
通过优化制备高纯度的前驱体湃铝石,获得了理想的η-Al2O3材料,比较了与γ-Al2O3在表面形貌、织构及酸碱性能方面的差异,结果显示,η-Al2O3具有较小的平均孔径与孔容,但比表面积与γ-Al2O3相当,同时具有更弱的弱碱位与较少的强碱位,以及丰富的中等强度酸性位。
将η-Al2O3与γ-Al2O3作为催化剂应用于CS2中温水解反应过程,结果表明,相同温度下,η-Al2O3上的CS2转化率始终较高,改变空速对此规律没有影响,说明η-Al2O3是一种比γ-Al2O3更佳的CS2水解催化剂。并且,两种催化剂上CS2反应的浓度效应明显不同,η-Al2O3上表现为一级或以上响应,而γ-Al2O3上反应低于一级。推测两种催化剂因酸碱性质存在差异,影响了对CS2的吸附能力,从而导致水解反应遵循不同的机制。

