BVT-14225通过抑制11β-羟基类固醇脱氢酶1还原活性促进神经干细胞增殖和迁移
马君梅,南海函,胡志妍,陈依尔,崔燕华,陈星驰,李 莉,苏 颖,梅虹霞,缪项慧,张旭彤,林 函,
〔1.温州医科大学附属第二医院、育英儿童医院麻醉与围术期医学科,浙江 温州 325027;2.温州医科大学检验医学院(生命科学学院),浙江 温州 325035;3.浙江省麻醉学重点实验室,浙江 温州 325035;4.温州市人民医院,浙江 温州 325000〕
神经干细胞(neural stem cells,NSC)是中枢神经系统的多能性细胞,具有不断自我更新的增殖能力,向神经元、星形胶质细胞、少突胶质细胞的分化能力及向特定脑区的迁移能力[1],对于保持中枢神经系统的稳态和正常脑组织的发育具有重要的作用[2-3]。STROEMER等[4]研究表明,向卒中大鼠同侧壳核植入NSC,可显著改善大鼠的感觉运动功能和NSC的分化能力;同时,NSC替代治疗策略已进入临床试验。KALLADKA等[5]研究表明,向缺血性卒中患者同侧壳核注射NSC 2年后,患者的脑成像以及卒中评分较2年前均表现出显著的改善和提高。当中枢神经系统受到损伤时,促进NSC的发育对保持认知功能和修复受损的脑细胞起着至关重要的作用[6]。
糖皮质激素作为重要的应激激素,在孕妇、胎儿及婴幼儿手术的围术期显著增高;在慢性社会应激的情况下也会升高。而高浓度的糖皮质激素对中枢神经系统,特别是NSC的发育也会产生不良影响。SUNDBERG等[7]研究表明,在体外培养的NSC中,活性糖皮质激素(皮质酮)可显著抑制NSC的增殖,从而影响神经发育。LEMAIRE等[8]通过建立胎鼠应激模型的研究表明,在Morris水迷宫实验的空间学习任务中,应激SD大鼠的潜伏期和轨迹总距离在获得性训练时均显著延长。TIAN等[9]研究表明,手术应激参与了糖皮质激素受体(glucocorticoid receptor,GR)的早期激活;且GR拮抗剂可缓解手术应激引起的认知功能障碍。所以,我们提出科研假设:这种认知障碍或神经损伤可能与围术期应激导致糖皮质激素分泌增加而造成的神经发育毒性有关,降低围术期应激水平可能有助于缓解糖皮质激素对NSC的损害,从而达到神经保护的作用。
11β-羟基类固醇脱氢酶1(11β-hydroxysteroid dehydrogenase type 1,11β-HSD1),是糖皮质激素的代谢酶,可催化非活性的可的松〔在啮齿动物为 11-脱氢皮质酮(11-dehydrocorticosterone,DHC)〕和活性的氢化可的松〔即皮质醇,在啮齿类动物为皮质酮(corticosterone,CORT)〕的相互转化[10-12],从而维持局部组织活性糖皮质激素浓度的稳定。机体局部活性糖皮质激素的浓度受到11β-HSD1 活性的影响,BVT-14225(BVT)是11β-HSD1的特异性抑制剂。但NSC上是否存在11β-HSD1,其是否可对NSC发育产生影响,目前未见报道。为此本研究就BVT对NSC发育的影响及其机制进行研究,旨在阐明BVT是否通过调节11β-HSD1活性对围术期的NSC起到保护作用,为将来药物开发提供实验依据。
1 材料与方法
1.1 药品、试剂和仪器
CORT,美国陶素生化公司;DHC,美国Steroids公司;BVT,美国MCE公司;DMEM、DMEM/F12(1∶1)、B27 supplement、N-2 supplement和accutase消化酶,美国Gibco公司;碱性成纤维生长因子(basic fibroblast growth factor,bFGF)和 表 皮生长因子(epidermal growth factor,EGF),美国Peprotech公司;CytoTox96®非放射性细胞毒性试剂盒,美国Promega公司;DMSO,美国Sigma公司;基质胶,美国BD公司;Click-iT™EdUAlexa Fluor488高通道显像试剂盒和Trizol试剂盒,美国Invitrogen公司;小鼠抗大鼠巢蛋白单克隆抗体、兔抗人性别决定基因相关转录因子-2〔SRY(sex determining region Y)-box transcription factor-2,Sox2〕多克隆抗体、山羊抗人胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体、小鼠抗人神经元核抗原(neuronal nuclei,NeuN)单克隆抗体、兔抗人11β-HSD1单克隆抗体、荧光基团488标记的驴抗兔IgG多克隆抗体、荧光基团488标记的驴抗山羊IgG多克隆抗体和荧光基团594标记的驴抗小鼠IgG多克隆抗体,美国Abcam公司;兔抗人β-微管蛋白多克隆抗体,美国Proteintech公司;4‘,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)溶液,索莱宝公司;逆转录试剂盒RR037A,日本TaKaRa公司;qPCR试剂盒,德国Qiagen公司。正置荧光显微镜(TS100)和倒置荧光显微镜(Olympus Cx21),日本Nikon公司;超微量生物检测仪(Nano⁃drop2000c),美国 Thermo公司;CO2培养箱(SPX-250BS/S-Ⅱ),上海新苗医疗器械制造有限公司;超高效液相色谱-质谱仪(Waters TQD),美国Waters公司。
1.2 神经干细胞的提取、培养和鉴定
体质量250~350 g的SD大鼠(温州医科大学实验动物中心,动物许可证编号:SCXK(浙)2015-0001),以雌雄比1∶1置入交配笼里进行交配,室温控制在21~23℃,12 h昼夜交替,将观察到阴拴日记为孕第0天(E0)。对E15孕鼠以0.01 mL·kg-1ip给予5%水合氯醛进行麻醉,麻醉后无菌环境下取出胎鼠的大脑皮质进行增殖培养提取NSC。增殖培养基为含神经营养因子(2%B27,bFGF 20 μg·L-1和EGF 20 μg·L-1)和1%青链霉素混合液的DMEM/F12(1∶1),培养条件为5% CO2,37℃。培养约5 d进行细胞传代,稳定培养至第2代可接种于基质胶预先包被的培养板,随后进行NSC标志物巢蛋白和Sox2的免疫荧光染色:4%多聚甲醛固定30 min,0.5%曲拉通X-100透膜20 min和5%驴血清封闭孵育1 h后,加入含有巢蛋白和Sox2抗体(稀释比例均为1∶200)的一抗稀释液。4℃摇床孵育16~20 h后,加入含有驴抗小鼠IgG抗体和驴抗兔IgG抗体(稀释比例均为1∶500)的二抗稀释液(用0.01 mol·L-1磷酸盐缓冲液稀释),室温摇床孵育1 h,并用DAPI溶液对所有细胞核进行复染。然后用正置荧光显微镜拍照,用巢蛋白阳性和Sox2阳性细胞比例代表NSC纯度,以鉴定NSC。巢蛋白阳性细胞比例(%)=巢蛋白阳性细胞数/DAPI阳性细胞数×100%,Sox2阳性细胞比例(%)=Sox2阳性细胞数/DAPI阳性细胞数×100%。
除划痕实验细胞接种前培养板不需要基质胶预处理外,其他实验细胞培养板均用基质胶预处理,并置于细胞培养箱内6~12 h,以促进NSC贴壁。
1.3 逆转录PCR及凝胶电泳检测11 β-HSD1 mRNA在神经干细胞的表达
以每孔5.0×105L-1的密度将细胞接种于6孔板,每孔加入增殖培养基2 mL,置于细胞培养箱内培养48 h后更换增殖培养基,继续培养48 h。按Trizol试剂说明书提取NSC的总RNA,测定总RNA浓度及A260nm/A280nm的比值;利用TaKaRa逆转录试剂盒将RNA逆转录为cDNA,进行PCR,并用琼脂糖凝胶电泳法检测PCR产物。以EB核酸染色剂染色,在Bio-Rad曝光机凝胶成像系统的紫外线下对琼脂糖凝胶进行曝光处理,用Image Lab 3.0软件观察目的基因11β-HSD1和内参RS16的曝光条带。内参基因RS16的上游引物(F)AAGTCTTCG⁃GACGCAAGAAA,下游引物(R)TTGCCCAGAAGCAGAACAG;目的基因11β-HSD1的上游引物(F)CGAAGAAGCATGGAGGTCAAC,下游(R)GCAGAGTAGGAAGCAATCAGAG;反应条件:预变性(95℃,3 min),变性(95℃,15 s),退火(60℃,15 s)及延伸(72℃,60 s),共35循环,最后72℃延伸5 min。
1.4 免疫荧光法检测NSC增殖能力
1.4.1 DHC对NSC增殖的影响
将NSC以每孔0.5×105L-1的密度接种于预先放入爬片的24孔板,每孔加入增殖培养基500 μL。在细胞培养箱内培养24 h后,将细胞随机分为细胞对照组,溶剂对照组(0.1% DMSO处理48 h),CORT阳性对照组(CORT 1.0 μmol·L-1处理48 h),DHC组(DHC 0.1,1.0和10.0 μmol·L-1处理48 h)。在处理结束前 4 h 加入终浓度为 10 μmol·L-1的5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2′-deoxy⁃uridine,EdU),处理结束后按照Click-iT™ EdU Alexa Fluor488试剂盒说明书进行EdU和Hoechst 33342免疫荧光实验。用正置莱卡显微镜拍摄照片,ImageProPlus 6.0软件计数EdU阳性细胞数和Hoechst阳性细胞数,并计算EdU阳性的细胞比例,以此代表NSC的增殖能力。NSC增殖率(%)=EdU阳性细胞数/Hoechst阳性细胞数×100%。
1.4.2 BVT对NSC增殖的影响
将NSC以每孔0.5×105L-1的密度接种于预先放入爬片的24孔板,每孔加入增殖培养基500 μL。在细胞培养箱内培养24 h后,将细胞随机分为细胞对照组(培养48 h),溶剂对照组(0.1% DMSO处理48 h),DHC模型组(DHC 10.0 μmol·L-1处理48 h),BVT对照组(BVT 10.0 μmol·L-1处理48 h),BVT干预组(BVT 10.0 μmol·L-1处理1 h后再给予DHC 10.0 μmol·L-1,继续处理48 h)。在处理结束前4 h加入终浓度为 10.0 μmol·L-1的EdU,处理结束后,按1.4.1进行检测和分析NSC的增殖率。
1.4.3 BVT对NSC分化的影响
将NSC按1.0×105L-1的细胞密度接种于预先放入爬片的24孔板,每孔加入增殖培养基500 μL,在细胞培养箱内培养24 h后,更换为含有1% N-2 supplement(100×)和 1%青、链霉素混合液的DMEM/F12(3∶1)的分化培养基500 μL并将细胞按1.4.2分组处理,48 h后更换分化培养基,结束药物处理。以后每2 d更换一次分化培养基,直至细胞总分化时间达到7 d。然后对各组细胞进行GFAP、NeuN以及DAPI(可对所有细胞核进行染色)的免疫荧光染色实验:4%多聚甲醛固定30 min,0.5%曲拉通X-100透膜20 min和5%驴血清封闭孵育1 h后,加入含有GFAP和NeuN抗体(稀释比例均为1∶500)的一抗稀释液。4℃摇床孵育16~20 h后,加入含有驴抗山羊和驴抗小鼠IgG抗体(稀释比例均为1∶500)的二抗稀释液(用0.01 mol·L-1磷酸盐缓冲液稀释),室温摇床孵育1 h,最后用DAPI溶液复染细胞核。用正置莱卡显微镜拍摄照片,ImageJ 1.51软件和ImageProPlus 6.0软件分别计数GFAP阳性、NeuN阳性和DAPI阳性细胞数,以GFAP阳性和NeuN阳性细胞比例分别反映NSC的星形胶质细胞和神经元的分化能力。GFAP阳性细胞比例(%)=GFAP阳性细胞数/DAPI阳性细胞数×100%,NeuN阳性细胞比例(%)=NeuN阳性细胞数/DAPI+细胞数×100%。
1.5 乳酸脱氢酶(lactate dehydrogenase,LDH)释放法检测细胞毒性
将NSC以每孔1.0×105L-1的密度接种于96孔板,每孔增殖培养基100 μL,在细胞培养箱内培养24 h后,将细胞按1.4.2分组处理,并增设最大LDH释放组,在处理结束前40 min向最大LDH释放组的每个孔均加入10 μL的裂解液,处理结束后按照CytoTox 96非放射性细胞毒性试剂盒说明书,每孔各取培养上清液50 μL转移至另一96孔板与检测缓冲液底物50 μL混合,室温下避光孵育30 min后,每孔各加终止液50 μL终止反应。用酶标仪检测吸光度(A490nm)以反映LDH释放量,并以LDH释放率反映各组细胞毒性。LDH释放率(%)=处理组A490nm/最大LDH释放组A490nm×100%。
1.6 超高效液相色谱-质谱(UPLC-MS)法检测11 β-HSD1的还原活性
将NSC以每孔0.5×105L-1的密度接种于预先放入爬片的24孔板,每孔加入增殖培养基500 μL,在细胞培养箱内培养24 h后将细胞随机分为DHC模型组(DHC 10.0 μmol·L-1处理48 h)和BVT干预组(BVT 10.0 μmol·L-1处理 1 h 后再给予 DHC 10.0 μmol·L-1,继续处理48 h),然后收集各组的细胞培养基并继续进行如下UPLC-MS处理并计算培养基中DHC和BVT的浓度。
分别配制浓度梯度的CORT(0.01,0.02,0.1,0.5,1.0,2.0,5.0 μmol·L-1)、DHC(0.03,0.06,0.3,1.5,3.0,6.0和15.0 μmol·L-1)(标准品)原液及皮质醇0.2 μmol·L-1(内标),取空白培养基90 μL,加各梯度标准品原液10 μL置于1.5 mL塑料离心管中,加入内标10 μL,涡旋2 min混匀,随后加入甲醇300 μL沉淀蛋白,涡旋3 min,然后4℃,13 523×g离心10 min,取上清100 μL于进样小瓶中进行UPLC-MS分析,以标准品与内标的峰面积比值与相应的浓度进行加权线性回归,分别得到CORT及DHC的标准曲线方程。然后取细胞培养基100 μL和空白培养基100 μL进行上述同样操作,随后将样本与内标的峰面积比值代入标准曲线方程,分别得出各培养基样品中CORT和DHC的浓度,并计算转化率(即酶的还原活性)。酶的还原活性(%)=CORT浓度/DHC浓度×100%。
1.7 Western印迹法检测11 β-HSD1蛋白表达
将NSC以每孔5×105L-1的密度接种于6孔板,每孔加入增殖培养基2 mL,培养24 h后将细胞按1.6分组处理,48 h后配置蛋白裂解试剂依次加入至6孔板中,于冰上静置10 min,收集裂解液,超声。4℃,12 000×g离心30 min,收取上清液。用BCA工作试剂盒测定蛋白浓度,每条泳道蛋白上样量25 μg,电泳、转膜后用5%脱脂奶粉封闭1 h,加入内参蛋白β微管蛋白抗体(稀释比例1∶2000)和目的蛋白11β-HSD1抗体(稀释比例1∶1000),4℃摇床孵育18~20 h。TBST洗膜,加入稀释比例为1∶5000的羊抗兔生物素二抗,室温孵育1 h,TBST充分洗膜,通过曝光后显示条带。ImageJ 1.51软件分析目标蛋白条带和内参蛋白条带的积分吸光度(integrated absorbance,IA),11β-HSD1蛋白相对表达水平以IA11β-HSD1/IAβ微管蛋白比值表示。
1.8 划痕实验检测NSC迁移能力
将NSC以2.5×105L-1密度接种于用10%多聚鸟氨酸预处理(以促进NSC贴壁)的24孔板,每孔加入增殖培养基500 μL,在细胞培养箱内培养,待培养孔底部完全被细胞覆盖,使用200 μL无菌枪头对所有实验孔的细胞进行划痕处理并更换分化培养基,立即用倒置莱卡显微镜拍摄此时细胞划痕(0 h)的照片。然后将细胞按1.4.2分组处理,48 h后在0 h各拍照位点处复拍此时的划痕照片(48 h)。ImageJ 1.51软件计算处理前后细胞划痕的面积,以“愈合”率反映NSC迁移能力。“愈合”率(%)=(0 h的划痕面积-48h的划痕面积)/0h的划痕面积×100%。
1.9 统计学分析
所有实验均重复≥3次,实验结果用±s表示,用SPSS18.0软件进行统计分析。3组以上的比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法;两组比较采用两独立样本的t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 神经干细胞的鉴定
原代NSC培养5~7 d,可逐渐增殖,形成具有良好折光性的多细胞的球体(图1),选取400~500 μm的神经球用消化酶消化为单个NSC进行接种贴壁培养,以进行鉴定和后续实验。免疫荧光实验结果(图2)表明,巢蛋白(红色)和Sox2(绿色)阳性的细胞在DAPI(蓝色)细胞核染色的细胞中所占比例均>96%。因此,培养的细胞为NSC。

Fig.1 Photomicrograph of neural stem cells(NSCs)sphere.
2.2 11 β-HSD1 mRNA在神经干细胞中的表达水平
11β-HSD1和RS16的核酸凝胶电泳条带图表明,11β-HSD1存在于NSC上(图3)。
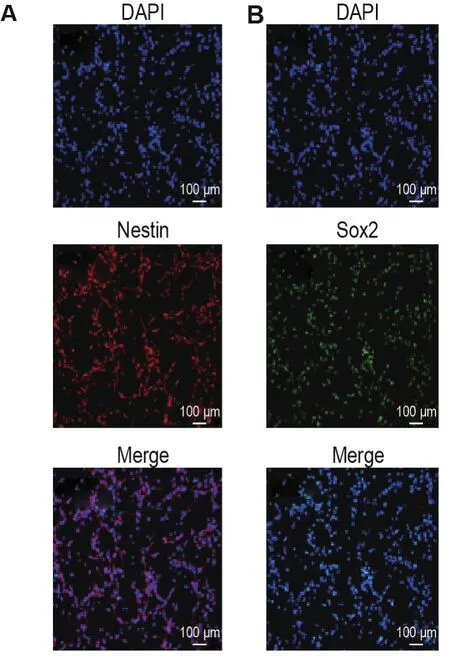
Fig.2 Immunofluorescence images of NSCs for nestin(A)and SRY(sex determining region Y)-box tran⁃scription factor-2(Sox2)(B).DAPI:4′,6-diamidino-2-phenylindole.
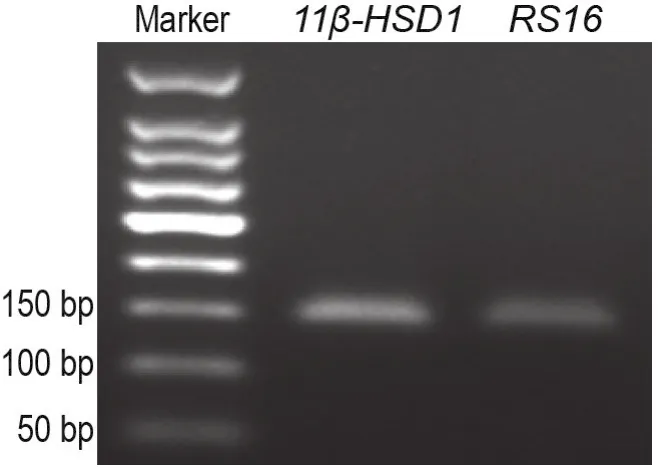
Fig.3 Identification of 11 β-hydroxysteroid dehydroge⁃nase type 1(11 β-HSD1)by nucleic acid gel electro⁃phoresis.
2.3 CORT和DHC对神经干细胞增殖能力的影响
如图4所示,与细胞对照组相比,溶剂对照组、DHC 0.1和1.0 μmol·L-1组NSC增殖率无统计学差异,CORT 阳性对照组和 DHC 10.0 μmol·L-1组NSC增殖率显著降低(P<0.01);与溶剂对照组相比,DHC 0.1 和1.0 μmol·L-1增殖率变化无统计学差异,CORT阳性对照组和DHC 10.0 μmol·L-1组NSC增殖率显著降低(P<0.01);与CORT阳性对照组相比,DHC 0.1和1.0 μmol·L-1组NSC增殖率显著增高(P<0.05),但DHC 10.0组NSC增殖率变化无统计学差异。提示DHC 0.1和1.0 μmol·L-1均不影响 NSC增殖,但 CORT 1.0 μmol·L-1和 DHC 10.0 μmol·L-1对 NSC的增殖具有相同程度抑制作用,表明非活性 DHC 10.0 μmol·L-1可建立与活性CORT 1.0 μmol·L-1等效的糖皮质激素浓度显著升高的环境。因此,后续实验均以DHC 10.0 μmol·L-1作为造模浓度。
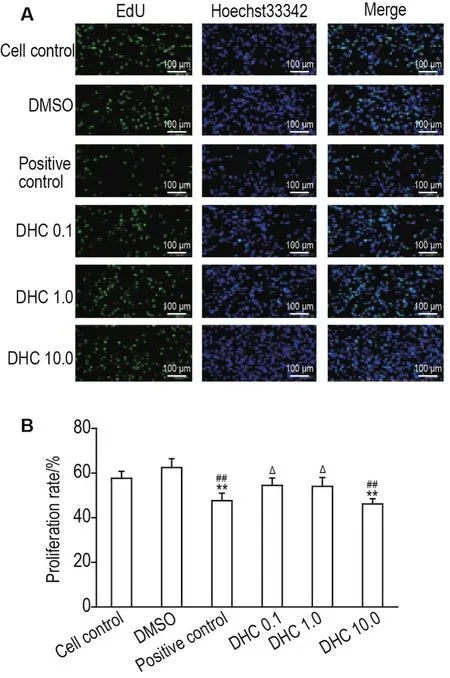
Fig.4 Effect of corticosterone(CORT)and 11-dehy⁃drocorticosterone(DHC) on NSC proliferation by 5-ethynyl-2′-deoxyuridine (EdU) assay.EdU positive cells refer to the cells that have the ability to proliferate,Hoechst positive cells mean total cells.DMSO group:NSCs were treated with 0.1% DMSO for 48 h;positive control group:NSCs were treated with CORT 10.0 μmol·L-1for 48 h;DHC groups:NSCs were treated with DHC 0.1,1.0 or 10.0 μmol·L-1for 48 h,respec⁃tively.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with DMSO group;△P<0.05,compared with positive control group.
2.4 BVT和DHC对神经干细胞的毒性作用
如表1显示,细胞对照组、溶剂对照组,DHC模型组、BVT对照组和BVT干预组LDH释放变化无显著差异,各组之间均无统计学意义。说明BVT和DHC均不增加NSC的LDH释放率,即BVT和DHC均无细胞毒性作用。
2.5 BVT对神经干细胞11 β-HSD1还原活性的影响
如表2所示,BVT干预组11β-HSD1还原活性显著低于DHC模型组(P<0.01),说明BVT可显著抑制NSC的11β-HSD1酶的还原活性。
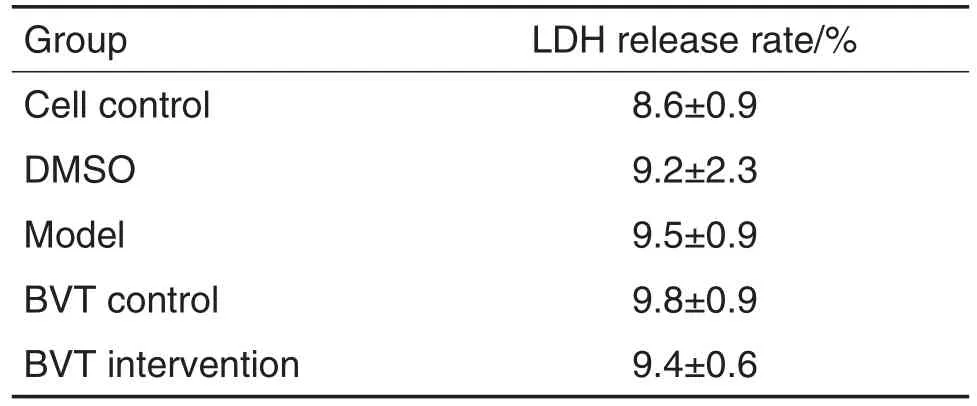
Tab.1 Effect of DHC and BVT-14225(BVT)on lactate dehydrogenase(LDH)release rate of NSCs

Tab.2 Effect of BVT on reduction activity of 11 β-HSD1 in NSCs by ultra performance liquid chromatographymass spectrometry(UPLC-MS)assay
2.6 BVT对神经干细胞11 β-HSD1蛋白表达水平的影响
如图5显示,与DHC模型组相比,BVT干预组蛋白表达水平的变化无统计学差异,表明BVT不改变NSC的11β-HSD1蛋白表达。
2.7 BVT对神经干细胞增殖能力的影响
如图6所示,与细胞对照组相比,溶剂对照组和BVT对照组NSC增殖率无统计学差异,DHC模型组(P<0.01)和BVT干预组(P<0.05)NSC增殖率均显著降低;与溶剂对照组相比,DHC模型组NSC增殖率显著降低(P<0.01),而BVT对照组和BVT干预组NSC增殖率均无统计学差异;与DHC模型组相比,BVT干预组NSC增殖率显著增强(P<0.05)。说明在糖皮质激素浓度显著升高时,BVT可促进NSC增殖。
2.8 BVT对神经干细胞分化能力的影响
如图7所示,细胞对照组、溶剂对照组,DHC模型组、BVT对照组和BVT干预组NeuN阳性和GFAP阳性细胞所占的比例变化无显著差异,各组之间均无统计学意义。说明DHC不影响NSC的分化,并且在糖皮质激素浓度显著升高时,BVT也不影响NSC的分化。
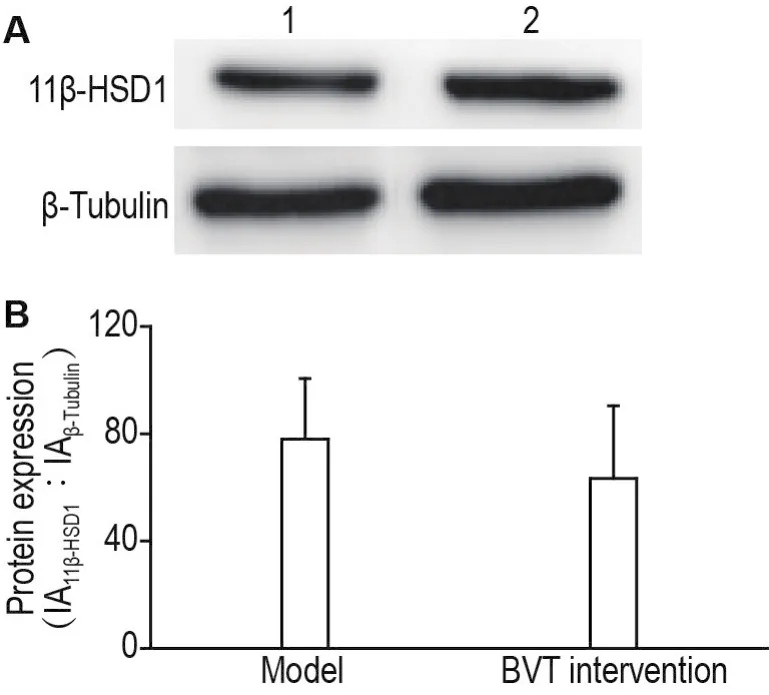
Fig.5 Effect of BVT on 11β-HSD1 protein expression in NSCs by Western blotting.Lane 1:model group;Lane 2:BVT intervention goup.See Tab.2 for the NSC treatment.B was the semi-quantitative result of A.IA:integrated absorbance.±s,n=4.

Fig.6Effect of BVT on NSCs proliferation by EdU assay.EdU positive cells refer to the cells that have the ability to proliferate.Hoechst33342 positive cells mean total NSCs.See Tab.1 for the NSC treatment.B was the semi-quantitative result of A.±s,n=3. *P<0.05,**P<0.01,compared with cell control group;##P<0.01,compared with DMSO group;△P<0.05,compared with model group.
2.9 BVT对神经干细胞迁移能力的影响
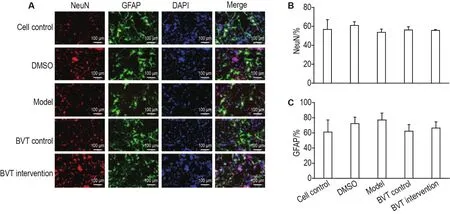
Fig.7 Effect of BVT on NSC differentiation by immunofluorescence assay.Neuronal nuclei(NeuN)positive cells mean neurons,glial fibrillary acidic protein(GFAP)positive cells means astrocytes,and DAPI positive cells mean all NSCs.See Tab.1 for the NSC treatment.B and C were the semi-quantitative result of A.±s,n=3.

Fig.8 Effect of BVT on NSC migration by scratch assay.See Tab.1 for the NSC treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with model group.
如图8所示,细胞对照组、溶剂对照组、DHC模型组和BVT对照组NSC迁移率变化均无显著差异,各组之间无统计学意义;与DHC模型组相比,BVT干扰组NSC迁移率显著增强(P<0.05)。说明虽然DHC不影响NSC迁移,但在糖皮质激素浓度显著升高时,BVT可促进NSC迁移。
3 讨论
本研究发现,NSC上存在糖皮质激素代谢酶11β-HSD1;在本实验条件下,非活性糖皮质激素DHC可显著抑制NSC的增殖,但对分化和迁移无影响;且在糖皮质激素浓度显著升高时,BVT可通过抑制NSC 11β-HSD1还原活性,显著促进NSC增殖和迁移而不影响分化(本研究结果已申请国家发明专利,专利号:202010531732.9)。
HARRIS等[13]通过建立小鼠的急性束缚应激模型的研究表明,应激时,野生型小鼠血浆CORT浓度增加但DHC浓度并未增加,而11β-HSD1(-/-)小鼠的血浆CORT和DHC浓度均表现出显著增高。且TA等[14]研究表明,大鼠急性应激时,血浆CORT浓度显著增加,而血浆DHC浓度呈现下降的趋势。因此,应激时HPA轴激活,机体内大量的非活性形式的DHC在代谢酶11β-HSD1的催化下,快速转化为活性的CORT,使机体活性的糖皮质激素浓度迅速升高。由于本研究拟通过调节11β-HSD1还原活性研究其对NSC增殖、分化和迁移的影响以期达到神经保护作用,所以本研究以DHC作为反应底物,模拟高糖皮质激素环境。本研究以CORT 1.0 μmol·L-1[7,14-15]为等效性评估标准,通过检测NSC增殖以确定DHC的等效浓度。
应激是机体重要的防御机制,应激时糖皮质激素的升高对抵抗有害刺激和保持内环境稳定起着重要的作用,但是持续高浓度的糖皮质激素不利于NSC发育。
ANACKER 等[16]研究 表 明,神 经祖细 胞(HPC03A/07)暴露于高浓度的皮质醇(100μmol·L-1),其增殖能力显著降低。SUNDBERG等[7]研究表明,在原代NSC的体外培养中,高浓度的地塞米松和皮质酮(1.0 μmol·L-1)均可显著抑制NSC的增殖能力。这与本研究中DHC转化为CORT,抑制NSC增殖能力的实验结果相似,也证明本研究DHC模型的可靠性。WONG等[17]通过对SD大鼠腹腔注射CORT建立应激模型的研究表明,7 d高水平的糖皮质激素显著降低NSC向神经元分化的能力,不影响NSC向星形胶质细胞的分化;而28 d高水平的糖皮质激素显著降低NSC向神经元和星形胶质细胞的分化能力。SUNDBERG等[7]研究表明,原代NSC暴露于高浓度的地塞米松或皮质酮5 d,分化能力无任何改变。ANACKER等[16]研究表明,高浓度的皮质醇(100 μmol·L-1)可显著抑制HPC03A/07细胞分化为神经元,但并不影响其向星形胶质细胞的分化。这与本研究中DHC或CORT不影响NSC分化能力的实验结果似乎是矛盾的,原因为本研究中NSC暴露于DHC通过11β-HSD1转化的CORT,48 h的暴露结束后,NSC继续在无DHC的分化培养基中培养5 d,类似于具有5 d的暴露后“恢复期”,可能是产生与上述研究结果矛盾的原因。STEVENS等[18]通过建立孕期(E12)小鼠的束缚应激模型的研究表明,CORT对神经祖细胞的迁移能力具有抑制作用。而本研究中的划痕迁移实验结果表明,DHC不影响NSC迁移能力,可能也是由于本实验条件下活性CORT暴露时间短、浓度低所致。因此,DHC暴露处理48 h可导致NSC增殖能力显著降低,但不影响NSC迁移能力和分化能力。
由于11β-HSD1在非完整细胞虽可表现出氧化还原双重活性,但在完整细胞内主要表现为还原活性(即催化DHC还原为CORT)[19]。而机体应激时循环中糖皮质激素浓度的增加会导致局部脑组织糖皮质激素浓度的增加,因此降低局部脑组织活性糖皮质激素的浓度对NSC至关重要。所以为了消除活性糖皮质激素的不良生物学效应,11β-HSD1是较好的糖皮质激素受体前调控靶点。
RAJAN等[10]研究表明,DHC和CORT均显著增强红藻氨酸对海马神经元的神经毒性,11β-HSD1还原酶抑制剂甘草次酸不改变CORT对红藻氨酸神经毒性的增强作用,但甘草次酸显著降低DHC对红藻氨酸神经毒性的增强作用。因此,11β-HSD1在神经元上以还原性为主,抑制其活性可减弱DHC对神经元的毒性作用。此外,PUIGORIOLILLAMOLA等[20]研究表明,11β-HSD1抑制剂可以阻滞氧化应激小鼠的神经退化和认知受损的进程。YAU等[21-22]研究表明,11β-HSD1(-/-)小鼠在急性应激时可表现出较完整的空间记忆能力。因此,抑制11β-HSD1具有显著的神经保护作用。
BVT-14225是Biovitrum公司开发的BVT系列11β-HSD1抑制剂之一,目前糖尿病的非临床研究已证明,BVT系列试剂对11β-HSD1还原活性具有显著的抑制作用[23-24],且与其药理作用相似的类似物已进入临床Ⅱ期试验。本实验首次确证NSC上存在11β-HSD1,且以还原活性为主,所以本研究以BVT探讨抑制NSC 11β-HSD1还原活性对NSC增殖、分化以及迁移的影响。UPLC-MS实验结果表明,BVT可显著抑制11β-HSD1的还原活性。并且LDH释放实验和Western印迹实验结果证明,本实验浓度的BVT不产生细胞毒性且不改变11β-HSD1蛋白表达水平。因此,结合EdU实验、免疫荧光染色实验和划痕实验结果可知,在糖皮质激素浓度显著升高时,BVT可通过抑制NSC 11β-HSD1的还原活性促进NSC的增殖和迁移,但不影响其分化,从而缓解过高浓度糖皮质激素对NSC的损伤。
综上所述,BVT或其衍生物在未来是值得的药物开发的靶点,用于降低胎儿围术期或病理环境下局部糖皮质激素的浓度,以缓解过高浓度糖皮质激素对NSC的损伤作用。但本研究均是在离体细胞中进行的,尚未在动物实验中进行验证。因此还需要一系列的动物实验及临床试验进行验证。

