转运体介导中药与化学药相互作用研究进展
王静静 ,江振洲 ,3,张陆勇 ,黄 鑫 ,3
(中国药科大学1.药物科学研究院,2.江苏省新药筛选重点实验室,3.药物质量与安全预警教育部重点实验室,江苏 南京 210009;4.广东药科大学药学院新药筛选与药效学评价中心,广东 广州 510006)
药物相互作用是指同时或贯序使用2种及2种以上药物时,药物的药效学或药动学发生变化的现象。而药物相互作用的评估常涉及以下几个方面:①非临床和体外实验的预测;②临床试验的评估;③以相关模型评价药物相互作用产生的可能性[1]。在这一过程中,人们往往从代谢酶和转运体的角度对其相互作用的可能原因作出解释。
转运体是位于细胞膜上的一类转运蛋白,可介导内源性物质和外源性药物及其代谢物进出细胞,分布在小肠、肝、肾、脑组织及一些生殖器官中细胞的顶侧膜或基底侧膜上(图1),专司各类物质的跨膜转运[2-3]。按转运方式可将转运体分为2类:一类为原发性主动转运型,以三磷酸腺苷结合盒(ATP-binding cassette,ABC)为代表,主要包括P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multi⁃drug resistance-associated protein,MRP)和乳腺癌耐药相关蛋白(breast cancer resistance protein,BCRP)等;另一类为继发性主动转运型或促进扩散型,主要为溶质载体转运体(solute carrier trans⁃porter,SLC),主要包含有机阴离子转运多肽(organic anion transporting polypeptide,OATP)、有机阴离子转运体(organic anion transporter,OAT)、有机阳离子转运体(organic cation transporter,OCT)和寡肽转运体(oligopeptide transporter,PEPT)等[4-6]。转运体底物具有广泛的重叠性和多样性。如他汀类药物既是BCRP和MRP的底物,也是OATP的底物[1],这增加了此类药物与他药产生药物相互作用而增强药物疗效的可能性,但也增加了联合用药产生药物不良反应的风险。在转运体介导的药物相互作用中,研究较多的是P-gp,BCRP,OATP,OAT和OCT。FASINU等[7]研究发现,用于治疗获得性免疫缺陷综合征(acqired immuno defi⁃ciency syndrome,AIDS)的草药苏合兰(Suther⁃landia frutescens)可显著抑制P-gp,OATP1B1和OATP1B3对底物的摄取,当抗病毒类药物用于AIDS患者时,应避免选择上述转运体底物。
在药物相互作用中,代谢酶与转运体的作用不容忽视,当联用药物共同为代谢酶/转运体的底物、抑制剂或激动剂时,就有出现药物相互作用的可能性,可能会对药物的疗效和毒副作用产生干扰(图2)。中药与化学药的相互作用(herb-drug interaction,HDI)与药物相互作用类似,也会出现几种常见结果:①当两种药物都是某代谢酶/转运体底物时,可能会存在竞争性摄取或外排,导致两药的摄取和外排均有一定程度的降低;②当一种为其底物,而另一种为其抑制剂时,可能会出现底物药物的摄取或外排降低;③当一种为其底物,而另一种为其激动剂时,可能会出现底物药物的摄取或外排升高[8]。但因中药本身所含组分相对复杂,很多成分至今还不为所知,且中药多以副作用小的优点广泛被人们接受[9],加之中药替代疗法的不断引入,中药与化学药联用也日渐进入人们视野。HDI中,细胞色素P450(cytochrome P450,CYP450)酶的重要作用已有不少学者进行了总结归纳。本文着眼于P-gp,BCRP,OAT,OCT和OATP等5种美国食品药品监督管理局(Food and Drug Administra⁃tion,FDA)建议进行药物相互作用研究的转运体,探究它们在HDI中的作用,以阐明转运体在其间的作用,对联合用药过程中可能的效果作出预估,提高药物联用的效率。

图1 肠(A)、肾(B)、肝(C)和脑(D)中转运体分布.OCT:有机阳离子转运体;OST:有机溶质转运体;MRP:多药耐药相关蛋白;OATP:有机阴离子转运多肽;PEPT:寡肽转运蛋白;ASBT:顶膜钠依赖性转运体;MCT:单羧酸转运体;BCRP:乳腺癌耐药转运体;P-gp:P-糖蛋白;OAT:有机阴离子转运体;URAT:尿酸盐转运体;MATE:毒素外排蛋白;OCTN:肉碱/有机阳离子转运体;BSEP:胆盐输出泵.
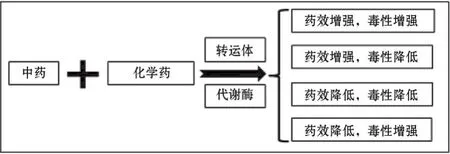
图2 中药与化学药联用可能产生的结果.
1 P-糖蛋白
P-gp是药物相互作用中研究最多的转运体,也是ABC转运体家族的代表性转运蛋白,其底物通常是疏水性的阳离子[3],具有极普遍的广泛性。临床上常用的药物,如免疫抑制剂环孢素A、他克莫司和伊维菌素等,抗癌药多柔比星、长春新碱、长春碱、紫杉醇和伊马替尼等,HIV蛋白酶抑制剂利托那韦和茚地那韦等均与P-gp相关,并通过其完成药物原型及其代谢物的外排[10]。临床上广泛用于心血管疾病治疗的地高辛是P-gp的典型底物。LI等[11]发现,大黄素使地高辛的药时曲线下面积(the area under the concentration-time curve,AUC0-τ)升高0.51 倍,18 β-甘草次酸(18 β-glycyrrhetic acid,18 β-GA)使地高辛的最大血药浓度(the maximum plasma concentration,Cmax)升高0.58倍。而大黄素(50 μmol·L-1)和 18 β-GA(50 μmol·L-1)对 P-gp的抑制效果分别为93.9%和83.9%。表明P-gp被抑制或诱导都可能会引起HDI,甚至会使得系统暴露量发生不可估量的变化,尤其是对于治疗窗较窄的药物。氯吡格雷是临床上用于治疗心血管疾病的常见药物,早期实验发现,其在体内发挥药效作用的是其代谢物,主要经CYP2C19调节[12]。同时,CHEN等[13]研究表明,氯吡格雷与常用于心血管疾病的灯盏生脉胶囊(Dengzhan Shengmai capsule,DZSM)联合使用时,氯吡格雷的Cmax,AUC0-τ和AUC0-C均出现明显的上升趋势,而其活性代谢物却出现完全相反的结果。氯吡格雷在体内的吸收受限于P-gp,而其代谢物的产生与CYP450相关,表明在此过程中转运体和代谢酶共同起作用。转运体和代谢酶不仅会影响药物的吸收、分布、代谢和消除(absorption,distribution,metabolism and ex⁃cretion,ADME)过程,对于药物的毒副作用也有较大的影响。如临床广泛用于类风湿性关节炎治疗的雷公藤多苷,其主要有效成分之一的二萜类生物碱雷公藤甲素(triptolide,TP)会导致严重肝毒性,并且肝毒性的产生被认为是P-gp与CYP3A4共同介导的,当TP与P-gp抑制剂联合使用时,TP肝毒性显著增强[14-16]。由此提示,临床使用过程中应避免雷公藤多苷与P-gp抑制剂联用,尤其是肝功能不全患者。在新药研发过程中,可将P-gp作为一个切入点,若发现P-gp的抑制剂,应避免与P-gp典型底物进行联用,或是考虑二者联用后,可能减少底物外排而增强其有效血药浓度维持时间的延长,从而增强患者的良好依从性。
本文总结了P-gp介导的HDI的体内研究,主要表征了药物在体内的ADME过程的变化,以反映转运体P-gp在其中的重要作用(表1)。
2 乳腺癌耐药相关蛋白
BCRP是ABC转运家族的另一常见转运体,由ABCG2基因编码,其对药物在体内的ADME过程有着不可替代的作用[27]。阿巴卡韦、拉米夫定及部分抗癌药如多柔比星(阿霉素)和二羟蒽二酮的外排均与其相关[28]。据研究报道,当二羟蒽二酮与含异戊二羟基黄酮类化合物的啤酒花联合使用时,后者使二羟蒽二酮的细胞内蓄积量较单独使用时增加了1.4~1.6倍[29]。而主要成分为异戊二烯基类黄酮的中草药是ABCG2的有效抑制剂,ABCG2介导的异戊二烯类黄酮的外排可能是改变该类药物生物利用度的一种机制[29]。
瑞舒伐他汀(rosuvastatin,RST)是多种转运体的底物,如OATP1B1,OATP1B3,OATP1A2,BCRP,NTCP和CYP。将乌索酸或丹参素预先15 min给药后再给予大鼠RST,RST的药动学参数Cmax,AUC0-τ和AUC0-C均较单独使用时升高≥2倍,而总清除率(Clz)/F则下降约57%,提示乌索酸或丹参素对RST的药物代谢产生了显著影响,并且这种相互作用的产生极可能是以上转运体中的一种或几种参与其中所致[30]。RST与丹参(tanjin)在健康志愿者中联用时,RST的Cmax和AUC0-12h较单独使用时分别下降了26.9%和19.4%;而给大鼠联用时,其血药浓度在15,30和45 min时分别降低了84.4%,64.4%和50.0%,tanjin可能上调了小肠的BCRP的表达,表明tanjin通过加速外排而抑制了瑞舒伐他汀的吸收,并且这种抑制效果的产生部分是由于小肠上分布的BCRP的上调导致的[31]。

表1 P糖蛋白在中药与化学药联用过程中ADME过程变化汇总
BCRP作为介导药物外排的重要转运体之一,其介导的药物相互作用对底物药物毒性和效用作用关键,在实际临床应用中可根据此将毒性较大的BCRP底物药物与BCRP的激动剂联用以加速其外排,而对药效较强的药物,可以通过和BCRP抑制剂联用以延长其有效血药浓度维持时间。外排转运体影响了药物离开靶器官的速率,故而在药物联用过程中其可能发挥的作用也是应当关注的重点。
3 阴离子转运多肽
OATP属于SLC家族的重要转运体,包含多种亚型,在肝、肾、肠和脑表达较多,OATP的底物转运通常是钠离子和pH值依赖性的[32]。与其相关的药物不胜枚举,如RST、匹伐他汀等他汀类和非索非那定等药物都是OATP的常见底物[33]。在OATP存在较多的亚型中,OATP1B1,OATP1B3和OATP2B1研究较多,因此本文对该3种亚型介导的HDI进行分别阐述。
3.1 OATP1B1和OATP1B3
OATP1B1和OATP1B3主要表达于肝的血窦膜侧[34],能调节较多药物在肝内的摄取[35]。如白鹤灵芝类物质(rhinacanthin-C)可显著抑制OATP1B1(IC50=0.7 μmol·L-1)和 OATP1B3(IC50=3.95 μmol·L-1)对底物的摄取功能,同时还可抑制多种CYP450酶的活性和功能,在临床联用过程中可能会对某些特异性药物产生干扰,具有发生HDI的可能性[36]。另有研究表明,匹伐他汀以西柚汁进行口服时相对于以水口服,健康受试者体内匹伐他汀酸和匹伐他汀内酯的Cmax均下降约14%,且其AUC0-24h,AUC0-48h,AUC0-τ和AUC0-C均呈现显著性升高,表明西柚汁中某些成分对匹伐他汀的体内过程存在影响,而这一作用的产生与基因SLCO1B1 388A>G多态性相关[37],提示OATP1B1在西柚汁与匹伐他汀联用过程中起到了关键作用。因此,在临床用药过程中,应要求患者以水送服,避免药物不必要的体内过程的改变。
3.2 OATP2B1
OATP2B1是肠上皮细胞和肝细胞中分布广泛的一类转运体,与药物的肠吸收和肝代谢摄取密切相关[38]。而与其相关的药物相互作用的报道中,西柚汁、橙汁和苹果汁的研究较多,因其中含有的黄酮类成分是OATP2B1的抑制剂,因此口服药物在服用时应避免用西柚汁等果汁送服[39-40]。如SHIRASAKA等[41]指出,OATP2B1底物雌酮-3-硫酸与3种果汁中的任一种联用时,高表达OATP2B1的卵母细胞(oocytes-OATP2B1)对雌酮-3-硫酸的摄取量显著减少,将果汁中含有的黄酮类成分进行单独摄取时,柚苷和橙皮苷对底物雌酮-3-硫酸的摄取呈现显著性抑制,并且存在浓度依赖性。该结果进一步表明果汁中黄酮类成分的干预作用。在他汀类药物瑞舒伐他汀、阿托伐他汀和氟伐他汀与临床血药浓度相当的绿原酸、甘草次酸、桑皮黄素、槲皮素以及黄芩素联合应用的OATP2B1-HEK293细胞摄取实验中,3种他汀类药物的摄取量较单用的摄取量均显著减少[43],表明OATP2B1参与该过程且可能会与OATP2B1底物发生HDI。
OATP2B1在肠上皮细胞广泛分布,在药物吸收过程中的作用不可小觑,OATP2B1的基因表达和功能表达对该转运体底物的吸收速度和效率存在一定的干扰。因此,当药物与OATP2B1存在依存关系时,OATP2B1介导的药物相互作用应作为考虑因素之一来选择合适的联用药物。
OATP1B1,OATP1B3和OATP2B1在肝和肠表达较强,其位置和功能决定了它们可能会对药物的代谢产生影响,可协同CYP450酶共同起作用,若是药物代谢减慢,可能会导致药物在肝聚积导致严重的肝毒性,福辛普利钠和曲美替尼等产生的高胆红素血症和肝毒性可能就是OATP被抑制产生的[43]。因此,OATP的体内表达应引起足够重视,与其相关的药物联用也应进行适当的体内外考察,以避免增加一些药物不良反应发生的概率。
4 有机阳离子转运体
OCT属于SLC22家族,主要表达于肝、肾细胞基底侧膜上,参与调节阳离子和药物的体内药动学过程[44]。OCT1在肝高表达,OCT2在肾表达明显,而OCT3主要在骨骼肌和胎盘有表达,介导药物的跨膜转运,包括H2受体拮抗剂雷尼替丁、降糖药二甲双胍、抗肿瘤药奥沙利铂,还包括一些内源性物质,如维生素B1、组胺和去甲肾上腺素等[45-46]。SHAMS等[47]指出,白屈菜红碱有潜力改善肥胖患者服用庆大霉素过程中并发的肾毒性,因其能通过OCT2抑制肾小管上皮细胞对庆大霉素的摄取,避免庆大霉素在肾蓄积致毒。红色车轴草的主要成分芒柄花黄素属于异黄酮类中草药。HUANG等[48]研究发现,芒柄花黄素能够下调OCT2的表达,同时上调MRP的表达而降低顺铂在肾内的蓄积,以降低其急性肾损伤后对肾的进一步毒性。
上述结果提示,可利用转运体的桥梁,尝试采用联合用药的方式降低药物的毒副作用,这为临床开具处方提供了一种逆行思路,有助于患者的耐受性和良好依从性,以减轻患者痛苦,使患者尽快痊愈。同时,当药物产生严重肝、肾毒性时,可考虑在此过程中OCT转运体是否会发生变化,或许OCT可作为肝、肾毒性产生的靶点之一,通过药物联用逆转OCT表达的变化以达到减轻药物肝、肾毒性的目的。
5 有机阴离子转运体
OAT与OCT一样,同属于SLC22家族,主要参与转运小分子物质,包括两亲性的有机阴离子、不带电的分子,甚至是一些有机阳离子[49],主要表达于肾近曲小管上皮细胞的基底侧膜上,是转运药物进入肾小管上皮细胞的第一层媒介[50]。因此其介导的药物相互作用主要与肾排泄相关。如丹参的成分紫草酸、迷迭香酸和丹参素对OAT1的底物对氨基马尿酸和OAT3的底物雌酮硫酸盐产生≥70%的抑制效果,并且混合物呈现更明显的抑制结果[51]。由此提示,OAT底物与丹参素联合使用时,可能会影响OAT1/3底物的肾排泄,进而造成血液或是其他脏器组织的药物蓄积,带来隐患。LU等[52]研究了172种中草药提取物,并以OAT1和OAT3底物6-羧基荧光素进行相互作用的研究,发现30%的中草药提取物都对其有显著的抑制效果,在进行药物联用时,要考虑OAT3表达变化带来的相互作用。在灯芯草与OAT1/3底物呋塞米相互作用的药动学实验中,相比呋塞米单独使用的情况,口服联合时其AUC0-τ和AUC0-C分别升高了2.31和0.81倍,静脉联合时AUC0-τ和AUC0-C分别升高了0.25和0.55倍;并且2种给药方式下,呋塞米的表观分布容积(Vz-obs)和清除率(Clobs)均出现下调趋势[52]。因此,灯芯草与OAT1/3底物联用时,应注意潜在药物相互作用的存在,可能会对底物药物的排泄产生干扰而延长药效或增强毒性。同时,LIU等[53-54]指出,甲氨蝶呤,临床用于类风湿性关节炎的一线用药,40%~90%以原型经肾排泄,且OAT1和OAT3在其排泄过程中发挥重要作用,当其与OAT1/OAT3抑制剂白藜芦醇或大黄酸联用时,其肾毒性明显改善。由此提示,OAT1/3的下调可能是甲氨蝶呤等底物的一种毒性机制,可利用两药联用来减轻肾毒性,这为临床用药提供了一定的理论指导。
OAT在药物由血入肾过程中发挥作用,对药物的血药浓度和排泄速率均存在一定影响,联用过程中药物的治疗窗应严格监视,以降低无效治疗发生的概率。
SLC介导的中药-化学药相互作用汇总见表2。
6 结语与展望
转运体和CYP450酶之间有较大的相似性,CYP450酶主要分布在肝,并参与药物的转化,而转运体广泛分布于各组织脏器的细胞膜,协助完成药物的跨膜转运。在HDI过程中,药物药动学发生变化的过程通常是CYP450酶和转运体被抑制或诱导产生的,且这种诱导或抑制通常受其上游核受体[63],如法尼醇X受体(farnesoid X receptor)、肝X受体(liver X receptor)、视黄酸X受体(retinoid X receptor)和过氧化物酶体增殖物激活受体等的调控。另一方面,越来越多的学者探讨转运体在药物毒性发生发展过程中的作用,并试图采用药物联用的方式逆转毒性状态下转运体的变化,从而达到联用减毒的效果。
药物与CYP450酶之间关系的研究多采用肝微粒体或肝原代细胞,与转运体间关系的研究多采用高表达转染细胞,并在此基础上研究底物药物的药动学过程的变化,评价CYP450酶和(或)转运体在HDI中的角色。这有助于对HDI的结果做出更好的预测,对于机制的研究有助于了解CYP450酶和(或)转运体发生变化的可能通路,以更好地阻断药物带来的不利变化。通过体内外数据和计算机模拟HDI发生的可能性和结果,可为临床提供更有利的合理用药的理论依据,降低HDI产生不良反应的概率。未来研究中,不同疾病状态下的CYP450酶和(或)转运体的表达变化可能会改变临床联用药物的选择,了解药物联用过程中CYP450酶和(或)转运体的作用有利于临床联用方案的及时调整。关注CYP450酶和(或)转运体在HDI的作用可为临床合理用药可提供强有力的科学指导。
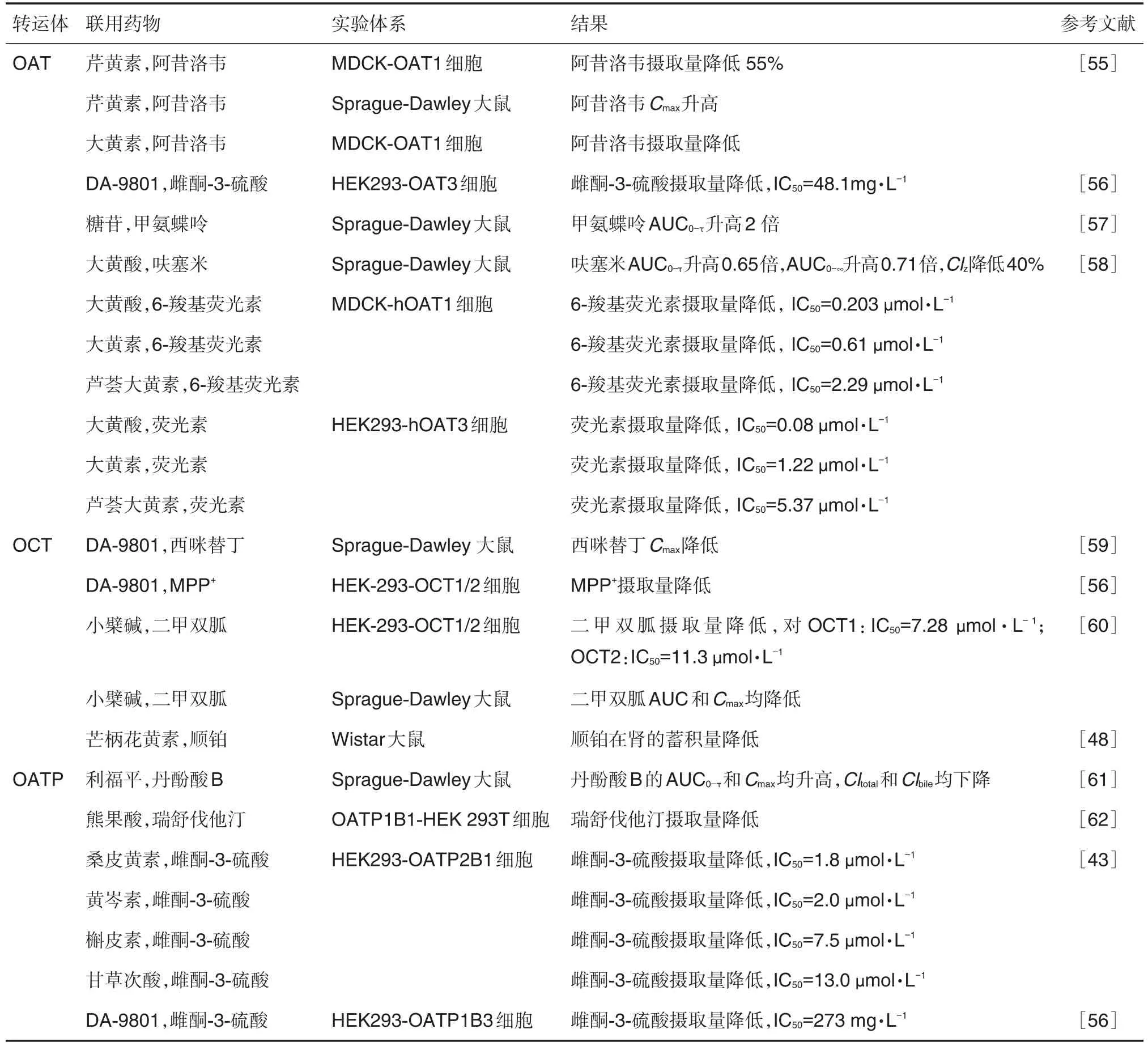
表2 溶质载体转运体(SLC)介导的中药-化学药相互作用

