肺混合性鳞状细胞和腺性乳头状瘤4例临床病理分析
郑时玉 周新成 石国儿 邓茜 李海莉 郭亚男 陈洁
肺混合性鳞状细胞和腺性乳头状瘤(mixed squamous cell and glandular papilloma,MSCGP)是一种极其罕见的肺部肿瘤。截止2019年8月英文文献共报道20例,中文文献共报道10例,且多为个案报道。如果对本疾病认识不足,尤其是在活检及冷冻切片诊断中,会很容易造成误诊,进而影响患者治疗。本文现报道收治的4例肺MSCGP患者,并结合相关文献探讨肺MSCGP的临床及病理学特征。
1 资料和方法
1.1 一般资料 选取2016年至2019年宁波市第二医院收治的4例肺MSCGP患者,其中男2例,女2例,年龄 53~70(57.5±7.2)岁;分别以咳嗽 1 个月、胸痛 1 周、体检发现肺结节3、5个月入院就诊。CT检查显示肺内见结节状高密度影,边界较清或不清,可呈分叶状,远端肺实质伴节段肺不张或实变,肿块局部与胸膜粘连1例(图1),抗感染3、5个月后肿块未见明显改变2例,影像学检查考虑肺恶性肿瘤2例。男性吸烟患者1例,吸烟30年,约2支/d。行肺楔形切除2例,肺叶切除2例。出院后随访2~30个月,均无复发及转移。

图1 肺混合性鳞状细胞和腺性乳头状瘤的CT表现
1.2 病理检查方法 切除标本经10%中性甲醛溶液固定,常规石蜡包埋,4 μm厚切片,HE染色。免疫组化染色采用EnVison两步法,所有一抗、二抗及二氨基联苯胺显色剂均为福州迈新生物技术开发有限公司产品,选用抗体包括广谱细胞角蛋白(CK-pan)、波形蛋白(Vimentin)、细胞角蛋白 5/6(CK5/6)、抑癌基因 p63、p40、细胞角蛋白 7(CK7)、甲状腺转录因子-1(TTF-1)、天冬氨酸肽酶A(Napsin A)、增殖细胞核抗原Ki-67。免疫组化以PBS代替一抗为阴性对照,以已知的阳性对照片为阳性对照,切片均经3位主任医生阅片,确保结果真实可靠。以肿瘤细胞胞质/细胞膜/细胞核内出现棕黄色颗粒为阳性,无着色为阴性。
2 结果
2.1 巨检 4例肺MSCGP患者的肺肿瘤分别位于左上肺、左下肺、右中肺及右下肺,其中右下肺者见结节2枚;肿瘤体积最大者为5.0 cm×4.0 cm×3.0 cm,最小者0.7 cm×0.5 cm×0.5 cm,其中质地硬1例,界不清1例,伴黏液感2例;肿瘤最大者周围肺组织伴不同程度的实变。
2.2 镜检 肺MSCGP分为两种组织学结构,组织学结构一(图2a-c,插页):3例患者肺肿瘤位于扩张的小支气管或细支气管腔内,局灶延伸至肺泡腔;肿瘤与肺组织界限较清,局灶呈乳头状生长,乳头轴心为纤维血管组织伴急、慢性炎细胞浸润;被覆鳞状上皮及腺上皮,与正常的支气管上皮相移行,腺上皮分别为假复层纤毛/非纤毛立方及柱状细胞,部分为黏液柱状细胞,均见基底细胞,鳞状上皮及腺上皮可见移行,有类似腺上皮鳞化的过程;腺上皮有时会形成乳头或微乳头,并延伸脱落至邻近的肺泡腔,2例患者见黏液渗出。组织学结构二(图2d,插页):1例患者可见位于肺外周部边界清楚的2枚小结节,直径为0.7、0.8 cm,位于支气管腔外,排列呈乳头状结构,乳头状结构表面被覆腺上皮,乳头轴心大部分为鳞状上皮,此组织学结构罕见。4例患者被覆上皮均未见异型、核分裂象及坏死。周围肺组织肺泡间隔稍增宽,可见炎细胞浸润,肺泡腔内充满粉染渗出液。
2.3 免疫组化 4例患者肿瘤细胞均表达CK-pan,鳞状上皮及基底细胞均表达p63、p40、CK5/6,所有肿瘤细胞均不表达Vimentin、Napsin A,Ki-67增殖指数<5%,组织学结构一中的3例患者鳞状上皮及腺上皮均表达CK7及TTF-1,组织学结构二中的1例患者仅腺上皮表达 CK7及 TTF-1(图 3,插页)。

图2 肺混合性鳞状细胞和腺性乳头状瘤常规病理检查所见[a:肿瘤位于扩张的细支气管腔内(HE染色,×40);b:肿瘤呈乳头状生长,被覆腺上皮及鳞状上皮,见黏液柱状细胞(HE染色,×40);c:腺上皮形成乳头或微乳头,并脱落至邻近的肺泡腔,易误诊为腺癌(HE染色,×100);d:肿瘤排列呈乳头状结构,乳头状结构表面被覆腺上皮,乳头轴心大部分为鳞状上皮(HE染色,×40)]
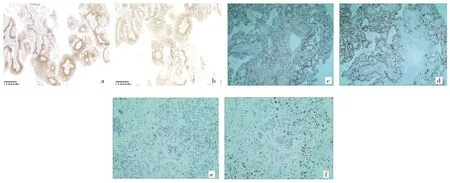
图3 肺混合性鳞状细胞和腺性乳头状瘤免疫组化检查所见[a、b:组织学结构一分别表达p63、甲状腺转录因子-1(×40);c、d:组织学结构二分别表达p63、甲状腺转录因子-1(×40);e、f:组织学结构一类似浸润性区域表达p63及甲状腺转录因子-1(×100)]
3 讨论
肺孤立性乳头状瘤是一种少见的肿瘤。1998年,Flieder等[1]将肺孤立性乳头状瘤分为鳞状上皮乳头状瘤、腺性乳头状瘤及MSCGP,其中肺MSCGP最少见(约占15%);患者发病年龄11~75岁,中位年龄58岁,男女比例约2∶1[1-10];而本文患者2例男性,2例女性,平均发病年龄57岁;可以推测本病好发于中老年人。
Flieder等[1]根据生长部位将乳头状瘤分为中央支气管内型及周围细支气管型。文献报道肺MSCGP多为中央型MSCGP,少部分为周围型MSCGP[1-10]。本研究报道3例为周围型MSCGP,其中2例位于细支气管腔内,1例位于细支气管腔外。中央型MSCGP支气管镜下MSCGP可形成疣样或菜花状肿块,但有时仅表现为支气管黏膜肿胀,CT检查结果未见异常表现[2]。显微镜下3例患者可见乳头状病变位于支气管内,被覆柱状上皮及鳞状上皮,且与正常的支气管黏膜上皮相延续,部分周围型病变,乳头延伸脱落至肺泡腔,部分患者黏液细胞较多,可形成黏液湖,容易误诊。1例患者肺肿瘤位于支气管腔外,排列呈乳头状结构,乳头状结构表面被覆腺上皮,乳头轴心大部分为鳞状上皮,考虑起源于化生的细支气管。Yabuki等[3]报道了1例非支气管来源的MSCGP,肿块最大径为11 cm,位于胸膜下,镜下显示病变主要沿着纤维化的肺泡间隔及化生的细支气管生长,由此推测肿瘤可能起源于化生的细支气管。Kadota等[4]首次对1例MSCGP患者进行细胞学报道,支气管刷检细胞学显示鳞状上皮轻度不典型增生,柱状细胞核无不典型增生。
有研究发现1例72岁吸烟男性肺MSCGP中抑癌基因p16 Ink4a阳性表达[5],多位学者对肿瘤细胞中的HPV进行检测,结果均未发现HPV感染的证据[6-8]。Huang等[9]首次在18岁非吸烟男性MSCGP患者中检测出HPV阳性及鼠类肉瘤滤过性毒菌致癌同源体B基因变异,由此推测HPV感染及鼠类肉瘤滤过性毒菌致癌同源体B基因变异可能在年轻非吸烟患者的发病中起到一定的作用。有文献报道肺MSCGP吸烟者占比超过50%,因此笔者推测肺MSCGP的发生、发展与吸烟具有一定的关系[8]。
肺MSCGP需要与下列肿瘤鉴别[6]:(1)腺癌:MSCGP腺上皮有时会形成乳头或微乳头,并延伸脱落至邻近的肺泡腔,容易误诊为乳头或微乳头型腺癌,当富含黏液细胞时,易误诊为黏液腺癌;腺癌细胞有异型性,无基底细胞,p40及CK5/6阴性。而MSCGP未见细胞异型性,可见基底细胞,p40及CK5/6阳性。(2)黏液表皮样癌:由表皮样细胞、产黏液细胞及中间型细胞组成的恶性肿瘤,边界不清,表皮样细胞缺少细胞间桥及角化,未见假复层纤毛/非纤毛柱状上皮;而MSCGP边界较清,鳞状上皮可见细胞间桥及局灶角化。(3)纤毛黏液结节性乳头状肿瘤:由纤毛柱状细胞、黏液细胞及基底细胞组成的乳头状肿瘤,与MSCGP在细胞构成上类似;但是MSCGP主要发生在支气管腔内,可见与支气管黏膜上皮延续,并可见鳞状上皮;纤毛黏液结节性乳头状肿瘤主要发生在肺的周边部(支气管外),未见鳞状上皮。(4)细支气管鳞状上皮化生:鳞状上皮化生与MSCGP鳞状细胞区域类似,但MSCGP在结构上更加复杂,可见乳头状结构,CT检查结果可见孤立性的结节;而鳞状上皮化生常常仅在纤维镜下可见,不形成占位性病变。
肺MSCGP一般通过肺楔形或肺叶切除可以达到根治目的。但Fabrice等[2]报道了1例发生在右主支气管的MSCGP,仅支气管镜下见黏膜肿胀,该病变经支气管镜下的电切术切除,随访2年无复发。MSCGP也可发生恶变,Lagana等[10]2011年报道了1例起源于周围型MSCGP的多形性癌(梭形细胞和鳞状细胞癌)。Stavros等[8]报道了1986年至2008年收集的5例肺MSCGP病例,其中2例恶变为腺癌和低级别癌。因此就目前的病例报道及随访资料并不能掌握其长期的生物学行为,需要收集更多的病例及随访资料以获得更准确的结论。肺MSCGP是良性肿瘤还是具有恶性潜能的肿瘤有待进一步讨论。

