1 株犊牛源多重耐药大肠杆菌分离株的ESBLs 与AmpC β-内酰胺酶表型检测
刘一飞,王志宇,刘华栋,马 馨,张伟业,孙仰介,薛俊龙,刘泽民
(山西农业大学动物医学学院,山西太原030032)
犊牛腹泻是养牛场中频发的常见疫病,急性腹泻通常会导致犊牛产生系统性败血症,甚至死亡,而致病性大肠杆菌(Escherichia coli)及其他致病性病原微生物感染是造成犊牛腹泻的最主要原因。近年来,由于抗生素类药物在养殖业中的长期不规范使用,各种耐药性大肠杆菌菌株在临床检验过程中不断被发现,而超广谱β- 内酰胺酶(Extendedspectrum beta-lactamases,ESBLs) 和头孢 菌素 酶(AmpC enzyme)的产生是临床分离病原菌株呈现多重耐药性(mult-drug resistance,MDR)的重要机制之一[1-2]。当前,产ESBLs 和AmpC 病原菌已在多种家畜中普遍流行。迄今为止,国内外已有较多涉及家禽、猪、牛及伴侣动物源产ESBLs 和AmpC 酶大肠杆菌的相关报道[3-5]。其中,ESBLs 主要由肠杆菌科(Enterobacteriaceae)耐药质粒(R plasmid)介导的β- 内酰胺酶基因衍化而来,具有水解β- 内酰胺类抗生素如青霉素和氨基青霉素的活性,但不能水解头霉素类和碳青霉烯类药物。ESBLs 活性可被抑制剂如克拉维酸(clavulanate,CLA)显著抑制。ESBLs的各基因型主要分为blaTEM、blaSHV、blaCTX-M等[6],其中,产blaTEM型β- 内酰胺酶大肠杆菌在我国家畜中流行最为普遍[7-8]。近几年,国内有关肠杆菌科AmpC β- 内酰胺酶的报道日益增多[7,9]。AmpC 酶基因几乎存在于所有肠杆菌科细菌中,通常是由染色体介导表达低水平的AmpC 酶,从而导致革兰氏阴性杆菌对第3 代头孢菌素产生耐药性,该酶活性不能被CLA 所抑制,但可被氨基酸硼酸(3-Aminophenol boric acid,APB)和氟氯西林(flucloxacillin,INN)显著抑制。而在大肠杆菌中,AmpC 酶主要由R 质粒介导产生,且无需诱导即可持续、大量表达[10]。
由于β- 内酰胺酶基因可经由R 质粒、转座子和整合子等方式在细菌间散播[11],因此,有必要对产β- 内酰胺酶病原微生物进行实时检测,以指导临床上合理用药。2019 年初,太原市某奶牛场一头因罹患腹泻死亡的犊牛被送至山西省农业科学院畜牧兽医研究所预防兽医研究室受检。该奶牛场场主描述,使用多种抗生素治疗该病犊后,病情皆无缓解。据此,推测该病犊可能是因耐药性病原微生物感染而导致抗生素治疗效果欠佳。在对病犊剖检过程中发现,其病理特征呈现典型的肠型大肠杆菌病症状,并从病犊肝脏中分离到1 株多重耐药性优势大肠杆菌菌株。经查询文献得知,当前尚未有关于山西省牛源产β- 内酰胺酶大肠杆菌的相关研究报道。
本试验将该犊牛源大肠杆菌分离株分别进行25 种药物的敏感性试验、ESBLs 和AmpC 酶表型筛选以及blaTEM基因型PCR 检测,以了解该分离株的耐药谱和β- 内酰胺酶基因的携带情况,旨在为该养牛场犊牛腹泻的综合治疗推荐敏感药物种类以及为有效防控耐药菌株的传播提供参考。
1 材料和方法
1.1 材料
1.1.1 试验动物 供试动物为山西省太原市某奶牛场送检的因腹泻致死的犊牛1 头,剖检可见病犊真胃存有凝乳块,胃黏膜充血;肝脏苍白有零星出血点;肠内容物混有血液和气泡,小肠黏膜充血,肠系膜淋巴结肿大。病犊的病理剖检呈现典型肠型大肠杆菌病症状。
1.1.2 主要试剂 普通营养琼脂、麦康凯琼脂、M-H 肉汤、M-H 琼脂、LB 肉汤等均购自青岛日水生物技术有限公司;质粒提取试剂盒、TaqPCR Mix、TaqDNA 聚合酶等均购自生工生物工程(上海)股份有限公司;25 种抗菌药物药敏纸片均购自中国兽药监察所;大肠杆菌质控菌株ATCC25922、肠杆菌科编码生化鉴定管以及ESBLs 和AmpC 酶检测试剂盒均购自杭州天和微生物试剂有限公司。
1.2 方法
1.2.1 临床菌株的分离鉴定 无菌条件下取病犊肝脏进行低温研磨,生理盐水稀释后取上清液接种于营养琼脂平板,37 ℃培养12 h,反复接种将分离菌纯化至单个菌落,肉眼观察菌落形态。用接种环挑取圆形、湿润、灰白色、凸起菌落划线转接于麦康凯琼脂平板,37 ℃培养24 h。挑取麦康凯琼脂平板上的单个纯培养粉红色菌落进行涂片、染色、镜检,将符合肠杆菌科细菌形态特征的纯化单菌落分别接种于GYZ-15e 生化编码鉴定管硫化氢、苯丙氨酸、葡萄糖酸盐、靛基质、葡磷胨水、枸橼酸盐、尿素酶、胰蛋白胨半固体、葡萄糖、赖氨酸、鸟氨酸、棉子糖、山梨醇、侧金盏花醇、木胶糖中,37 ℃培养18~24 h,观察并记录各生化反应结果。
1.2.2 大肠杆菌分离株的药物敏感性试验 其按美国临床实验室标准化委员会(CLSI)推荐的肠杆菌科细菌纸片法(K-B)药敏试验标准进行操作和判定。使用25 种常用药物对该大肠杆菌分离株进行药物敏感性试验,将分离菌株接种M-H 肉汤,37 ℃培养4 h,在光度计中比对0.5 麦氏管,用生理盐水将培养菌液稀释到0.5 麦氏单位(1.5×108cfu/mL),用无菌棉棒蘸取菌悬液涂布于M-H 琼脂平板,静置10 min 后将药敏纸片贴于培养基表面。以质控菌株ATCC25922 作为对照,测量各药敏纸片的抑菌直径,以确保药敏结果的准确性。
1.2.3 大肠杆菌分离株的ESBLs 表型检测 运用CLSI 推荐的双纸片协同法(Double-disk synergy test,DDST)对分离菌株进行ESBLs 表型检测。分离株菌悬液制备和涂布M-H 琼脂平板方法同1.2.2,以质控菌株ATCC25922 对头孢菌素和克拉维酸进行质控检测。将头孢他啶(CAZ,30 μg/片)与头孢他啶 - 克拉维酸(CAZ-CLA,30/10 μg/片)、头孢噻肟(CTX,30 μg/片)与头孢噻肟- 克拉维酸(CTX-CLA,30/10 μg/片) 分别对称贴于 M-H 琼脂平板,37 ℃培养12 h。测量各药敏纸片的抑菌圈直径,将头孢他啶- 克拉维酸(CAZ-CLA)抑菌圈直径大于头孢他啶(CAZ)5 mm 以上或者头孢噻肟- 克拉维酸(CTX-CLA)抑菌圈直径大于头孢噻肟(CTX)5 mm以上判定为产ESBLs 阳性菌株。
1.2.4 大肠杆菌分离株的AmpC 酶表型检测 目前,CLSI 还未推荐标准的AmpC 酶表型检测方法。而根据美国临床检验委员会(NCCLS,2000)执行标准设计的APB 阻抑物基法被认为是AmpC 酶表型检测的常规方法[12]。该方法是将2 片头孢他啶(CAZ 1、CAZ 2)间距18 mm 以上贴于M-H 琼脂平板上,另将一片APB 阻抑物纸片贴在其中一片头孢他啶(CAZ 1)附近 4~6 mm 处,分别标记为 CAZ 1、APB(图 2),37 ℃培养 12 h。将 CAZ 1 朝向 APB 的融合抑菌圈直径大于另一单独头孢他啶(标记为CAZ 2)5 mm 以上,且CAZ 1 抑菌环向APB 明显扩大即判定为产AmpC 酶阳性菌株。分离株菌悬液制备和涂布M-H 琼脂平板方法同1.2.2。
1.2.5 质粒介导的blaTEM基因型PCR 检测 将分离菌株接种于LB 肉汤,置于37 ℃培养箱,以180 r/min 振荡培养8 h,按照质粒提取试剂盒操作步骤提取菌株质粒DNA。ESBLsblaTEM基因型PCR 扩增上、下游引物序列分别为:5′- CATTTCCGTGTCGCC CTTATTC-3′和 5′- CGTTCATCCATAGTTGCCTGA C-3′,预计扩增片段长度为 800 bp[13]。PCR 反应体系为:10×Buffer 5 μL,dNTP 4 μL,上游引物 1 μL,下游引物 1 μL,TaqDNA 聚合酶 0.25 μL,质粒 DNA(20~50 ng/μL)2 μL,加 ddH2O 补足至 25 μL。PCR反应参数为:94 ℃预变性 5 min;94 ℃变性 45 s,54 ℃退火 45 s,72 ℃延伸 1 min,共 30 个循环;72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测、纯化后送交生工生物工程(上海)有限公司进行测序。
2 结果与分析
2.1 临床分离株的形态特征和生化鉴定结果

表1 分离菌株生化特性鉴定结果
从病犊肝脏中分离到菌株经纯化培养后,在麦 康凯琼脂平板上生长为圆形、湿润、光滑、中心隆起、直径为1~2 mm 的粉红色菌落(图1-A);革兰氏染色镜检显示,分离菌株为革兰氏阴性菌,短杆状,两端钝圆,单个或成对排列(图1-B)。生化反应结果显示,该分离菌株与大肠埃希菌的生化特性一致,且经GYZ-15e 生化鉴定编码册查知,该分离菌株的鉴定编码为06345。综合分离菌株的形态特征观察和生化鉴定结果,确认该分离菌株为大肠杆菌菌株。所有受试生化试剂和代谢结果如表1 所示。
2.2 大肠杆菌分离株的药物敏感性试验结果
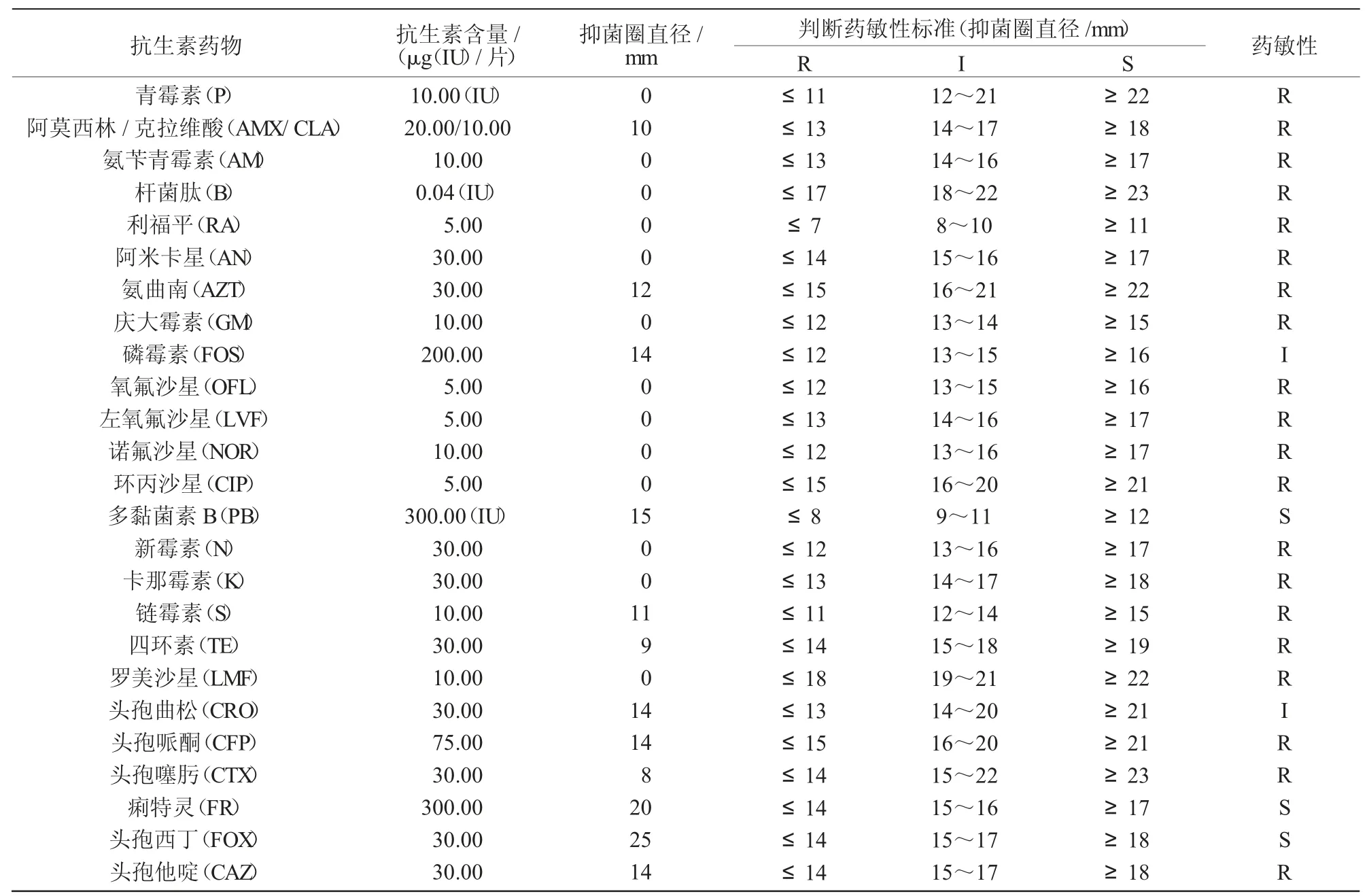
表2 大肠杆菌分离株药敏试验结果
药敏试验结果显示,分离菌株对多黏菌素B、痢特灵、头孢西丁敏感;对磷霉素、头孢曲松中度敏感;而对青霉素、阿莫西林、氨苄青霉素、杆菌肽、利福平、阿米卡星、氨曲南、庆大霉素、氧氟沙星、左氧氟沙星、诺氟沙星、环丙沙星、新霉素、卡那霉素、链霉素、四环素、罗美沙星、头孢哌酮、头孢噻肟、头孢他啶耐药。结果表明,该大肠杆菌分离株为多重耐药性菌株。分离菌株对25 种药物的敏感性试验结果如表2 所示。
2.3 大肠杆菌分离株ESBLs 和 AmpC 酶表型检测结果
分离株ESBLs 表型检测结果显示,CAZ-CLA抑菌圈直径为23 mm,CAZ 抑菌圈直径为14 mm,二者差值为9 mm;CTX-CLA 抑菌圈直径为23 mm,CTX 抑菌圈直径为8 mm,二者差值为15 mm(图2-A),2 组差值均大于5 mm,表明该大肠杆菌分离株为产ESBLs 阳性菌株。分离株AmpC 酶表型检测结果显示,CAZ 1 朝向APB 的融合抑菌圈直径为24 mm,CAZ 2 抑菌圈直径为14 mm,二者差值为 10 mm(图2-B),大于5 mm,且抑菌环向APB 方向明显扩大,表明APB 与CAZ 间产生协同效应,该大肠杆菌分离株为产AmpC 酶阳性菌株。依据β-内酰胺酶表型检测结果,判定该分离菌株为兼产ESBLs 和AmpC 酶的阳性菌株。
2.4 质粒介导blaTEM 基因型测序结果分析
PCR 扩增结果表明,该分离菌株R 质粒中携带有blaTEM基因,进一步证实该分离菌株对β- 内酰胺类药物产生耐药性在一定程度上是由ESBLs 的表达所导致。分离菌株质粒介导的blaTEM基因部分扩增序列如图3 所示。登录NCBI 网站将blaTEM基因测序结果提交Blastn 进行序列同源性在线分析,结果表明,大肠杆菌分离菌株与大肠杆菌HA33 TEM家族blaTEM基因(GenBank 登录号 MN128601.1)、大肠杆菌3E TEM 家族blaTEM基因(GenBank 登录号MN096661.1)的同源性均为100%。
3 结论与讨论
随着抗生素类药物在畜禽养殖中的广泛使用,临床分离到的耐药菌株种类、数量逐步增多,且细菌耐药性不断加重,越来越多的条件致病菌尤其多重耐药性大肠杆菌在畜禽群体间的普遍传播被认为是导致犊牛腹泻发病率和死亡率显著升高的重要因素之一[14-15]。青霉素类抗生素和头孢菌素类抗生素作为治疗大肠杆菌病的常规药物在某些养牛场可能被过度使用。因此,有必要对由大肠杆菌病引起的腹泻牛群进行产β- 内酰胺酶大肠杆菌的临床细菌学检查。在本试验中,从腹泻犊牛肝脏中分离纯化到1 株优势大肠杆菌,该菌株仅对PB、FR和FOX 敏感,其耐药谱数多达20 种,即P/AMX/AM/B/RA/AN/AZT/GM/OFL/LVF/NOR/CIP/N/K/S/TE/LMF/CFP/CTX/CAZ。药敏试验结果证实,该大肠杆菌分离株为多重耐药性菌株,耐药种类几乎涵盖青霉素类、头孢菌素类、氨基糖苷类、氟喹诺酮类、利福平类等临床常用药物,且其耐药谱比同时期新疆自治区牛源大肠杆菌优势耐药谱(氯霉素/四环素/链霉素)[15]和秦皇岛地区牛源大肠杆菌优势耐药谱(林可霉素/庆大霉素/阿米卡星)[16]更为宽泛。本试验受试大肠杆菌分离株的血清型鉴定和致病性试验将在后续试验中开展。
目前,已有多种表型筛选和分子技术应用于细菌β- 内酰胺酶的检测。然而,由于可能出现假阳性结果,常规的纸片协同法检测细菌β- 内酰胺酶表型仅可作为阳性菌株的初步筛选,β- 内酰胺酶的进一步确认还需结合分子检测手段。例如,PCR 扩增和宏基因组测序[17]可检测相关耐药基因;胶体金免疫层析技术[18]和酶联免疫吸附试验[19]可供用于检测抗生素钝化酶。为保证试验结果的准确性,本试验受试大肠杆菌分离株的β- 内酰胺酶检测采用了纸片协同法初筛和PCR 扩增2 种试验方法进行相互验证。其中,纸片协同法的初筛结果表明,该分离株兼产ESBLs 和AmpC 酶阳性菌株;且经PCR 从分离株R 质粒中成功扩增出blaTEM基因片段,由此证实该分离株确实为产ESBLs 阳性菌株。近期有研究表明,在青海和宁夏地区检测到羊源产AmpC 酶大肠杆菌的流行基因型是以质粒介导的blaCIT和blaACC基因型为主[20]。本试验曾对分离株R 质粒介导的AmpC 酶blaCIT和blaACC基因片段进行了PCR扩增,但是并未扩增出相应的目的片段,更多AmpC酶基因型的PCR 检测将于后续试验中进行。目前,有研究也常使用头孢西丁纸片进行产AmpC 酶菌株的初筛,当头孢西丁抑菌圈直径小于17 mm 即被认为是产AmpC 酶阳性菌株[21]。本研究分离菌株的药敏试验结果显示,该分离菌株对头孢西丁敏感,且抑菌圈直径为25 mm,大于17 mm 的临界值点。因此,若以头孢西丁抑菌圈直径标准判断,则该分离株应为不产AmpC 酶的阴性菌株,但这似乎与APB 阻抑物基法检测的阳性结果相互矛盾。由于肠杆菌科细菌染色体上通常携带诱导型AmpC 酶基因,其表达受到一个弱启动子和一个强效衰减子系统的严格调控,通常只在受到外界诱导的情况下才启动低水平表达[22-23]。而由质粒介导的、水平基因转移的和由染色体衍生出来的非染色体AmpC 酶基因无需诱导便可持续大量表达[10,23]。据此推测,该分离株的AmpC 酶基因可能定位于染色体DNA 上,只有少量AmpC 酶得以表达,不足以钝化头孢西丁的抑菌药效,使得分离菌株对头孢西丁表现敏感,但表达的少量AmpC 酶活性却会受到APB 的强烈抑制。因而,运用CAZ 和APB 协同效应检测AmpC酶具有更高的灵敏性和特异性。该推测结果也可在一定程度上解释为何本试验未从分离菌株R 质粒中扩增到AmpC 酶的blaCIT和blaACC基因片段。但R质粒上是否有其他AmpC 酶基因型的存在,仍需进一步检测予以验证。
由于长期受到抗生素的选择压力,耐药细菌不断出现并逐渐在健康家畜中传播,人类亦存在因消费畜产品而被间接感染的风险[3]。因此,如何控制耐药细菌的传播已成为亟待解决的世界性问题。近年来,多项研究表明,中草药可通过消除耐药大肠杆菌的R 质粒、抑制外排泵系统、增加外膜通透性和抑制β- 内酰胺酶活性等方式阻滞耐药大肠杆菌的产生和传播[24-25]。提示将中草药作为常规饲料添加剂会对多重耐药菌株的传播起到一定的抑制作用。
本试验从腹泻犊牛肝脏分离鉴定出1 株优势大肠杆菌菌株。该菌株为多重耐药菌株,对绝大多数常用抗生素药物都产生耐药性,其耐药谱多达20 种,仅对多黏菌素B、痢特灵、头孢西丁敏感,提示该奶牛场可能已成为多重耐药致病菌的贮存库,细菌耐药形势较为严重。该分离菌株为β- 内酰胺酶阳性菌株,且R 质粒中携带有blaTEM型ESBLs 基因。本研究是关于山西省牛源产β- 内酰胺酶大肠杆菌表型检测的首次报道,试验结果将为山西省养殖业开展大规模多重耐药致病菌的流行病学调查提供参考。

