补饲精料对大青山绒山羊瘤胃细菌及产甲烷菌多样性的影响
杨硕,卢洋洋,韦玥瑞,史彬林,娜仁花
(内蒙古农业大学动物科学院,内蒙古 呼和浩特 010018)
内蒙古地区具有丰富的家畜与草场资源,草地畜牧业是该地区重要的经济支柱,也是我国主要的绿色有机畜牧产品生产基地。2016年内蒙地区羊出栏量为5 971.3万只,产绒量为8 498.23 t,分别占全国的19.45%和45.10%[1]。大青山绒山羊作为正在培育的一个肉绒兼用新品种,具有较稳定的遗传性能和较高的生产性能,在内蒙古地区具有不可替代的养殖地位以及经济价值。大青山绒山羊常年以自然放牧为主,然而受冬季寒冷因素影响,该地区牧草枯黄期长,导致放牧条件下绒山羊营养摄入不足,严重影响其产肉和产绒的生产性能。相关研究表明,冬季补饲精料可显著提高欧拉型藏羊日增重,增强过冬度春的能力[2];而且,补饲精料后肉品质及屠宰性能均显著提高[3-4]。因此,在枯草期进行放牧与补饲合理结合,是实现放牧绒山羊营养均衡的主要措施。但是,日粮类型的改变势必会对瘤胃微生物区系产生重要影响。补饲可显著提高放牧羊瘤胃微生物多样性,且瘤胃微生物数量也随着补饲精料后发生显著性变化[5-6]。本研究利用高通量测序技术研究放牧大青山绒山羊瘤胃微生物的多样性以及补饲对瘤胃微生物多样性带来的影响。为研究大青山绒山羊瘤胃微生物(细菌、甲烷菌)多样性提供基础依据。
1 材料与方法
1.1 试验时间与试验地点
试验于2016年11月中旬至12月中下旬,在内蒙古呼和浩特市土左旗大青山种羊场进行。
1.2 试验设计与样品采集
试验选用年龄1岁、体重(38.2±1.6)kg的大青山绒山羊(羯羊)10只,经检疫和驱虫后,饲养观察7 d。试验分放牧组(natural grazing, NG)和补饲组(grazing with supplementary feeding, GS),每组5只。自然放牧组每天10:00至17:00期间在天然草场进行放牧,补饲组在自然放牧的基础上每天18:00补饲精料1次,每只补饲0.5 kg。整个试验期分为预饲期22 d和试验期7 d,共29 d。羊舍环境及饲养管理保持一致。试验结束时禁食12 h后,将瘤胃液样品采集器经羊的口腔、食道插入瘤胃内,进行体外采集瘤胃液,经4层纱布过滤后,迅速投入液氮保存以备DNA提取。
1.3 日粮和牧草营养成分组成
采用划区分点采样方法,采集地面可食用部分的牧草,经粉碎混匀后,采用四分法获得分析样品。补饲的精料购自呼和浩特市新凯饲料厂。主要采食的牧草营养组分及补饲精料营养组分见表1。

表1 绒山羊主要采食牧草的营养水平(干物质基础) %
1.4 瘤胃微生物DNA提取
参照文献[7]提供的珠磨—十六烷基三甲基溴化铵(CTAB)法,提取瘤胃液中总DNA,经酶标仪和琼脂糖凝胶电泳测定每个样品DNA浓度及条带完整性,-20 ℃保存备用。
1.5 荧光定量PCR扩增与Illumina HiSeq测序
以瘤胃微生物总DNA为模板,对16S rDNA V3至V4区进行扩增,建立DNA文库,所用细菌、甲烷菌的通用引物分别为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′); 1106F (F:5′-TTWAGTCAGGCAACGAGC-3′)和1378R (R:5′-TGTGCAAGGAGCAGGGAC-3′)。PCR反应体系:2.5 μL引物(上游引物、下游引物各1.25 μL),12.5 μL 2×Phusion Master Mix,2 μL模板DNA,和8.0 μL ddH2O。反应参数:98 ℃预变性30 s;98 ℃变性10 s;55 ℃退火30 s;72 ℃延伸30 s,35个循环;72 ℃延伸10 min。根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和qPCR定量,文库合格后,使用HiSeq 2500 PE250进行上机测序。
1.6 数据处理与生物信息学分析
利用Uparse 软件对所有样品的全部 Effective Tags进行聚类,以97%的一致性(Identity),将序列聚类,使之成为可执行分类操作单位(Operational Taxonomic Units,OTUs)。用Mothur方法与SILVA的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1),获得分类学信息,并分别在各个分类水平上,使用Qiime软件(Version 1.7.0)计算Chao1、Shannon,使用R软件进行Alpha多样性指数组间差异分析。通过将观察到的OTUs数量除以估计的最大OTUs数量来计算当前的百分比覆盖率。经Excel 2007对放牧组和补饲组样品菌群的相对丰富度进行统计,然后采用SAS 9.2统计软件并进行T检验,以P<0.05作为差异性显著性判定标准。
2 结果与分析
2.1 补饲对放牧条件下大青山绒山羊瘤胃液细菌多样性的影响
经Illumina HiSeq高通量测序和数据质量控制,除去接头序列、低复杂序列和低质量序列后, 两组细菌和产甲烷菌OTUs数以及α多样性见表2。在细菌种水平上,补饲组中Shannon指数低于放牧组,差异极显著(P<0.01),其他OTUs数量和Chaol指数均无显著差异性(P>0.05);在甲烷菌种水平上,补饲精料组OTUs数、Chaol指数显著高于放牧组(P<0.05),Shannon指数差异不显著(P>0.05)。

表2 补饲对放牧条件下大青山绒山羊瘤胃液中微生物多样性的影响
2.2 补饲对放牧条件下大青山绒山羊瘤胃微生物相似性比较分析
对放牧组与补饲组瘤胃微生物在门水平上的相似性利用非加权配对算术平均法(UPGMA)进行聚类分析,结果如图1所示。放牧组大青山绒山羊瘤胃微生物能清晰的与补饲组相区分,即在细菌门水平上(图1A)各放牧组间相似性较高,聚在一起;各补饲组间相似性较高,聚集在一起形成另一簇。同样,在产甲烷菌门水平上(图1B)放牧组与补饲组形成2大簇。该结果说明由补饲引起的日粮品质的改变,对瘤胃内微生物丰度产生了一定的影响。

注:NG,放牧组;GS,补饲组图1 瘤胃微生物门水平上相似性聚类分析
2.3 补饲对放牧条件下大青山绒山羊瘤胃液中细菌多样性的影响
补饲对放牧条件下大青山绒山羊瘤胃液中细菌多样性的影响见表3。大青山绒山羊瘤胃液中细菌在门水平上主要是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)。与对照组相比,补饲组拟杆菌门细菌丰度极显著高于放牧组(P<0.01),而且变形菌门细菌丰度也显著升高(P<0.05),但厚壁菌门细菌丰度显著低于放牧组(P<0.05);放牧组中的互养菌门(Synergistetes)细菌丰度显著高于补饲组(P<0.05);补饲对其他菌门无显著性影响(P>0.05)。
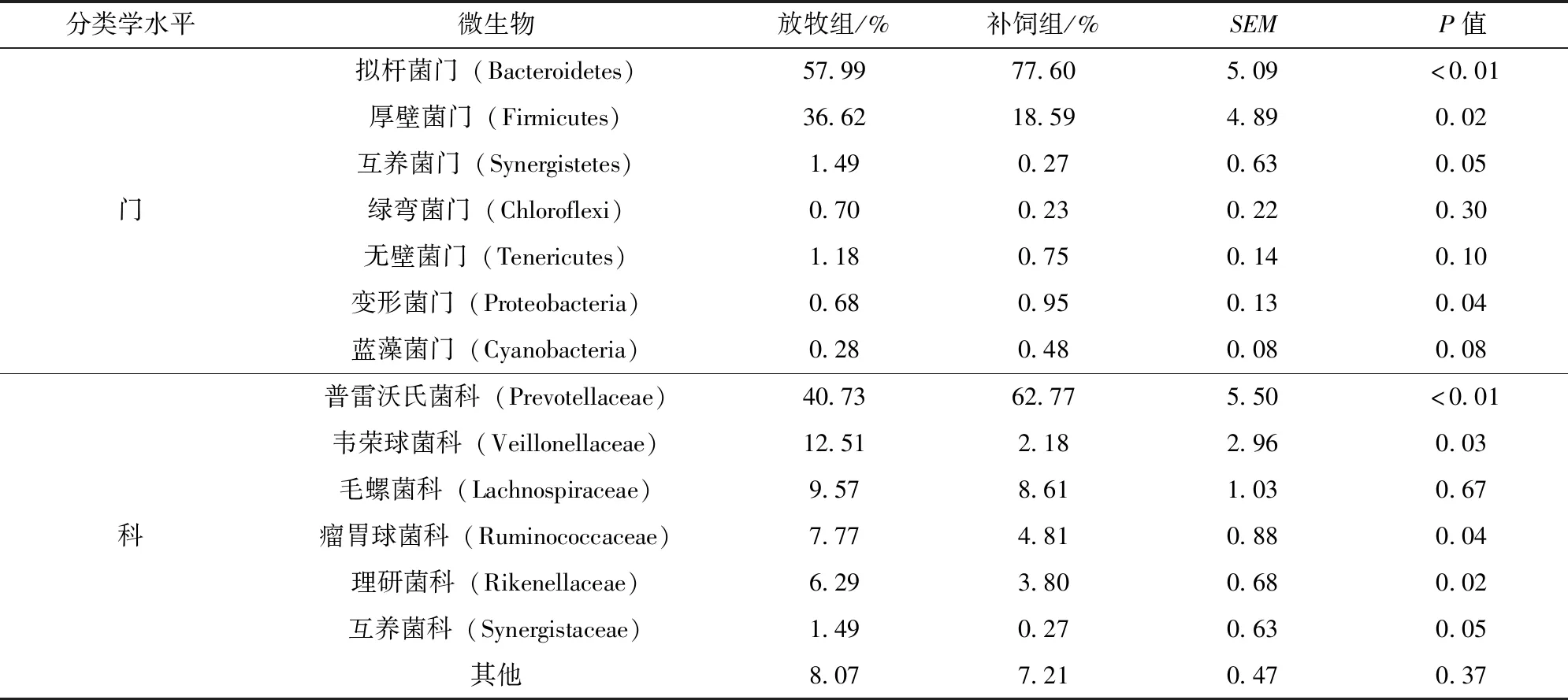
表3 补饲对放牧条件下大青山绒山羊瘤胃细菌菌群丰度的影响(门、科水平)
选取每个样品在科水平上最大丰度排名前6的物种,分别为普雷沃氏菌科(Prevotellaceae) 、韦荣球菌科(Veillonellaceae)、毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、理研菌科(Rikenellaceae)和互养菌科(Synergistaceae)。补饲精料组显著增加了瘤胃液中普雷沃氏菌科细菌丰度(P<0.01),但显著降低于韦荣球菌科、瘤胃球菌科、理研菌科以及互养菌科细菌丰度(P<0.05)。其他菌科间并无显著性差异(P>0.05)。
2.4 补饲对放牧条件下大青山绒山羊瘤胃液中产甲烷菌多样性的影响
补饲对放牧条件下大青山绒山羊瘤胃液中产甲烷菌区系在科水平上组成的影响见表4。可鉴定到科水平的大青山绒山羊瘤胃产甲烷菌主要为甲烷杆菌科、甲烷八叠球菌科、甲烷微菌科。补饲组瘤胃液中甲烷杆菌科显著高于放牧组(P<0.05),而甲烷八叠球菌科和甲烷微菌科显著低于放牧组(P<0.05)。另外,放牧组与补饲组瘤胃液中未鉴定的甲烷菌科分别占41.14%、39.33%。
大青山绒山羊瘤胃产甲烷菌在属水平上的差异见表4。甲烷短杆菌属为绝对优势菌属,且补饲组显著高于放牧组(P<0.05),分别占总产甲烷菌属的59.97%、47.76%。放牧组中的甲烷微球菌属显著高于放牧组(P<0.05),而甲烷球形菌属低于补饲组,差异趋于显著(P=0.06)。另外,将不属于任何已知属的甲烷菌标注为未分类甲烷菌,分别占放牧组和补饲组的45.97%、39.53%。

表4 补饲对放牧条件下大青山绒山羊瘤胃产甲烷菌菌群丰度的影响(科、属水平)
3 讨论
3.1 补饲对放牧条件下大青山绒山羊瘤胃液中细菌多样性的影响
分析瘤胃液样品的OTUs数量和α多样性,其结果可以反映微生物群落的丰度和多样性。本研究通过HiSeq测序发现,补饲精料组大青山绒山羊瘤胃液细菌OTUs数量低于放牧组,分别为1 357、1 289。表明不同饲养条件下大青山绒山羊瘤胃微生物种类均很丰富。但本试验的OTUs数量低于陈芸等[8]对黑山羊的研究结果。这可能由于不同宿主动物进化历程的差异性所致,同时与绒山羊的生存环境、所处地理位置、草场类型不同也存在关系。另外,补饲组的特征指数Chao1、ACE、Shannon均低于放牧组,表明在补饲精料的过程中,粗蛋白、淀粉等含量的增加对瘤胃微生物结构有重要影响。
瘤胃细菌是瘤胃中最多样化的群体,能够利用纤维、淀粉、蛋白质和糖,在动物健康和生产性能中具有重要作用[9]。本研究对绒山羊瘤胃细菌群落分析显示,瘤胃拟杆菌门和厚壁菌门为主要的优势菌,其他菌门丰度相对较少,这与过去对反刍动物的许多研究一致[10]。在门水平上,与放牧组相比补饲精料使拟杆菌门增加了19.61%,然而厚壁菌门丰度降低了18.03%。曾燕[11]报道与本试验中绒山羊不同,认为绵羊瘤胃内相对丰度最高的为厚壁菌门(44.37%),蒙古羊瘤胃相对丰度最高的为拟杆菌门(67%)。韩旭峰等[12]研究发现,80~110日龄陕北绒山羊瘤胃微生物以厚壁菌门为主。以上结果表明,瘤胃细菌菌群结构受反刍动物品种、日龄等因素的影响,其群落结构发生变化。另外,补饲精料后变形菌门丰度显著增加,林波等[13]在对水牛瘤胃微生物的研究中也有相似发现。有研究发现,初生(1~3 d)犊牛和乳汁补充日粮饲养的2月龄犊牛瘤胃中变形菌门的丰度最高,6月龄后奶牛瘤胃中变形菌门的丰度急剧下降[14]。这一结果可能是因为犊牛在断奶后摄入饲粮中蛋白含量降低,纤维含量升高引起的。在本试验中,放牧组牧草蛋白含量较低,中性洗涤纤维和酸性洗涤纤维含量较高,而补饲的精料中具有较高的蛋白含量以及较低的纤维含量,因此推测变形菌门的丰度随纤维含量的增加而减少,并且与日粮中的蛋白含量呈正相关。有研究发现,变形菌门主要包括的属为假单胞菌,多数假单胞菌能够产生角蛋白酶,该酶具有很强的蛋白质降解功能[15]。该观点可为上述假设提供一定的辅助性参考。本试验进一步在科水平上的研究发现,拟杆菌门中的普雷沃氏菌科,厚壁菌门中的韦荣球菌科、毛螺菌科、瘤胃球菌科与上述变化具有相同的趋势。这些丰度的差异,可能是因日粮中纤维含量的不同造成的[16]。普雷沃氏菌科在两组中为优势菌,且补饲精料后显著增加了丰度。与前人研究结果对比分析发现,普雷沃氏菌的丰度并不总是随着日粮的变化而表现出规律性变化。有人发现饲喂干草组山羊瘤胃中的普雷沃氏菌丰度高于精料组[17]。然而,也有人认为,虽然不同日粮组绵羊瘤胃中普雷沃氏菌的丰度差异不显著,但与粗粮组相比,精料组中普雷沃氏菌呈上升趋势[18]。这一结果与本试验的研究结果具有相似性。普氏菌中有许多种类,它们参与半纤维素、果胶、淀粉和蛋白质的降解[19]。由于普雷沃氏菌的种类和对底物的偏好不同,日粮结构的变化并不一定会引起普雷沃氏菌丰度的规律性变化。瘤胃球菌由白色瘤胃球菌和黄色瘤胃球菌两种强纤维消化细菌组成,可产生大量的纤维素酶和半纤维素酶。受底物诱导的影响,纤维含量越高,瘤胃球菌的丰度越高[20]。据报道,瘤胃毛螺菌在消化纤维过程中与产琥珀酸丝状杆菌具有协同作用[21]。然而,由于分离培养困难,对毛螺菌的生理特性理解不够深入[22],其在纤维消化中的作用有待进一步研究。
3.2 补饲对放牧条件下大青山绒山羊瘤胃液中产甲烷菌多样性的影响
产甲烷菌广泛存在于反刍动物胃肠道中,在维持瘤胃代谢及功能方面发挥着重要作用[23]。有人提出,瘤胃产甲烷菌的特定性可能与宿主饲料转化效率有关;然而,由于可用于发酵的食物变化,日粮化学组成极大地影响瘤胃中甲烷的生成[24]。因此,本试验试图通过高通量测序技术,对比放牧与补饲条件下大青山绒山羊瘤胃产甲烷菌的群落结构。
在瘤胃中,古菌占所有微生物的4%[25]。本研究也发现,产甲烷菌α多样性指数远小于细菌,但随补饲精料后产甲烷菌丰度发生改变,特别补饲组中的OTUs数量以及Chao1指数显著高于放牧组。产甲烷菌作为专性厌氧古菌,不能直接利用复杂有机物,只能利用瘤胃细菌、原虫和真菌的发酵产物(H2、CO2、甲酸盐等)作为能量来源,所以,受饲养环境、饲料组成及饲喂方式等因素影响较大。本试验在产甲烷菌科水平上研究表明,大青山绒山羊瘤胃内产甲烷菌以甲烷杆菌科为主。这与国内外报道在其他反刍动物上的研究结果一致[26-27]。补饲精料后甲烷杆菌显著提高,通过属水平分析可知,甲烷短杆菌属、甲烷球形菌属、甲烷杆菌属是甲烷杆菌的主要成员,它们能够利用H2还原甲醇。在瘤胃中,甲醇是原虫水解果胶和细菌酯酶活性的产物。牧草是一种相对较差的日粮果胶来源,而精料中一些成分,如柑橘和甜菜果肉中含有丰富的果胶。有人研究发现,当饮食中的精料部分增加时,原虫数量会增加, 造成瘤胃内可用甲醇量增加[28]。因此,补饲精料可能是通过甲醇含量的变化造成甲烷杆菌丰度的升高。已有报道称,丰度较低的微生物在不同环境中发挥重要作用,即使这些基因型仅占所有基因型的3%,依然在代谢效率方面起到重要调节作用,最终导致寄主饲料利用率和宿主甲烷排放的变化[29]。虽然本研究中放牧组甲烷微球菌属丰度较低,但有可能是产生甲烷的主要菌群,补饲显著降低了其丰度,从而引起瘤胃甲烷生成的减少。利用qPCR对16S rRNA基因进行分析,发现甲烷的产量主要归因于产甲烷菌数量的变化[30]。因此,补饲精料引起甲烷菌丰度的变化是否与甲烷产量的变化有直接关系仍需进一步的探讨。本研究发现未知产甲烷菌属占很高的比例,达到39.53%以上。这些数据说明,瘤胃产甲烷菌群落结构的庞大信息远超出我们的认知范围,仍需进一步探索。
4 结论
在细菌门水平上,放牧组和补饲组存在共同的优势菌群即拟杆菌门和厚壁菌门,补饲提高了拟杆菌门含量,降低了厚壁菌门含量。在科水平上,放牧组和补饲组丰度最高的均为普氏菌科,补饲后瘤胃球菌科、理研菌科和互氧菌科丰度显著降低。
古菌中甲烷杆菌科及甲烷短杆菌属受补饲精料的影响显著升高,而甲烷八叠球菌科和甲烷微球菌属显著降低。

