以第三级肝蒂横断为主导的解剖性肝VIII段切除标准化流程
涂玉亮,张卓超,李梦阳,赵伟,朱自满,韩明明,金鑫,宦宏波,王大东,蔡守旺
(1.解放军总医院第四医学中心 肝胆外科,北京 100853;2.解放军总医院第一医学中心 肝胆外科,北京100048)
由于在手术安全性和降低复发率等方面显著优于非解剖性肝切除[1-3],解剖性肝切除在治疗肝脏肿瘤和肝内胆管结石等方面已逐渐得到广泛接受和应用。随着对肝脏血管和胆道解剖结构的深入了解,解剖性肝切除已从解剖性肝叶切除逐渐精确到解剖性肝段甚至亚肝段切除。以第三级肝蒂横断为主导的解剖性S8段切除术要求精确解剖出入右前肝的血管及胆管,阻断右前叶及S8段肝血流,根据缺血分界线确定肝段切除范围。在肝断面上显露标志性肝中静脉及肝右叶S8段的Glisson系统断端,并完整保留左半肝的肝实质和肝蒂。由于肝右前叶位于膈下较深的部位,受肋弓的影响,术野显露困难,术中一旦出血难以控制,规范手术流程显得尤为重要。现结合解放军总医院第四医学中心肝胆外科10例原发性肝细胞肝癌行解剖性肝VIII段切除病例,分析讨论解剖性肝VIII段切除手术的规范化流程。
1 临床资料
2014年1月至2018年12月解放军总医院第四医学中心肝胆外科收治10例肝VIII段原发性肝细胞肝癌病例,并行解剖性肝VIII段切除,平均年龄57.6(46~71)岁,其中男8例,女2例,9例有慢性乙型病毒性肝炎病史,1例有慢性丙型病毒性肝炎病史。手术时间(159.5±25.9)min,术中出血量(296.0±117.8)mL,术后住院时间(17.7±2.7)d,术后均无腹腔感染、腹腔出血、胆漏、腹水等并发症,无死亡病例。
2 术前评估
2.1 全身状况评估
一般情况良好,无明显心、肺、肾、脑等重要脏器功能障碍;控制血压、血糖在正常范围内;肝功能正常,或仅有轻度损害(Child-Pugh A级),或Child-Pugh B级,经短期护肝治疗后恢复到A级;无不可切除的肝外转移性肿瘤。有条件的单位术前可行残肝体积评估及吲哚菁绿排泄试验(ICG R15)。一般认为ICG R15<15%可作为安全进行肝大块切除术而肝功衰竭发生机率低的界限。
2.2 肝脏解剖的术前评估
术前影像学检查如CT血管造影(CTA)、磁共振胰胆管造影(MRCP)等,也可以做肝脏三维成像,评估右前、右后肝管、门静脉右前、右后支和肝右动脉有无异常的汇入支,肝中静脉和肝右静脉是否存在共干或异常分支。肝VIII段门静脉P8通常不是单独一支,而是分为腹侧支(antero-ventral portal branch,AVP)和背侧支(antero-dorsal portal branch,ADP),这对术中染色具有重要意义。
3 标准化手术步骤
(1)患者平卧位,行气管插管,全身静脉麻醉。
(2)常规消毒铺无菌巾,取右上腹肋缘下“J”切口,上至剑突,下至右腋前线。逐层切开入腹,洗手后探查:腹腔有无腹水;肝脏色泽、质地;脾脏大小;肿瘤有无腹腔转移;肿瘤有无侵犯第一、二肝门。
(3)放置肝叶拉钩,切断肝圆韧带、镰状韧带,游离肝结肠韧带、右冠状韧带、右三角韧带、肝脏右叶,使右半肝充分暴露。有条件者,可行术中B超,了解肝中静脉、肝右静脉以及前裂静脉走形。切开肝十二指肠韧带左侧肝胃韧带组织,用肝门阻断带绕肝十二指肠韧带,准备肝门阻断。
(4)切除胆囊:向上牵拉胆囊壶腹部,分离胆囊管和胆囊动脉,分别结扎并切断。游离切除胆囊,充分显露右肝门和Rouviere沟,在沟内有右后肝蒂(见图1)[4],部分病例Rouviere沟不明显,但在右后叶肝蒂进入肝实质处常有小切迹,可以根据此切迹估计右后肝蒂位置。
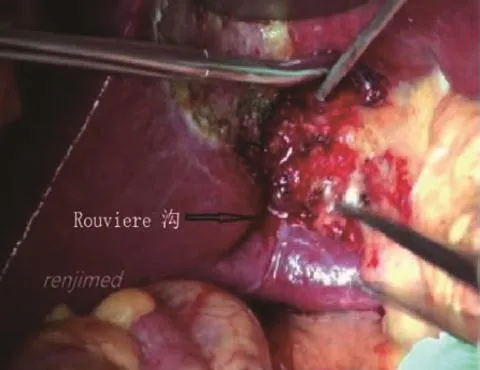
图1 在胆囊右侧下方的Rouviere沟,其内有右后肝蒂。
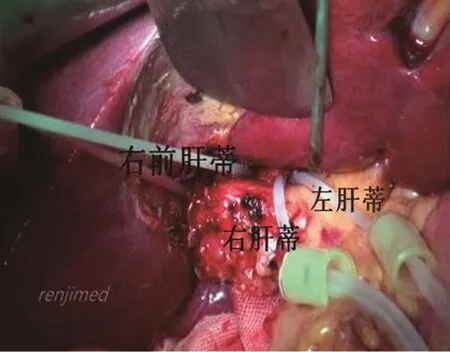
图2 在左、右肝蒂及右前肝蒂Gilsson鞘外置入预阻断带。
(5)游离左、右肝蒂:切开肝门部横沟前缘和后缘肝门板,用静脉分离钳自肝门横沟上缘由前向后Glisson外绕过右肝蒂(见图2),套入右肝蒂预阻断带,备用。同法,置入左肝蒂预阻断带。为防止静脉分离钳方向偏移,可用左手食指置于肝门后指引分离钳的方向。此操作可能会有肝实质出血,可用明胶海绵填塞压迫止血。
(6)游离右前肝蒂:在胆囊床左侧缘、Rouviere沟前方有一个三角锥形区域,是右前、右后肝蒂投影区,胆囊床左侧缘是右前肝蒂投影区,Rouviere沟是右后肝蒂投影区(见图3)。沿右肝蒂向右前方切开胆囊板,三角锥形区内上半部分切除少量肝实质,鞘外法游离显露右前肝蒂和远侧第三级肝蒂的S5、S8段肝蒂[5],用直角钳从右前肝蒂、S5和S8段肝蒂后方Glisson外分别置入预阻断带,悬吊(见图4)。
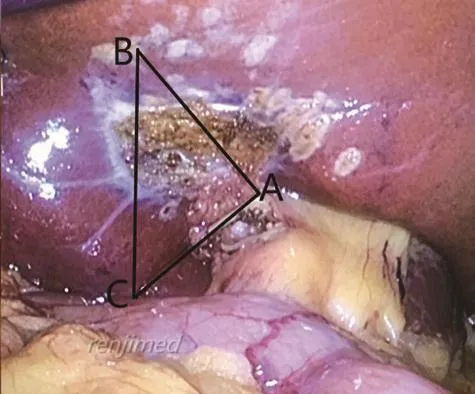
图3 三角形ABC区域,边AB为右前肝蒂及S5、S8段肝蒂投影区,边AC为Rouviere沟,是右后肝蒂投影区。
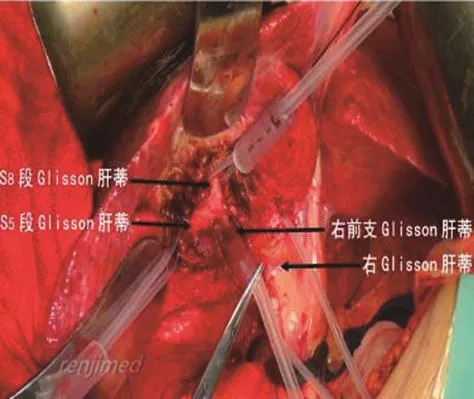
图4 三角形切开部分肝实质后,显露S5、S8段肝蒂。
(7)S8段肝蒂结扎及立体染色:用血管夹夹闭肝S8段支起始部,观察肝脏缺血的范围。与增强CT或CTA观察到的S8段属支比较,因S8段含有腹侧和背侧属支,避免遗漏此属支。必要时可以试阻断S5段肝蒂,观察S5段缺血范围,反观明确S8段肝组织。沿肝S8段缺血线电刀标记拟切除的肝S8段。用21号静脉套管针穿刺门静脉S8段支,注射亚甲蓝4 mL,S8段肝组织立体染色,肝表面染色范围与缺血区域一致,并有助于确定肝脏深部组织界面(见图5)。
(8)S8段肝组织切除:结扎S8段肝蒂,沿S8段肝组织缺血线自下至上,由浅至深离断肝实质,肝实质内切除有染色引导,在染色和非染色组织之间游离肝实质,遇管道结扎或缝扎。5-0 Prolene线缝扎肝断面出血点,观察肝断面有无出血、胆瘘。在切除肝组织左侧时,阻断左肝蒂;在切除肝组织右侧时,阻断右肝蒂。肝切除过程中需要注意保护肝中静脉和肝右静脉(见图6)。
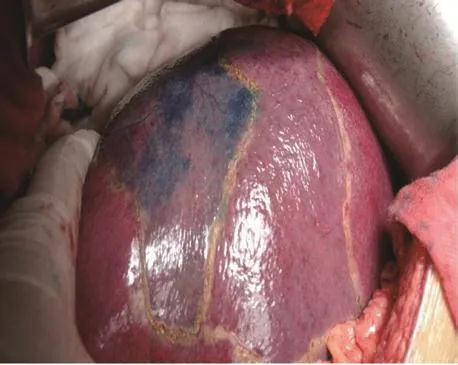
图5 结扎S8段肝蒂后S8段缺血,注射亚甲蓝后S8立体染色。
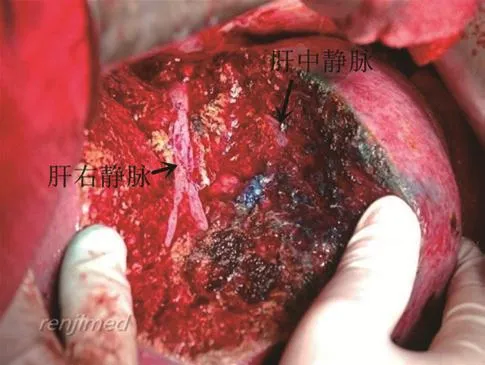
图6 S8肝段切除,保护肝右静脉和肝中静脉。
(9)注意事项:在胆囊床深面约3 cm的位置是肝中静脉发出的较粗大的S5段肝静脉分支,其后方是右肝Glisson系统走行,可称之为“S5段肝静脉间隙”;显露肝中静脉,S8段肝静脉与下腔静脉之间为“S8段肝静脉间隙”(见图7),这时遇到肝中静脉向S8段发出的粗大分支,找到肝静脉S8段属支,包含由肝中静脉发出的前裂静脉(该静脉将S8段分为腹侧、背侧亚段)。解剖出VIII段肝静脉并牢固结扎、切断。其中,注意避免损伤V段肝静脉分支。
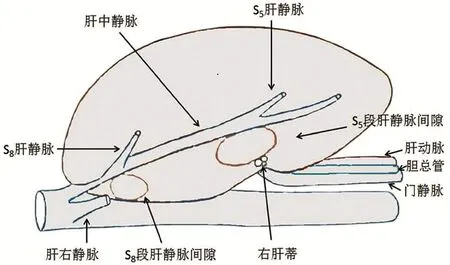
图7 S5段和S8段肝静脉间隙,肝切除时注意避免损伤S5段肝静脉、肝中静脉、肝右静脉。
(10)关腹:温盐水浸泡、冲洗创面。确定无活动性出血及胆漏。肝断面放置1根粗乳胶管,自右侧腹壁切口下戳孔引出并固定。清点器械纱布无误,逐层关腹。术毕。
4 标准化术后管理
4.1 术后一般监测
给予心电监护,密切观察患者生命体征,如心率、血压、血氧饱和度;每12 h记录尿量、引流液的性质和量。心率过快要判断补液量,补液量过多、过少,都会造成心率加快。手术结束后拔除胃管,术后1 d拔除导尿管。
4.2 术后补液
维持水、电解质、酸碱代谢平衡,按照体重及每日额外丢失量及所需热量补液和营养支持,保持心率、血压、尿量在正常范围内,术后严格控制液体量,一般补液量不超过2 500 mL/d。
4.3 术后止痛
给予止痛泵,必要时给予口服塞来昔布胶囊等非甾体类止痛药。
4.4 术后早期活动
鼓励术后早期活动,术后6 h在病床上活动、翻身,术后24 h可以下床活动。
4.5 术后饮食
术后6 h可以少量多次口服温水,术后24 h可以进流食、半流饮食,之后逐渐过渡到正常饮食,同时减少补液。
4.6 术后引流管护理
肝创面小、创面处理确切者可以不放置腹腔引流管;放置腹腔引流管者,术后观察引流液性状和引流量。如果引流量少,无明显出血和胆汁漏,可以术后24 h拔除引流管;如果引流管血性液,密切观察引流情况,注意有无活动性出血,引流物色泽由淡红色逐渐变为淡黄色后可以拔除引流管;如果引流管有胆汁,需较长时间放置引流管,至引流管无胆汁,调整引流管深度后继续观察1 d,引流管仍无胆汁后才可拔除。
4.7 术后病情观察
术后前3 d,每日复查血常规、肝肾功能、电解质、凝血酶原时间及活动度、D-二聚体、血氨等,发现病情变化及时处理。术后第5至7天,B超检查胸腔和腹腔,如果发现胸腔或腹腔有较多积液,应及时在B超引导下放置大静脉管或猪尾巴管引流。
4.8 术后抗病毒治疗
对有乙型或丙型肝炎病毒感染患者,常规应用抗病毒药物治疗。
5 总结
原发性肝细胞癌容易发生门静脉转移,形成门静脉癌栓,门静脉癌栓形成的主要原理为“门脉血逆流学说”[5]。原发性肝细胞癌在生长的早期便形成由肝动脉及门静脉双重供血的血管丛,病灶中央主要由肝动脉供血,病灶周边的肿瘤细胞及子灶主要由门静脉供血。由于周边的肿瘤细胞生长活跃,门静脉是肝癌的浸润生长及肝内转移的重要通道。此外,肿瘤生长瘤内压上升致中央静脉受阻,使门静脉成为引流静脉从而加快肝癌细胞在肝内的转移;肿瘤中的动静脉瘘使门静脉压增大,门静脉逆流增加,肿瘤细胞可能因门静脉逆流进入门静脉主干或沿门静脉进入其他门脉支,造成肝脏内其他部位转移[6]。以上原因均可导致肝癌在肝内沿门静脉系统播散而形成癌微小转移灶,这是肝癌术后复发率高达70%的重要原因。解剖性肝切除可以减少肝癌术中因挤压而引起的门静脉系统转移扩散的风险,提高肝癌患者术后无瘤生存率[7-10]。
肝切除术的一个重要风险就是术中出血,为减少和预防术中出血而形成了一系列手术方法,但肝脏血流阻断术可减少术中出血,但会造成肝脏缺血再灌注损伤,两者之间存在明显的矛盾。由于肝段和肝叶之间的解剖间隙存在乏血管区,按照肝脏的解剖分段形成的间隙离断肝实质有助于减少肝切除术中出血。Pringle法仍是目前肝切除术中最常用而有效的暂时性入肝血流阻断方法,但Pringle法肝门阻断可能引起肝脏缺血再灌注损伤,对原本有肝硬化的肝脏是一个严重的损伤过程,可能造成术后出现严重并发症。第三级肝蒂血流阻断可显著减轻肝脏缺血再灌注损害,同时最大限度增加了残留肝体积,对于减轻肝功能损害、保留肝脏功能性体积患者具有实用价值[11]。
控制术中出血、保持剩余肝脏结构完整、减少剩余肝脏缺血再灌注损伤、减轻肿瘤沿引流门静脉播散是肝切除的核心内容。在标准化的具体实施过程中,以患者整体长期获益为目的,通过关键步骤的质量控制,使手术达到简单化、流程化、可控化的要求,使术后管理规范化、程序化。
5.1 解剖标志明确化
明确解剖标志,规范全面的术前影像学评估必不可少,尤其是对血管成像和胆道成像的评估。根据肝脏Couinaud分段系统,在术前明确手术的解剖标志[12]。右半肝切除的肝切面中,存在着几个出血相对较少的解剖层面即“肝内间隙”,包括:S5段肝静脉间隙、S8段肝静脉间隙、Rouviere沟等,结合血管成像和胆道成像,明确解剖标志位置,可以作为肝切除术的关键解剖标志。深部肝组织中的关键解剖标志可以用术中超声定位,如肝中静脉、肝右静脉及S8的门静脉腹侧支和背侧支的走行必须明确,可以引导手术切除范围。
5.2 手术操作简单化
传统的肝切除手术采用Pringle法间隔阻断全肝入肝血流以减少肝切除过程中的出血。笔者认为以第三级肝蒂为主导的选择性的入肝血流阻断更有优势。切除胆囊后即在Rouviere沟和胆囊左侧缘之间找到肝S5/S6/S7/S8肝蒂的三角投影区,沿这个投影区三角锥形切除少量肝组织,即可暴露右前(S5/S8)、右后肝蒂(S6/S7),选择性结扎相应的肝蒂,阻断入肝血流的同时形成拟切肝段的缺血线,有利于选择恰当的肝切面。肝蒂阻断后,肝切除的过程中,出血主要是来源于肝静脉,控制中心静脉压或行肝下下腔静脉阻断[13-18],可以明显减少术中出血。本组病例的术中中心静脉压控制在0~5 cmH2O,术中出血量(296.0±117.8)mL。在不阻断全肝血流的精细断肝技术,可以大大简化肝实质分离的操作步骤。在脉管离断前,须分离其周围间隙,做好离断操作面,最大程度地裸化管道,避免夹闭不全或部分离断的情况。
5.3 手术步骤流程化
以第三级肝蒂为主导的肝段切除,其手术入路是正确的找到打开右半肝4个肝段的“门”。先分离Rouviere沟前肝实质,血管夹夹闭拟切除肝段的肝蒂,即可出现明确的拟切肝段与残留肝脏之间缺血线,为切除肝段明确了范围。必要时可以使用目标肝段亚甲蓝染色,将目标肝段立体染色。近来也有用吲哚菁绿荧光(ICG)成像法,明确肝段的立体切除范围[19-20]。肝S8内外侧与左肝和右后叶的分界通畅较易明确,但由于肝S8的Glisson鞘可能存在解剖变异,分支较多,与S5的分界可能难以通过S8门静脉美兰注射染色来确定,这种情况下,可以用反染法,将S4/S5/S6/S7染色,剩余的右肝未染色部分即为S8。另外,还可以在术中超声引导下行S8各门静脉分支定位注射染色,确定S8染色的立体边界。本组病例有1例行术中超声美兰染色,2例行反染法染色确定S8范围。对于变异S8的Glisson鞘横断方法,可以切除胆囊床三角区域部分肝组织,充分显露Glisson鞘右前支,在明确S5的Glisson鞘后将剩余的分支结扎横断,即为S8的Glisson鞘横断。阻断肿瘤肝段的肝蒂,可减少术中挤压造成的肿瘤细胞播散,符合无瘤原则,可带来生存获益,缝扎拟切肝段周围肝组织,减少肝实质离断过程中的血供以减少出血。肝实质离断沿“肝内间隙”的顺序,由下至上,由浅至深。
5.4 手术风险可控化
手术全过程中出血是肝脏切除手术过程中最大的风险,在肝蒂阻断后,其出血主要来源于肝静脉。对可能出血位置的充分预判和控制十分重要。三个出血高风险区:(1)胆囊床深面约3 cm肝中静脉的分支;(2)肝中静脉S8分支和前裂静脉;(3)肝右静脉和肝中静脉夹角部。在断肝过程中,秉承“小步快走,逢血必止”的理念,多采用电凝或缝合进行彻底的止血。采用Glisson鞘肝蒂横断,可以减少手术出血和肝脏缺血再灌注损伤,使手术风险可控[21-22]。
5.5 术后管理程序化
根据快速康复外科理念[23],将解剖性肝段切除术后管理规范化。术后多模式有效镇痛,适当合理的补液,及早拔除胃管、导尿管,早活动、早进食,减少术后并发症,促进患者快速康复,减少住院时间。
总之,以第三级肝蒂为主导的解剖性肝段除术的标准化流程规范了术前评估,简化了手术流程,提高了手术效率,加快了术后康复。但是,以第三级肝蒂为主导的解剖性肝段切除术也存在病例选择的局限性,对于高龄患者、肿瘤体积太大、外生侵犯膈肌、压迫第一、二肝门或下腔静脉的病例手术操作比较困难。