表达HIV-1 CRF01_AE亚型结构基因小鼠模型的建立和鉴定
郭婷婷 ,岳成 ,徐柯 ,周玉柏
1.北京工业大学 生命科学与生物工程学院,北京 100124;2.中国疾病预防控制中心 病毒病预防控制所,北京 100052
人类免疫缺陷病毒1型(human immunodefi⁃ciency virus type 1,HIV-1)感染导致的获得性免疫缺陷综合征(acquired immunodeficiency syn⁃drome,AIDS)也称为艾滋病,是一种可通过多种途径传播且潜伏期较短的传染病,目前已成为世界范围内威胁人类健康的重大社会和公共卫生问题[1-2]。流行病学调查显示,2017年全球共有180万新发病例,约94万人死于与艾滋病相关的疾病[3]。虽然1996年进入临床应用的高效抗反转录病毒疗法(highly active antiretroviral therapy,HAART)能够抑制HIV复制,但该疗法只能部分缓解免疫失调和免疫功能丧失[4],并不能彻底清除HIV,且治疗中还会伴随一系列诸如神经认知障碍、肝肾衰竭、心脏疾病等严重的并发症[5-6]。从疾病控制的长远战略看,研制有效的HIV疫苗,通过机体免疫获得HIV中和抗体或特异性细胞免疫以清除体内HIV,不失为一种预防HIV感染、控制病毒传播,以及延缓疾病进程的经济且高效的方法。
HIV在传播和进化过程中产生了不同的亚型。研究显示,我国HIV-1的流行株虽然仍以B′/C亚型为主,但近年来AE亚型占比呈逐渐增多的趋势[7-8]。因此,针对B′/C亚型的HIV疫苗难以满足当前形势的要求。本课题组前期构建了针对我国HIV-1 CRF01_AE亚型的HIV-gp160疫苗,但缺少评价该疫苗临床前免疫效果的生物学工具。在本研究中,我们拟构建并鉴定携带HIV-1 CRF01_AE gp160基因的细胞和小鼠模型,建立评价HIV-1 CRF01_AE亚型疫苗免疫效果的体内外模型,为我国HIV-1 CRF01_AE亚型HIV疫苗的进一步开发奠定实验基础。
1 材料与方法
1.1 材料
C57BL/6小鼠购自并饲养于中国疾病预防控制中心实验动物中心;293T细胞为中国疾病预防控制中心病毒病所曾毅院士实验室保存;TC-1细胞(小鼠肺上皮细胞)购自北京协和医院;大肠杆菌BMStbl3感受态细胞购自北京博迈德基因技术有限公司;携带密码子优化HIV-1 CRF01_AE亚型gp160基因的pVR-AE gp160质粒及Lenti-X HTX慢病毒包装系统均由中国疾病预防控制中心病毒病所提供;限制性内切酶EcoRⅠ-HF、BamHⅠ-HF购自New England Biolabs(北京)有限公司;质粒大量提取试剂盒QIAGEN Plamid Mega Kits、基因组DNA提取试剂盒AllPrep DNA/RNA Mini Kit均购自QIAGEN公司;引物由北京擎科生物技术有限责任公司合成;罗氏真核细胞转染试剂X-tremeGENE HP DNA Transfection Reagent与TRIzol试剂购自北京静远康生物技术发展有限公司;Anti-HIV gp160抗体购自Abcam公司;FITC标记的兔抗山羊IgG购自北京中杉金桥生物技术有限公司;GFP(D5.1)XP抗体购自北京鸿拓嘉禾科技有限公司;多聚甲醛固定液购自Solarbio公司。
1.2 稳定表达HIV AE gp160基因的TC-1细胞的构建
用限制性内切酶EcoRⅠ-HF和BamHⅠ-HF将HIV-1AE亚型gp160基因克隆到慢病毒穿梭质粒pLVE-IRES-eGFP中,获得携带密码子优化型gp160基因的重组质粒pLVX-AE gp160;利用Lenti-X HTX慢病毒包装系统与重组质粒pLVXAE gp160共转染293T细胞获得重组慢病毒LVGFP-AE gp160。测得滴度为1.28×108TU/mL的重组慢病毒LV-GFP-AE gp160感染1×105TC-1细胞,嘌呤霉素筛选获得稳定表达gp160基因的TC-1-HIV AE gp160细胞。
1.3 RT-PCR法检测AE gp160基因在TC-1-HIV AE gp160细胞中的表达
提取细胞总RNA,设计扩增引物F(5'-GGA ATTCCGCCACCATGAGAGTGAGAG-3')和 R(5'-C GGATCCTTACAACTAGAAGGCACAGCA-3'),采用TaKaRa PrimeScript One Step RT-PCR Kit Ver.2试剂盒扩增gp160基因(RT-PCR反应条件:50℃30 min,94℃ 2 min,94℃ 30 s、60℃ 30 s、72℃1 min,30个循环)。扩增产物经1%琼脂糖凝胶电泳鉴定后送北京擎科生物技术有限公司测序。
1.4 流式细胞术检测TC-1-HIV AE gp160细胞中Gp160蛋白的表达
收集5×105TC-1-HIV AE gp160细胞,加入终浓度为50 μg/mL的Anti-HIV gp160抗体,室温避光孵育60 min,洗涤后加入1∶200稀释的FITC标记的兔抗山羊IgG(二抗),室温孵育45 min,设置不孵育抗体的空白对照与只孵育FITC标记的兔抗山羊IgG的阴性对照,3组洗涤后上流式细胞仪进行检测。
1.5 表达AE Gp160蛋白的小鼠模型的建立及免疫组化鉴定
分别将3×105、4×105、5×105稳定表达 Gp160 蛋白的TC-1-HIV AE gp160细胞接种到C57BL/6小鼠背部,最终确定能1周成瘤的50万个细胞数作为接种细胞数,分离接种TC-1-HIV AE gp160细胞7 d后形成的细胞团块,多聚甲醛4℃固定,石蜡包埋切片,非免疫正常山羊血清封闭30 min,吸除封闭液,孵育稀释比为1∶50的GFP(D5.1)XP抗体4℃过夜,PBST冲洗5次各5 min,孵育HRP标记的二抗,室温孵育30 min,PBST冲洗5次各5 min。苏木素溶液染色后进行乙醇梯度水化,二甲苯透明2次各5 min,石蜡切片中央滴加中性树脂封片观察,PBS缓冲液做对照实验。
2 结果
2.1 重组质粒pLVX-AE gp160的酶切鉴定
用高保真酶EcoRⅠ-HF与BamHⅠ-HF双酶切重组质粒pLVX-AE gp160,酶切产物经1%琼脂糖凝胶电泳,结果显示gp160扩增片段约为2600 bp,与预期一致,说明gp160基因插入慢病毒载体,重组质粒构建成功(图1)。
2.2 GFP荧光鉴定
测得滴度为1.28×108TU/mL的重组慢病毒LV-GFP-AE gp160感染1×105TC-1细胞,48 h后荧光显微镜下观察TC-1-HIV AE gp160细胞呈现较强的绿色荧光,说明外源基因可以在重组慢病毒中表达(图2)。
2.3 RT-PCR鉴定TC-1-AE gp160细胞
RT-PCR结果见图3,扩增的gp160基因片段约为2600 bp,说明gp160基因成功插入TC-1-HIV AE gp160细胞基因组。

图1 重组质粒pLVX-AE gp160的酶切鉴定

图2 TC-1-HIV AE gp160细胞荧光图
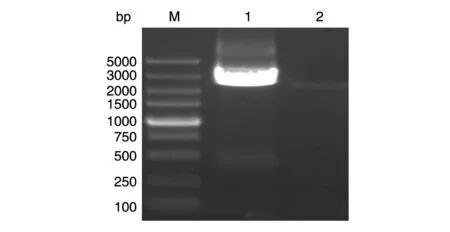
图3 TC-1-HIV AE gp160细胞的RT-PCR鉴定
2.4 流式细胞术鉴定TC-1-AE gp160细胞
收集TC-1-HIV AE gp160细胞总蛋白,设置的空白对照(图4A、B)与阴性对照(图4C、D)组只出现1个峰值,说明无荧光信号;实验组与对照组实验重复3次,图4E、F结果表明TC-1-HIV AE gp160细胞中有较强的荧光信号,即外源基因表达的Gp160蛋白可以在TC-1-HIV AE gp160细胞表面暴露。
2.5 免疫组化鉴定表达AE Gp160蛋白的小鼠模型
免疫组化及HE染色结果显示,小鼠体内接种的TC-1-HIV AE gp160细胞能形成细胞团块,TC-1-HIV AE gp160细胞团块呈红褐色,而对照组组织中无色,表明外源基因可以在小鼠体内形成的细胞团块中表达,提示可能成功构建了表达外源基因的小鼠模型(图5)。
3 讨论
艾滋病是一种传染性较强且潜伏期短的传染病,缺少特效治疗药物。目前有效的疫苗接种仍是HIV-1感染导致的艾滋病的最主要的治疗方法,其中对治疗性疫苗的研发最多。截至2017年4月3日,国际艾滋病疫苗促进组织的研发数据库中有43个艾滋病候选疫苗进入临床试验[9],其中Ⅰ期31个、Ⅰ/Ⅱ期3个、Ⅱ期8个、Ⅲ期1个。HIV疫苗的研发主要以HIV结构基因为靶点,HIV结构基因env表达的膜蛋白Gp160可诱导机体产生特异性免疫应答,在艾滋病相关免疫治疗中被认为是良好的靶抗原。研究表明,进行艾滋病疫苗研究、药物治疗和发病机制研究的必要条件之一是细胞模型和动物模型的构建。艾滋病疫苗研发的主要障碍之一是HIV的高效变异性,因而缺乏有效的动物模型[10]。考虑到经济效应及遗传、代谢、免疫等研究进展,小鼠作为模式动物成为艾滋病疫苗模型研究的焦点。小鼠本身没有CD4特异性受体,无法直接用于HIV-1的感染研究[11],但可作为靶向疫苗的评价模型动物,为疫苗的临床前效果评价提供了研究模型。对于HIV疫苗的临床前效果评价,携带靶抗原的小鼠模型尤为重要。目前关于检测HIV疫苗的靶向治疗效果已有针对小鼠模型建立的研究。TC-1在细胞模型中广泛用于疫苗特异性免疫应答评价和体外抗肿瘤效果评价,均为本实验的可行性提供了有益参考。本实验构建的TC-1-HIV AE gp160小鼠模型和体外细胞模型,目的是满足前期已构建的HIV疫苗的免疫评价需要,进一步完善HIV疫苗评价模型的相关研究。
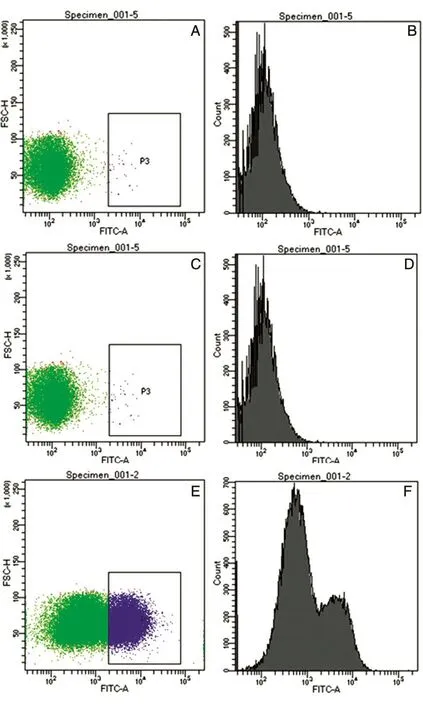
图4 流式细胞术检测TC-1-HIV AE gp160细胞gp160基因表达

图5 GFP蛋白在小鼠组织中的表达(HE染色和IHC)
慢病毒载体基于HIV-1发展而来,该载体能够使外源基因整合到宿主细胞基因组中,并随细胞基因组的分裂而分裂,过程持续且稳定。本研究选用慢病毒pLVX包装系统,构建携带gp160基因的小鼠模型。首先用慢病毒载体构建重组质粒,利用慢病毒包装系统Lenti-X HTX,通过细胞内同源重组获得携带靶基因gp160的重组慢病毒,重组慢病毒感染小鼠细胞TC-1,外源基因gp160以转座子的形式插入小鼠肿瘤细胞TC-1的基因组,经嘌呤霉素抗性筛选后获得表达外源基因gp160的TC-1细胞。为成功构建稳定表达Gp160蛋白的小鼠模型,选择2种小鼠肿瘤细胞系,分别是P815(小鼠肥大肿瘤细胞)及TC-1(小鼠肺上皮肿瘤细胞),目的是为防止后期免疫小鼠出现排斥反应。但是,由于携带gp160基因的P815细胞中Gp160蛋白表达不稳定,经抗性筛选后外源基因容易丢失,因此选择了生长速度快且经抗性筛选后仍稳定表达Gp160的TC-1细胞。将50万个稳定表达Gp160的TC-1细胞接种C57BL/6小鼠,免疫组化及HE染色结果显示,小鼠体内接种的TC-1-HIV AE gp160细胞能形成细胞团块,且可能有Gp160蛋白表达。
综上,我们建立了稳定表达Gp160蛋白的小鼠模型和体外细胞模型,为HIV-1相关疫苗临床前的全面评价提供了模型,也为HIV-1相关疫苗的临床申请提供了数据支持。

