红花注射液配伍稳定性研究
丁艳谱,李响明*,杨 琴,孙胜斌,2,姜国志,刘 鑫
(1.神威药业集团有限公司,河北 石家庄 051430;2.中药注射剂新药技术开发国家地方联合 工程实验室,河北 石家庄 051430;3.河北省中药注射剂工程技术研究中心,河北 石家庄 051430)
红花注射液由红花水提,再经2次醇沉、水沉、热处理等精制工艺制得的灭菌水溶液。现代药理研究显示红花注射液有抗凝血、抑制血栓形成、抗血小板聚集与黏附、改善血液流变学、改善微循环的作用[1]。临床上用于治疗闭塞性脑血管疾病、冠心病、脉管炎[2-3]。
红花注射液的化学成分包括黄酮类化合物、聚乙炔类化合物、5-羟色胺类化合物、甾体类化合物、木质素类化合物、烷基二醇类化合物、有机酸类化合物和色素成分,其中总黄酮类化合物是该产品中最主要的化学成分,具有较好的临床疗效,应用广泛,而关于红花注射液临床应用的配伍研究报道较少[4-5]。因此,本研究参照红花注射液现行质量标准[6]中【用法与用量】在室温环境中模拟配伍考察其稳定性,以期为指导红花注射液的临床应用提供参考。
1 试药和仪器
1.1 试药
红花注射液(神威药业集团有限公司);5%、10%葡萄糖注射液(石家庄四药有限公司);羟基红花黄色素A对照品(111637-201810,93.1%);山奈酚对照品(1110861-201812,93.8%),以上对照品均购自中国食品药品检定研究院。乙腈,色谱纯;三乙胺、冰醋酸、甲醇、三氯化铝均为分析纯。
1.2 仪器
U3000高效液相色谱仪(戴安公司);CPA225D 电子天平(Sartorius);FE20酸度计(梅特勒-托利多);不溶性微粒测定仪(天津市天大天发科技有限公司);紫外可见分光光度计(日本岛津公司);电热恒温水浴锅(北京科伟永兴仪器有限公司);渗透压摩尔浓度测定仪(天津天河医疗器械有限公司)。
2 方法
2.1 配伍方法
红花注射液现行质量标准【用法与用量】中已明确“治疗闭塞性脑血管疾病,静脉滴注,一次15 mL,用10%葡萄糖注射液250~500 mL稀释后使用,每日1次,15~20次为1个疗程。治疗冠心病,静脉滴注,每次5~20 mL,用5%~10%葡萄糖注射液250~500 mL稀释后应用,每日1次,10~14次为1个疗程,疗程间隔为7~10日。治疗脉管炎,肌内注射,每次2.5~5 mL,每日1~2次[6]。”为了提高滴注的顺应性,降低疼痛反应的发生率,我公司在产品说明书中“建议滴速小于40滴/min,一般控制在15~30滴/min”。
因此本研究确定红花注射液的稀释液为5%、10%葡萄糖注射液,分别考察最小浓度、最大浓度时的配伍稳定性。结合滴速,可计算出最长滴注时间为11.2 h。综上,本研究分别取5 mL红花注射液与500 mL的5%、10%葡萄糖注射液在超净台下配伍;取20 mL红花注射液与250 mL的5%、10%葡萄糖注射液在超净台下配伍,配伍后在室温下静置12 h,分别在0 h、1 h、2 h、4 h、6 h、12 h观察配伍液的性状,测定配伍液的pH值、不溶性微粒、摩尔渗透压比、吸光度。有文献[7]指出羟基红花黄色素A、总黄酮是红花注射液的有效成分,在配伍后0、12 h时测定配伍液的有效成分含量,确认临床用药中有效成分的稳定性。
2.2 检测方法
2.2.1 性状 目视,观察配伍液的颜色,是否有气体产生,有无浑浊或沉淀。
2.2.2 pH值 取配伍液,按中国药典2015版四部通则0631测定pH值。
2.2.3 不溶性微粒 取配伍液,按中国药典2015版四部通则0903测定不溶性微粒。
2.2.4 渗透压摩尔浓度 取配伍液,按中国药典2015版四部通则0631测定渗透压摩尔浓度比。
2.2.5 吸光度 精密量取低浓度配伍液5 mL置25 mL量瓶中,加水至刻度摇匀;精密量取高浓度配伍液2.5 mL置100 mL量瓶中,加水至刻度摇匀。照紫外-可见分光光度法(中国药典2015年版四部通则0401),取相应浓度的葡萄糖注射液稀释相同的倍数后为空白,在250~350 nm波长范围内扫描。
2.2.6 羟基红花黄色素A 参照红花注射液现行质量标准(WS3-B-3825-98-2012)中【含量测定】羟基红花黄色素A的方法测定。
供试品溶液的制备:取红花注射液按“2.1”项下方法配伍后,即得。
测定法:精密吸取低浓度配伍方式的供试品溶液100 μL注入液相色谱仪;精密吸取高浓度配伍方式的供试品溶液10 μL,注入液相色谱仪。
2.2.7 总黄酮 参照红花注射液现行质量标准(WS3-B-3825-98-2012)中【含量测定】总黄酮的方法测定。
供试品溶液的制备:取红花注射液,按低浓度配伍方式配伍,精密量取10 mL配伍液,水浴蒸至近干,用甲醇转移定容至10 mL量瓶中,摇匀,作为供试品溶液。取红花注射液,按高浓度配伍方式配伍,精密量取15 mL配伍液置100 mL量瓶中,用甲醇定容至刻度,摇匀,作为供试品溶液。分别精密吸取2 mL供试品溶液置10 mL具塞试管中,照标准曲线制备项下的方法,自“加0.1 mol/L三氯化铝溶液1.0 mL”起,依法测定吸光度。同时精密量取供试品溶液2 mL,置10 mL具塞试管中,加甲醇3.0 mL,置40 ℃水浴中,其余同上操作,作为空白溶液。从标准曲线上读出供试品溶液中相当于山奈酚的量,计算,即得。
3 结果
根据“2.1”项下方法配伍后,分别再放置0 h、1 h、2 h、4 h、6 h、12 h按“2.2”项下方法检测,得出试验结果,见表1-表3。

表1 配伍液的性状及pH值变化
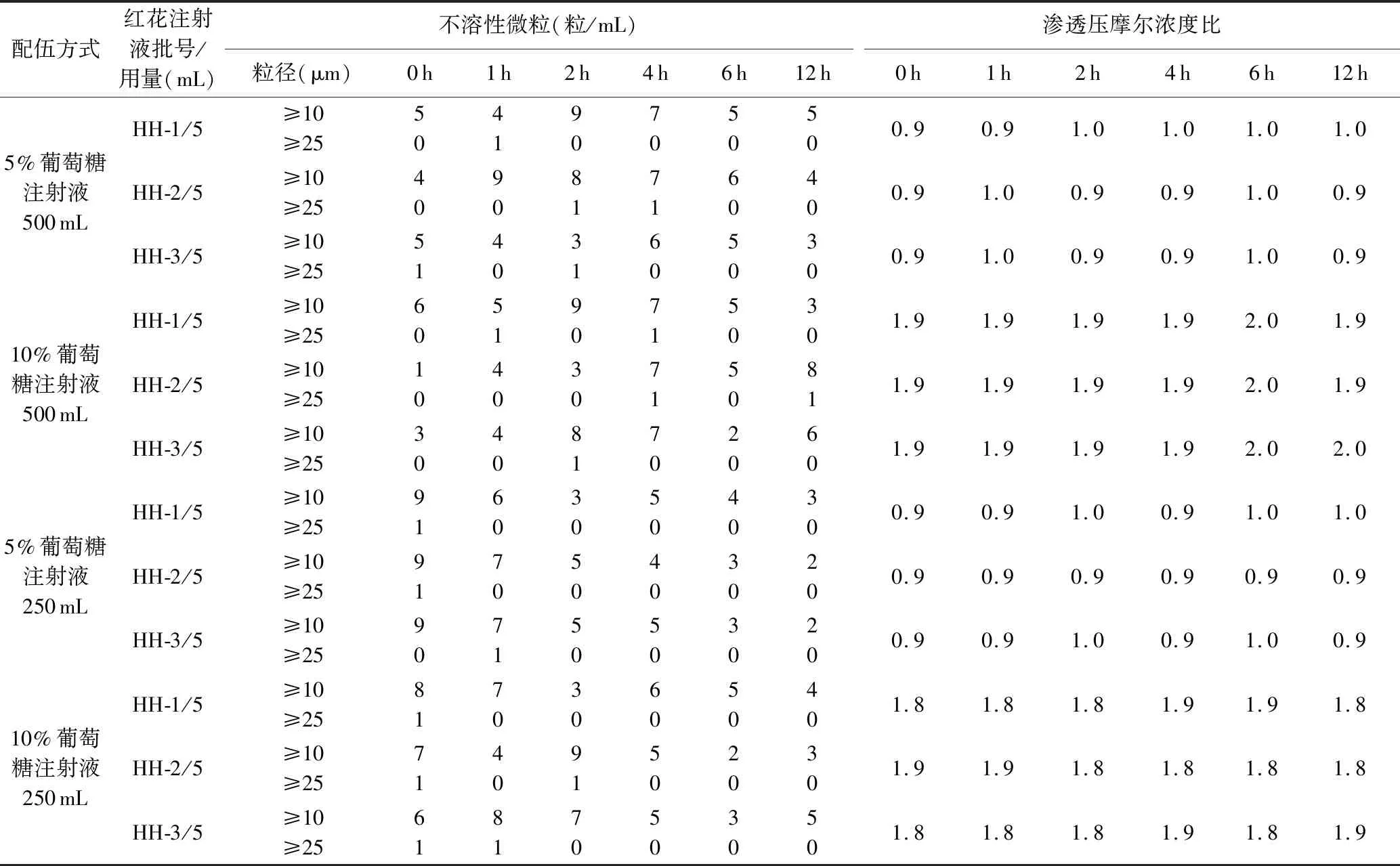
表2 配伍液的不溶性微粒及渗透压摩尔浓度的变化

表3 配伍液的吸光度、羟基红花黄色素A及总黄酮的变化

续表3
从以上3个表中的数据可知,将红花注射液分别与5%、10%葡萄糖注射液配伍成两种浓度后,在超净台下室温连续放置12 h,配伍液未发生变色、产气、浑浊或沉淀的现象,配伍液始终呈黄色的澄明液体;pH值、摩尔渗透压比稳定,几乎无变化。与5%、10%葡萄糖注射液配伍后,配伍液的pH值、摩尔渗透压比有差异,这与所用的葡萄糖注射液浓度有关。不溶性微粒数目主要取决于葡萄糖注射液中不溶性微粒的水平,放置过程中配伍液不溶性微粒数目无显著变化。配伍液在250~350 nm波长范围内扫描,发现在(266±2)nm处有最大吸收,在12 h内吸收度值稳定。本研究还测定了配伍液中有效成分的含量,放置12 h后羟基红花黄色素A、总黄酮含量相对稳定。本次研究表明红花注射液与5%、10%葡萄糖注射液配伍稳定。
4 讨论
随着红花注射液的临床广泛应用,其不良反应也时有报道,目前已知的不良反应涉及中枢及外周神经系统、心血管系统、呼吸系统、胃肠系统、泌尿系统、皮肤及附件、全身性损害等,临床表现主要有瘙痒、皮疹、恶心、呕吐、头晕头痛、气短气促、呼吸困难、心悸、心律失常、血尿、排尿困难、发热、寒战等,严重者出现过敏性休克[8-10]。
红花注射液不良反应的发生主要与两方面有关,其一是患者自身的年龄[11]、基础疾病、联合用药[12],其二是中药制剂药效成分复杂,在工业生产中大分子蛋白类成分[13]、脂溶性成分[14-15]的残留可能增加患者使用后不良反应的发生率。上述这些物质在使用后进入人体,均有可能参与人体的免疫反应,直接或间接吸附于血管壁上,降低小动脉、毛细血管的通透性,增强血管脆性,最终诱发各种疾病[16]。
中药制剂引起不良反应的原因很多,可以从以下几点努力,降低不良反应的发生率:①加强基础研究,明确与之配伍有禁忌的、不适宜配伍的制剂,从理论指导临床联合用药;②提高临床医患、医护的防范意识,根据患者的自身疾病、生理、心理的差异制定科学、合理、有效的治疗方案,使用前仔细询问患者的用药史、过敏史,必要时做皮肤过敏试验等降低风险,使用后密切观察用药反应[17];③制剂生产企业在说明书中增加警示语、用药注意事项等安全性信息,持续优化生产工艺,降低致敏风险,提高产品质量。
——2017年渗透压相关高考真题赏析

