沙糖橘S-腺苷甲硫氨酸脱羧酶基因克隆及表达分析
唐文武 吴秀兰

摘要:【目的】克隆沙糖橘S-腺苷甲硫氨酸脫羧酶基因(CrSAMDC),并明确其在不同组织和干旱胁迫下的表达特征,为开展SAMDC基因分子机理研究提供理论依据,同时为柑橘抗逆分子育种提供候选基因。【方法】以6年生沙糖橘为材料,利用RT-PCR克隆CrSAMDC基因并进行生物信息学分析,以实时荧光定量PCR检测CrSAMDC基因在不同组织和干旱胁迫下的表达谱,并开展原核诱导外源蛋白表达及Southern杂交分析。【结果】从沙糖橘嫩叶克隆获得的CrSAMDC基因cDNA序列全长1736 bp,含有1个1131 bp的开放阅读框(ORF),编码376个氨基酸残基;CrSAMDC蛋白相对分子量为40.69 kD,理论等电点(pI)为5.27,为亲水性蛋白,其二级结构以α-螺旋和无规则卷曲为主,分别占32.98%和42.02%,β-转角仅占6.91%,延伸链占18.09%;与克里曼丁橘(Citrus clementina,XP_024047984.1)和甜橙(C. sinensis,KDO62315.1)的SAMDC蛋白亲缘关系较近,其氨基酸序列同源性分别为99.5%和97.3%;具有LSE-SSLF的酶原剪切位点结构域及与SAMDC蛋白降解相关的PEST结构域(TVHITPED-GFSYASYE)。CrSAMDC基因在沙糖橘的叶、花、果肉和果皮中均有表达,且在分裂旺盛的嫩叶和花器官中高表达;干旱胁迫下,CrSAMDC基因表达量呈先上升后下降的变化趋势,以干旱胁迫后24 h的相对表达量最高。CrSAMDC基因在沙糖橘基因组中以单拷贝形式存在,且通过构建原核表达载体能成功诱导表达获得CrSAMDC融合蛋白。【结论】CrSAMDC基因在沙糖橘中的表达具有组织特异性,且以单拷贝存在,在干旱胁迫下呈上调表达趋势,即参与干旱胁迫响应的多胺代谢调控。
关键词: 沙糖橘;CrSAMDC基因;多胺;干旱胁迫;原核表达;Southern杂交
Abstract:【Objective】The S-adenosylmethionine decarboxylase gene(CrSAMDC) was cloned from Shatangju, and the expression characteristics of the CrSAMDC gene was analyzed in different tissues and under drought stress. This provided basis for further molecular mechanism of SAMDC gene and provided candidate genes for Citrus stress resistant molecular breeding. 【Method】CrSAMDC gene was cloned by using reverse transcriptional PCR(RT-PCR) with six-year Sha-tangju as materials. Bioinformatics was conducted as well. Real-time fluorescence quantitative PCR(qRT-PCR) method was adopted to study the expressions of CrSAMDC gene in different tissues and under drought stress. Prokaryotic induction exogenous protein expression and Southern blot analysis were conducted. 【Result】The cDNA full-length sequence of CrSAMDC gene cloned fron Shatangju new leaves was 1736 bp, with an open reading frame(ORF) of 1131 bp, encoding 376 amino acids. CrSAMDC protein relative molecular weight was 40.69 kD, theoretical isoelectric point(pI) was 5.27. It was a hydrophilic protein. Its secondary structure was mainly consisted of α-helix(32.98%) and random coil(42.02%), β-turn only accounted for 6.91%, and extended chain accounted for 18.09%. It had the close genetic relationship with SAMDC protein of Citrus clementina(XP_024047984.1) and C. sinensis(KDO62315.1), their amino acid sequence homology were 99.5% and 97.3%. It had LSE-SSLF prozyme cleavage site domain and PEST domains related to SAMDC protein degradation(TVHITPED-GFSYASYE). CrSAMDC gene was expressed in leaves, flowers, flesh and peel of Shatangju, and was highly expressed in young leaves and flowers with vigorous division. Under drought stress, the expression level of CrSAMDC gene first increased and then decreased, and the highest expression level was reached at 24 h. CrSAMDC gene exists as a single copy, and CrSAMDC fusion protein could be obtained through induction of prokaryotic expression vector. 【Conclusion】The expression of CrSAMDC gene in Shatangju has tissue specificity, and exists as single copy. It up-regulates its expression under drought stress, which means that involves in the regulation of polyamine metabolism in response to drought stress.
Key words: Shatangju; CrSAMDC gene; polyamine; drought stress; prototypical expression; Southern blot analysis
0 引言
【研究意义】多胺在调控植物生长发育和缓解逆境胁迫等方面发挥重要作用,S-腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxylase,SAMDC)作为多胺合成的关键限速酶,主要参与植物防御干旱胁迫的调控过程(郝爱平和王婷婷,2014;Wi et al.,2014)。沙糖橘是我国南方主栽的柑橘品种,多种植于丘陵山地等干旱缺水地区,易受干旱和低温等气候影响及病虫害威胁,尤其是近年来全球气候变暖,导致持续高温干旱和缺乏降雨等异常气候频发,对我国柑橘生产造成严重影响(王静,2009;李果果等,2018)。因此,开展沙糖橘SAMDC基因克隆及表达分析,对研究柑橘的抗逆分子机理及遗传改良具有重要意义。【前人研究进展】多胺是由两个或两个以上氨基组成具有促进细胞分裂分化的低分子脂肪族含氮碱,在生物体内广泛分布,具有刺激生长和延缓衰老的作用(张雪梅等,2012)。植物中的多胺主要以腐胺(Putrescine,Put)、尸胺(Cadavarine,Cad)和亚精胺(Spermidine,Spd)等形式存在,在调控植物生长发育、抗逆性、形态建成及延缓衰老等方面发挥重要作用(Bouchereau et al.,1999;赵维峰等,2004;Alcázar et al.,2006;Groppa and Benavides,2008)。SAMDC作为精胺和亚精胺合成过程的限速脱羧酶,能催化S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)脱羧并形成氨丙基,然后在精胺合成酶(Spermine synthase,SPMS)催化作用下,提供的氨丙基与腐胺反应生成精胺;或在亚精胺合成酶(Spermidine synthase,SPDS)作用下,氨丙基与腐胺反应生成亚精胺(Kakkar et al.,2000;李亚栋和何近刚,2012)。目前,已在马铃薯(Mad Arif et al.,1994)、曼陀罗(Torrigiani et al.,2005)、番茄(Sinha and Rajam,2013)、甘蔗(文乐等,2015)、胡萝卜(王广龙等,2017)、陆地棉(梁其干等,2019)和白菜(唐文武和吴秀兰,2019)等多种植物中分离获得SAMDC,其作为限速酶调控着植物体内多胺的合成,在植物的抗逆境胁迫、细胞分裂分化、种子萌发及花果发育等过程中发挥重要作用(Minocha et al.,2014)。【本研究切入点】沙糖橘是我国南方地区重要的柑橘品种,但至今有关沙糖橘SAMDC基因(CrSAMDC)的克隆及其功能研究尚無报道。【拟解决的关键问题】以无籽沙糖橘为材料,利用RT-PCR克隆CrSAMDC基因并进行生物信息学分析,以实时荧光定量PCR检测CrSAMDC基因在不同组织和干旱胁迫下的表达谱,并开展原核诱导外源蛋白表达及Southern杂交分析,以期为开展SAMDC基因分子机理研究提供理论依据,同时为柑橘抗逆分子育种提供候选基因。
1 材料与方法
1. 1 试验材料
供试材料为广东地区种植的无籽沙糖橘品种,由肇庆市四会果园提供。选择生长旺盛的6年生沙糖橘果树,在不同时期摘取其嫩叶(春梢期)、老叶(越冬期)、花(花芽期)、30 d幼果果肉和30 d幼果果皮,每3株果树为1个重复,共设3个重复,所有材料取样后置于-80 ℃冰箱保存,用于总RNA提取。干旱胁迫处理时,采集6年生沙糖橘果树上的新发秋梢,再以10% PEG-6000对其进行模拟干旱胁迫,胁迫时间分别设为3、6、9、12、24和36 h,以0 h为对照,设3个重复。
1. 2 CrSAMDC基因克隆
1. 2. 1 叶片总RNA提取及cDNA第一链合成 取6年生无籽沙糖橘果树的嫩叶,采用RNAout试剂盒(北京天恩泽基因科技有限公司)提取其总RNA,并以DNaseⅠ(TaKaRa公司)进行消化。采用M-MLV反转录试剂盒(Life technology公司)反转录合成cDNA第一链,具体步骤严格按照试剂盒说明进行操作。
1. 2. 2 引物序列设计及PCR扩增 根据华中农业大学已公布的甜橙(Citrus sinensis)SAMDC基因序列(Gene ID:Cs4g02260)设计并筛选出1对PCR引物CrSAMDC-F/CrSAMDC-R(表1),委托生工生物工程(上海)股份有限公司广州分公司合成。以反转录合成的cDNA为模板扩增CrSAMDC基因cDNA序列,PCR反应体系50.0 μL:Ex Taq DNA聚合酶0.5 μL,10×PCR Buffer 5.0 μL,dNTP(2.5 mmol/L) 2.0 μL,CrSAMDC-F和CrSAMDC-R(10 μmol/L)各1.0 μL,cDNA模板(100 ng)2.0 μL,加ddH2O补充至50.0 μL。扩增程序:94 ℃预变性4 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 90 s,进行30个循环;72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳后,用DNA凝胶回收试剂盒(TaKaRa公司)回收纯化目的片段。
1. 2. 3 CrSAMDC基因测序分析 将CrSAMDC基因与克隆载体pMD19-T连接后,转化大肠杆菌DH5α感受态细胞,经培养、质粒DNA提取及PCR鉴定后,送至生工生物工程(上海)股份有限公司进行测序。
1. 3 CrSAMDC蛋白生物信息学分析
利用NCBI对CrSAMDC基因cDNA序列进行编码蛋白搜索,并以BLAST进行同源比对分析;采用ExPASy中的ProtParam进行CrSAMDC蛋白理化性质分析,使用ProtScale预测其亲/疏水性;利用PredictProtein预测CrSAMDC蛋白功能结构域;使用SWISS-MODEL进行CrSAMDC蛋白三级结构预测;最后以DNAMAN和MEGA 7.0进行蛋白序列多重比对及构建系统发育进化树。
1. 4 CrSAMDC基因在不同组织及干旱胁迫下的表达分析
根据CrSAMDC基因cDNA序列设计1对特异性引物QCrSAMDC-F/QCrSAMDC-R(表1),以柑橘ACTB基因为内参(Wu and Tang,2016),按SYBR荧光定量试剂盒说明进行实时荧光定量PCR检测,并采用2-△△Ct法计算目的基因的相对表达量(Livak and Schmittgen,2001)。
1. 5 CrSAMDC基因原核表达载体构建及融合蛋白诱导表达
设计含有EcoR I和Sal I酶切位点接头的引物pET32CS-F/pET32CS-R(表1),然后扩增携带有酶切位点的CrSAMDC基因。同时以EcoR I和Sal I双酶切pET32a原核表达载体,并与携带酶切位点的Cr-SAMDC基因进行大片段连接,构建重组质粒pET32a-CrSAMDC。经转化、涂板、双酶切及测序等鉴定后,将阳性重组质粒pET32a-CrSAMDC转化至BL21(DE3)原核表达菌株中,以pET32a空载体为对照。将克隆菌株接种至含氨苄青霉素(Amp+)的LB培养基上,37 ℃过夜培养,然后按1∶100比例再接种至LB培养基,37 ℃下摇床(200 r/min)培养至OD600为0.6~0.8,加入1 mmol/L IPTG进行诱导表达,表达产物用12% SDS-PAGE进行电泳检测。
1. 6 Southern杂交分析
采用CTAB法提取沙糖橘嫩叶基因组DNA(约10 μg),分别用限制性内切酶EcoR I、BamH I、Sac I和Dra I在37 ℃下进行酶切(约12 h),再以0.8%琼脂糖凝胶电泳进行检测,具体操作参考Wu和Tang(2016)的方法。探针引物为Southern-F/Southern-R(表1),扩增片段为597 pb,PCR反应体系及扩增程序同1.2.2。
2 结果与分析
2. 1 CrSAMDC基因克隆及测序分析结果
以沙糖橘嫩叶总RNA反转录合成的cDNA为模板,利用CrSAMDC-F/CrSAMDC-R引物进行PCR扩增,结果获得1条约1700 bp的清晰条带(图1),与预期结果相符。测序结果显示,CrSAMDC基因cDNA序列全长1736 bp,含有1个1131 bp的开放阅读框(ORF),编码376个氨基酸残基(图2)。
2. 2 CrSAMDC蛋白生物信息学分析结果
利用ProtParam对CrSAMDC蛋白理化性质进行预测分析,结果显示,CrSAMDC蛋白由376个氨基酸组成,相对分子量为40.69 kD,理论等电点(pI)为5.27;其中,丝氨酸(Ser)含量最高,占13.3%,色氨酸(Trp)含量最低,僅占1.1%;正电荷氨基酸残基[天冬氨酸(Asp)+谷氨酸(Glu)]41个,占氨基酸总数的10.9%,负电荷氨基酸残基[精氨酸(Arg)+赖氨酸(Lys)]31个,占氨基酸总数的8.2%。ProScale亲/疏水性预测结果表明,CrSAMDC蛋白疏水性最强的是第73位亮氨酸(Leu),其分值为1.811;亲水性最强的是第163位脯氨酸(Pro),其分值为-2.244;平均亲水系数为-0.016,即CrSAMDC蛋白为亲水性蛋白。CrSAMDC蛋白二级结构以α-螺旋和无规则卷曲为主,分别占32.98%和42.02%,β-转角仅占6.91%,延伸链占18.09%。使用SWISS-MODEL对CrSAMDC蛋白进行同源建模分析,结果(图3)表明该蛋白与PDB蛋白结构数据库中人类SAMDC S68A(1msv.1.A)的相似性为31.35%,全局模型质量评估值(GMQE)为0.62。
利用MEGA 7.0中的邻接法(Neighbour-joining,NJ)构建基于SAMDC氨基酸序列同源性的系统发育进化树,结果(图4)显示,CrSAMDC蛋白与克里曼丁橘(C. clementina,XP_024047984.1)和甜橙(KDO62315.1)的SAMDC蛋白亲缘关系较近,其氨基酸序列同源性分别为99.5%和97.3%;然后与阿月浑子(Pistacia vera,XP_031285063.1)、博落回(Macleaya cordata,OVA09485.1)、毛白杨(Populus trichocarpa,XP_002324514.2)和番木瓜(Carica papaya,XP_021902142.1)的SAMDC蛋白聚在同一分支上。欧洲栓皮栎(Quercus suber,XP_023920228.1)、杨梅(Morella rubra,KAB1211990.1)和笋瓜(Cucurbita maxima,XP_022999703.1)的SAMDC蛋白则聚为另一分支。利用DNAMAN对上述物种的SAMDC蛋白进行序列多重比较,结果发现均含有LSE-SSLF的酶原剪切位点结构域,以及与SAMDC蛋白降解相关的PEST结构域(TVHITPED-GFSYASYE),显示出SAMDC蛋白功能结构域的高度保守特征。
2. 3 CrSAMDC基因表达分析结果
选取6年生沙糖橘果树的嫩叶、老叶、花、30 d幼果果肉和30 d幼果果皮等5个组织样品,提取其总RNA后反转录合成cDNA,以实时荧光定量PCR检测CrSAMDC基因的组织表达特性。由图5可知,CrSAMDC基因在沙糖橘的叶、花、果肉和果皮中均有表达,但以嫩叶的相对表达量最高,其次为花,而30 d幼果果肉的相对表达量仅为嫩叶的14.5%。说明CrSAMDC基因表达具有明显的组织特异性,且在分裂旺盛的嫩叶和花器官中高表达。
为研究干旱胁迫下CrSAMDC基因的表达特性,采用10% PEG-6000对新发秋梢进行模拟干旱胁迫处理,分别于胁迫处理后0、3、6、9、12、24和36 h取样进行检测分析。由图6可知,随着干旱胁迫处理时间的延长,CrSAMDC基因的相对表达量呈先上升后下降的变化趋势。以干旱胁迫后24 h的相对表达量最高,是对照处理的7.35倍。说明沙糖橘在干旱胁迫下可通过调节CrSAMDC基因高效表达,促进精胺和亚精胺等多胺合成,缓解干旱环境对植物生长发育的影响,以维持沙糖橘正常的生长发育。
2. 4 Southern杂交分析结果
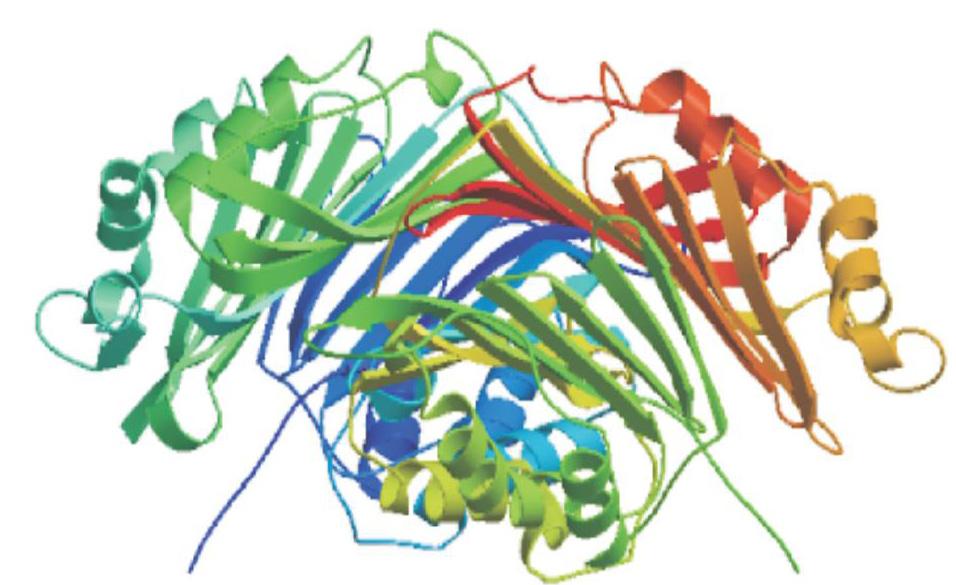
为明确CrSAMDC基因在沙糖橘基因组中的拷贝数目,而进行Southern杂交分析,结果(图7)显示,采用探针上无酶切位点的EcoR I、BamH I和Sac I进行酶切,Southern杂交仅检测到1条条带;而采用含有1个酶切位点的Dra I进行酶切,Southern杂交检测到2条条带,说明CrSAMDC基因在沙糖橘基因组中可能以单拷贝形式存在。
2. 5 融合蛋白诱导表达情况
经EcoR I和Sac I双酶切鉴定及测序分析,可确认pET32a-CrSAMDC为正确的重组质粒。对含有重组质粒pET32a-CrSAMDC的BL21(DE3)原核表达菌株进行IPTG诱导表达,然后利用超声波破碎细胞并离心,分别收集上清液和沉淀,以12% SDS-PAGE进行电泳检测,结果(图8)显示,在上清液中检测到1条约61.0 kD的条带,与预期的融合蛋白大小相符,而pET32a空载体在21.0 kD附近出现明显的GST标签蛋白条带,说明CrSAMDC融合蛋白诱导表达成功,且主要以可溶性的形式存在。
3 讨论
柑橘是热带亚热带地区多年生木本果树。据统计,2017年全球柑橘收获面积945.35万ha,收获产量14645.90万t(张浩,2018)。我国柑橘种植面积258.72万ha,柑橘产量3816.78万t(田楠坤,2019)。我国柑橘主要种植在丘陵山地等露天旱地环境中,其生长周期长且受自然环境调控,易受干旱和低温等气候影响及病虫害威胁(王静,2009)。多胺是调控植物生长发育和缓解逆境胁迫的关键物质,而SAMDC作为多胺合成的关键限速酶,可能参与植物应对干旱及低温等逆境胁迫的调控过程(Wi et al.,2014;刘长命等,2019)。王静(2009)研究发现,枳在低温胁迫下其SAMDC基因被诱导表达,且低温胁迫时间越长,SAMDC基因表达量越高。王广龙等(2017)在胡萝卜中克隆获得SAMDC基因,并证实其在高温、低温、干旱及盐渍等逆境胁迫下高表达,在胡萝卜抗逆境胁迫过程中发挥重要的调节作用。本研究从沙糖橘中克隆获得CrSAMDC基因,其cDNA序列全长1736 bp,编码376个氨基酸残基,与拟南芥、胡萝卜等双子叶植物的SAMDC蛋白氨基酸残基数目相近(王广龙等,2017),与克里曼丁橘和甜橙的SAMDC蛋白亲缘关系最近,其氨基酸序列同源性分别为99.5%和97.3%;CrSAMDC蛋白含有高度保守的酶原剪切位点LSE-SSLF及与SAMDC蛋白降解相关PEST结构域。实时荧光定量PCR检测结果显示,CrSAMDC基因在沙糖橘各組织中均有表达,但其表达量具有明显的组织特异性,以在分裂旺盛的嫩叶和花器官中表达量较高,与SAMDC基因在马铃薯(Mad Arif et al.,1994)、胡萝卜(王广龙等,2017)、甘蔗(刘金仙等,2010)等作物中的表达分布相似。
在干旱胁迫下,植物可通过上调SAMDC基因表达水平,以提高体内多胺含量而增强抗氧化能力,进而提高植株的抗旱性(Wi et al.,2014;文乐等,2015)。本研究结果表明,干旱胁迫下CrSAMDC基因表达水平呈先上升后下降的变化趋势,以干旱胁迫后24 h的表达量最高,即干旱胁迫会诱导CrSAMDC基因高水平表达,因此推测沙糖橘可能通过合成多胺来缓解干旱环境对植物生长发育的影响,说明CrSAMDC基因参与干旱胁迫响应的代谢调控过程。Southern杂交分析的结果表明,CrSAMDC基因在沙糖橘基因组中可能含有1个拷贝数,与纽荷尔脐橙(C. junos)的检测结果(王静,2009)基本一致。此外,本研究通过构建重组质粒pET32a-CrSAMDC,并通过BL21(DE3)原核表达菌株成功诱导表达获得约61.0 kD的融合蛋白,为进一步探究SAMDC在调控抗旱胁迫等非生物逆境作用的分子机制及遗传改良等提供了理论基础。
4 结论
CrSAMDC基因在沙糖橘中的表达具有组织特异性,且以单拷贝存在,在干旱胁迫下呈上调表达趋势,即参与干旱胁迫响应的多胺代谢调控。
参考文献:
郝爱平,王婷婷. 2014. 高粱SAMDC基因的电子克隆与生物信息学分析[J]. 西南农业学报,27(2):507-511. [Hao A P,Wang T T. 2014. In silico cloning and bioinformatic analysis of SAMDC gene in sorghum[J]. Southwest China Journal of Agricultural Sciences,27(2):507-511.]
李果果,陈香玲,秦荣耀,刘要鑫,赵小龙,孙宁静,欧智涛,唐志鹏,张广珍. 2018. 大果沙糖橘的遗传鉴定及引种栽培表现[J]. 南方农业学报,49(6):1171-1176. [Li G G,Chen X L,Qin R Y,Liu Y X,Zhao X L,Sun N J,Ou Z T,Tang Z P,Zhang G Z. 2018. Genetic identification and cultivation performance of introduced Daguo shatangju[J]. Journal of Southern Agriculture,4(6):1171-1176.]
李亚栋,何近刚. 2012. 植物多胺代谢与胁迫响应研究进展[J]. 华北农学报,27(S):240-245. [Li Y D,He J G. 2012. Advance in metabolism and response to stress of polyamines in plant[J]. Acta Agriculturae Boreali-Sinica,27(S):240-245.]
梁其干,熊显鹏,李艳军,张新宇,孙杰. 2019. 陆地棉GhSAMDC基因家族的全基因组分析[J]. 西北农业学报,28(3):388-396. [Liang Q G,Xiong X P,Li Y J,Zhang X Y,Sun J. 2019. Global genome analysis of GhSAMDC gene family in Gossspium hirsutum[J]. Acta Agriculturae Boreali-occidentalis Sinica,28(3):388-396.]
刘金仙,阙友雄,郭晋隆,许莉萍,徐景升,陈如凯. 2010. 甘蔗S-腺苷蛋氨酸脱羧酶基因Sc-SAMDC的克隆和表达分析[J]. 中国农业科学,43(7):1448-1457. [Liu J X,Que Y X,Guo J L,Xu L P,Xu J S,Chen R K. 2010. Molecular cloning of sugarcane S-adenosylmethionine decarboxy-lase gene(Sc-SAMDC) and its expression analysis[J]. Scientia Agricultura Sinica,43(7):1448-1457.]
刘长命,杨娜,文丹,路梦梦,明田田. 2019. 异源表达CmSAMDC基因拟南芥的耐盐性分析[J]. 江西农业学报,31(9):50-54. [Liu C M,Yang N,Wen D,Lu M M,Ming T T. 2019. Salt tolerance analysis of transgenic Arabidopsis thaliana plants with heterologous expression of CmSAMDC gene[J]. Acta Agriculturae Jiangxi,31(9):50-54.]
唐文武,吴秀兰. 2019. 白菜S-腺苷甲硫氨酸脱羧酶BrSAMDC基因的克隆、表达及生物信息学分析[J/OL]. 植物分子育种. http://kns.cnki.net/kcms/detail/46.1068.S.2019 1219.1415.004.html. [Tang W W,Wu X L. 2019. Clo-ning,expression and bioinformatic analysis of S-adenosylmethionine decarboxylase gene from Chinese cabbage[J/OL]. Molecular Plant Breeding. http://kns.cnki.net/kcms/detail/46.1068.S.20191219.1415.004.html.]
田楠坤. 2019. 全國及四川省柑橘生产现状及未来发展预测[J]. 粮食科技与经济,44(7):129-131. [Tian N K. 2019. Citrus production status and future development of China and Sichuan Province[J]. Grain Science and Technology and Economy,44(7):129-131.]
王广龙,却枫,陈伯清,任旭琴,王纪忠,熊爱生. 2017. 胡萝卜S-腺苷甲硫氨酸脱羧酶SAMDC基因的克隆及对非生物胁迫的响应[J]. 植物生理学报,53(3):413-421. [Wang G L,Que F,Chen B Q,Ren X Q,Wang J Z,Xiong A S. 2017. Cloning of S-adenosylmethioine decarboxylase gene SAMDC from Daucus carota and its response to abiotic stresses[J]. Plant Physiology Journal,53(3):413-421.]
王静. 2009. 柑橘类植物非生物胁迫下多胺变化及两个多胺生物合成基因的克隆与鉴定[D]. 武汉:华中农业大学. [Wang J. 2009. Changes in ployamine contents in citrus and its closely related species under abitic stresses and isolation,characterization of two ployamine biosynthetic genes[D]. Wuhan:Huazhong Agriculture University.]
文乐,黄诚梅,邓智年,曹辉庆,魏源文,李楠,吴凯朝. 2015. 甘蔗S-腺苷蛋氨酸脱羧酶基因Sc-SAMDC3的克隆和表达分析[J]. 南方农业学报,46 (11):1931-1936. [Wen L,Huang C M,Deng Z N,Cao H Q,Wei Y W,Li N,Wu K C. 2015. Molecular cloning of sugarcane S-adenosylmethionine decarboxylase gene(Sc-SAMDC3) and its expre-ssion analysis[J]. Journal of Southern Agriculture,46(11):1931-1936.]
张浩. 2018. 世界柑橘生产的变化及对我国柑橘发展的启示[J]. 农业开发与装备,(12):65. [Zhang H. 2018. Changes of citrus production in the world and enlightenment on the development of citrus in China[J]. Agricultural Deve-lopment and Equipments,(12):65.]
张雪梅,李保国,齐国辉,郭素萍. 2012. 外源多胺对不同苹果品种自花授粉花粉管生长的影响[J]. 南方农业学报,43(9):1344-1348. [Zhang X M,Li B G,Qi G H,Guo S P. 2012. Effects of exogenous polyamines on growth of self-pollinated pollen tube in different apple cultivars[J]. Journal of Southern Agriculture,43(9):1344-1348.]
赵维峰,孙光明,李绍鹏,杨小环,李茂富,杨文秀. 2004. 多胺与植物的抗逆性[J]. 广西农业科学,35(6):443-447. [Zhao W F,Sun G M,Li S P,Yang X H,Li M F,Yang W X. 2004. Polyamines and plant stress resistance[J]. Guangxi Agricultural Science,35(6):443-447.]
Alcázar R,Marco F,Cuevas J C,Patron M,Ferrando A,Carrasco P,Tiburcio A F,Altabella T. 2006. Involvement of polyamines in plant response to abiotic stress[J]. Biotechnology Letters,28(23):1867-1876.
Bouchereau A,Aziz A,Larher F,Martin-Tanguy J. 1999. Polya-mines and environmental challenges:Recent development[J]. Plant Science,140(2):103-125.
Groppa M D,Benavides M P. 2008. Polyamines and abiotic stress:Recent advances[J]. Amino Acids,34(1):35-45.
Kakkar R K,Nagar P K,Ahuja P S,Rai V K. 2000. Polya-mines and plant morphogenesis[J]. Biologia Plantarum,43(1):1-11.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2? ΔΔCt method[J]. Methods,25(4):402-408.
Mad Arif S A,Taylor M A,George L A,Butler A R,Burch L R,Davies H V,Stark M J,Kumar A. 1994. Characterisation of the S-adenosylmethionine decarboxylase (SAMDC) gene of potato[J]. Plant Molecular Biology,26(1):327-338.
Minocha R,Majumdar R,Minocha S C. 2014. Polyamines and abiotic stress in plants:A complex relationship[J]. Frontiers in Plant Science,5:175. doi:10.3389/fpls.2014. 00175.
Sinha R,Rajam M V. 2013. RNAi silencing of three homologues of S-adenosylmethionine decarboxylase gene in tapetal tissue of tomato results in male sterility[J]. Plant Molecular Biology,82(1-2):169-180.
Torrigiani P,Scaramagli S,Ziosi V,Mayer M,Biondi S. 2005. Expression of an antisense Datura stramonium S-adenosylmethionine decarboxylase cDNA in tobacco:Changes in enzyme activity,putrescine-spermidine ratio,rhizogenic potential,and response to methyl jasmonate[J]. Journal of Plant Physiology,162(5):559-571.
Wi S J,Kim S J,Kim W T,Park K Y. 2014. Constitutive S-adenosylmethionine decarboxylase gene expression increases drought tolerance through inhibition of reactive oxygen species accumulation in Arabidopsis[J]. Planta,239(5):979-988.
Wu X L,Tang W W. 2016. Cloning and expression analysis of the Cullin gene in Citrus reticulata[J]. Research Journal of Biotechnology,11(1):109-114.
(責任编辑 兰宗宝)

