“脑-肠轴”学说研究益生菌联合肠内营养对脑梗死大鼠免疫及认知功能的影响
王燕 石剑 贡丽雅 王凤姣
(河北医科大学第二医院营养科,河北 石家庄 050000)
脑梗死具有高发病率、高致残率、高致死率的特点,是导致人类死亡的主要原因之一〔1〕,近年来,其发病率不断提高,且呈现出明显的年轻化趋势,严重威胁人类身心健康〔2〕。脑梗死患者神经功能受损严重,常因意识不清而不能自主进食,引起不同程度的营养不良及免疫功能低下,还经常伴随肠道菌群失调、胃肠功能紊乱、肠黏膜屏障受损等并发症,影响其预后〔3〕。“脑-肠轴”是肠道菌群与大脑之间的双向通信系统,脑梗死患者即可通过脑-肠轴之间的神经、激素和免疫信号而影响肠道菌群的组成及代谢,进而影响胃肠功能造成各种并发症〔4〕,而肠道菌群与大脑之间是双向的调节关系〔5〕,因此通过影响肠功能修复脑梗死患者脑损伤是临床研究的热点。研究表明,脑梗死患者进行早期肠内营养支持,可维持患者营养支持,改善患者肠道功能紊乱和便秘症状,促进肠黏膜免疫系统细胞代谢和组织功能恢复,提高机体免疫功能,改善机体氧化应激状态,提高抗感染能力,进而减轻脑损伤,改善神经功能缺损症状〔6,7〕;益生菌主要是常见的乳酸杆菌及双歧杆菌,属于人体肠道正常菌群的优势菌,应用益生菌治疗可以抑制条件致病菌过度生长,有效维持肠道菌群平衡,并保护肠黏膜屏障〔8〕,并可有效提高机体免疫力〔9〕。但益生菌联合肠内营养对脑梗死大鼠肠黏膜屏障、免疫及认知功能的影响目前还不清楚,本文通过建立脑缺血再灌注大鼠模型,对其进行初步研究。
1 材料与方法
1.1动物 SD雄性大鼠〔许可证号:SCXK(粤)2013-0034,广东中医药大学动物实验中心〕,SPF清洁级,体重200~240 g,在清洁安静的环境中饲养,自然光照,温度保持在约25℃,湿度约为50%,噪音不高于80 dB,每小时保持通风换气约10次,定期清理鼠笼,消毒,更换垫料、饲料、饮水。
1.2主要试剂及仪器 双歧杆菌乳杆菌三联活菌片(蒙古双奇药业公司生产,国药准字为 S19980004);肠内营养混悬液〔纽迪希亚制药(无锡)有限公司生产,国药准字为H20030011〕;脂肪乳氨基酸(17)葡萄糖(11%)注射液(Fresenius Kabi AB生产,国药准字为J20040090);DAO检测试剂盒(上海晶抗生物工程有限公司生产,货号为JK-(a)-2773);D-乳酸检测试剂盒〔孟成科技(上海)有限公司生产,货号为K667〕;大鼠CD4+-PE(上海恒斐生物科技有限公司生产,货号为201507-1);大鼠CD8+-FITC(武汉博欧特生物科技有限公司生产,货号为orb248785);大鼠IgG ELISA试剂盒(美国Abcam公司生产,货号为ab189578);大鼠IgM酶联免疫吸附试验(ELISA)试剂盒(美国Abcam公司生产,货号为ab215085)等。XR-XC105型Morris水迷宫视频分析系统(上海欣软信息科技有限公司);CytoFLEX流式细胞仪(美国贝克曼库尔特公司);Centrifuge 5424R低温高速离心机(德国Eppendorf股份公司);制冰机、恒温水浴锅(北京六一仪器厂)等。
1.3动物模型制备及分组给药 参考文献〔10〕,将SD大鼠腹腔注射10%水合氯醛(4 ml/kg)麻醉,以仰卧位固定在鼠板上,颈部备皮后以75%酒精消毒,在正中做约2 cm的纵向切口,分离暴露左侧颈总动脉(CCA),在血管外预置缝线备用,沿CCA 向上继续分离暴露颈外动脉(ECA),以缝线结扎CCA及ECA近心端,以动脉夹夹闭CCA 远心端,在距CCA分叉部4 mm处剪一小口,插入0.24 mm的线栓后用缝线打一活结,取下动脉夹,稍提ECA继续缓慢插入线栓至感觉到阻力阻塞血管,扎紧CCA远心端的缝线,拴线尾端部分暴露于外,1.5 h后将栓线抽出,即完成缺血模型制备,根据大鼠活动情况,以Longa分级法〔11〕对造模后大鼠的神经功能缺损进行评分,标准:无神经功能缺损0分、不能完全伸展对侧前爪1分、行走向对侧转圈2分、行走向对侧倾倒3分、意识丧失,不能自发行走4分、死亡5分。评分1~3分为成功的大鼠模型〔12〕,共成功48只,将其随机分为模型组、益生菌组、肠内营养组、益生菌+肠内营养组,每组12只。另取12只大鼠仅麻醉后只暴露、分离CCA、ECA后缝合处理,作为假手术组。
各组大鼠均做空肠置管造瘘术:在幽门处插入直径约1.0 mm的无菌硅胶管,远端到达屈氏韧带以下5 cm处固定,由皮下隧道至颈背部肩胛间引出,各组大鼠均在首次用药前以微量输液泵推注2 ml生理盐水冲洗肠管。参照文献进行人鼠剂量换算,双歧杆菌乳杆菌三联活菌片,研磨后加入20 ml水中,以微量输液泵经肠管注入大鼠体内,每天300 mg/kg〔13〕,肠内营养液每天以微量输液泵经肠管注入大鼠体内35 ml,使总热量为35 kCal,每次推注5 ml,每天推注7次,两次推注的时间间隔为2 h〔14〕,假手术组、模型组、益生菌组每天以微量输液泵经肠管注入脂肪乳氨基酸(17%)葡萄糖(11%)注射液48 ml,使总热量保持为35 kCal,持续治疗14 d。
1.4标本收集及大鼠肠黏膜屏障检测 各组大鼠经尾静脉取血5 ml,取出1 ml备用,其余4 ml静置15 min,3 000 r/min,4℃离心15 min,取上清即血清备用。二胺氧化酶(DAO)是小肠黏膜上层绒毛中具有高度活性的细胞内酶,其活性与黏膜细胞的核酸和蛋白合成密切相关,可反映肠道机械屏障的完整性和受损伤程度,D-乳酸是肠道内细菌产生的,当肠黏膜受损时,会进入血液,可及时反映肠黏膜受损程度和通透性,故检测血清中DAO、D-乳酸水平,可反映肠黏膜屏障完整性及功能〔15〕。
取收集的血清500 μl分别用DAO、D-乳酸检测试剂盒检测血清中DAO、D-乳酸水平,操作步骤参照说明书进行。
1.5大鼠免疫功能检测1.4中的血清500 μl分别用ELISA试剂盒检测血清中IgG、IgM含量,操作步骤参照说明书进行。1.4中的血液以红细胞裂解液在冰浴下裂解30 min,1 000 r/min,4℃离心5 min,以磷酸盐缓冲液(PBS)洗涤细胞沉淀后计数,取约含有1×106个细胞的细胞液,加入大鼠PE-anti-mCD4、FITC-anti-mCD8单克隆抗体后振荡混匀,4℃,避光孵育40 min,1 000 r/min,4℃离心5 min,PBS洗涤细胞沉淀,加入0.5 ml PBS重悬后混匀,采用流式细胞仪检测T淋巴细胞CD4+和CD8+百分比,并计算其比值。
1.6大鼠神经功能缺损情况检测 大鼠末次给药结束24 h后,观察各组大鼠活动情况,以Longa分级法〔11〕对其神经功能缺损情况进行评分。
1.7大鼠认知功能检测 大鼠末次给药结束24 h后,以Morris水迷宫实验检测各组大鼠认知功能,参照文献〔16〕:准备一个Morris直径160 cm、高 50 cm的水迷宫水池,将其分为4个象限,并在每个象限水池壁的正中分别固定4个不同形状的标记作为参照物,向水池中注水,水温保持22~26℃,水深22 cm,在第三象限正中放置直径12 cm,高20 cm的平台。在实验开始前1 d将大鼠放入水池中进行适应训练,实验共进行6 d,前5 d为定位航行实验,将大鼠面朝池壁的标记从第一至第四象限放入水中,记录大鼠找到水下平台的时间,即为平均逃避潜伏期;第6天为空间探索实验,撤去平台,将大鼠面朝池壁的标记从第一象限放入水中,记录其在1 min内穿越平台原位置的次数,以用来评估大鼠空间学习和记忆能力。
1.8统计学分析 采用SPSS24.0软件进行方差分析,t检验。
2 结 果
2.1各组肠黏膜屏障功能比较
2.1.1各组血浆中DAO、D-乳酸水平比较 与假手术相比,模型组DAO、D-乳酸的水平均明显升高(P<0.05);与模型组相比,益生菌组、肠内营养组、益生菌+肠内营养组DAO、D-乳酸的水平均明显降低(P<0.05);与益生菌组、肠内营养组相比,益生菌+肠内营养组DAO、D-乳酸的水平均明显降低(P<0.05),见表1。

表1 各组血浆中DAO、D-乳酸水平比较
2.2各组免疫功能比较
2.2.1各组血清中IgG、IgM含量比较 与假手术组相比,模型组IgG、IgM含量均明显降低(P<0.05);与模型组相比,益生菌组、肠内营养组、益生菌+肠内营养组IgG、IgM含量均明显升高(P<0.05);与益生菌组、肠内营养组相比,益生菌+肠内营养组IgG、IgM含量均明显升高(P<0.05),见表2。
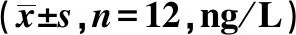
表2 各组血清中IgG、IgM含量比较
2.2.2各组血清中T淋巴细胞CD4+/CD8+比较 与假手术组(2.15±0.25)相比,模型组CD4+/CD8+明显降低(1.48±0.16,P<0.05);与模型组相比,益生菌组(1.77±0.19)、肠内营养组(1.79±0.20)、益生菌+肠内营养组(2.05±0.24)CD4+/CD8+均明显升高(P<0.05);与益生菌组、肠内营养组相比,益生菌+肠内营养组CD4+/CD8+均明显升高(P<0.05),见图1。
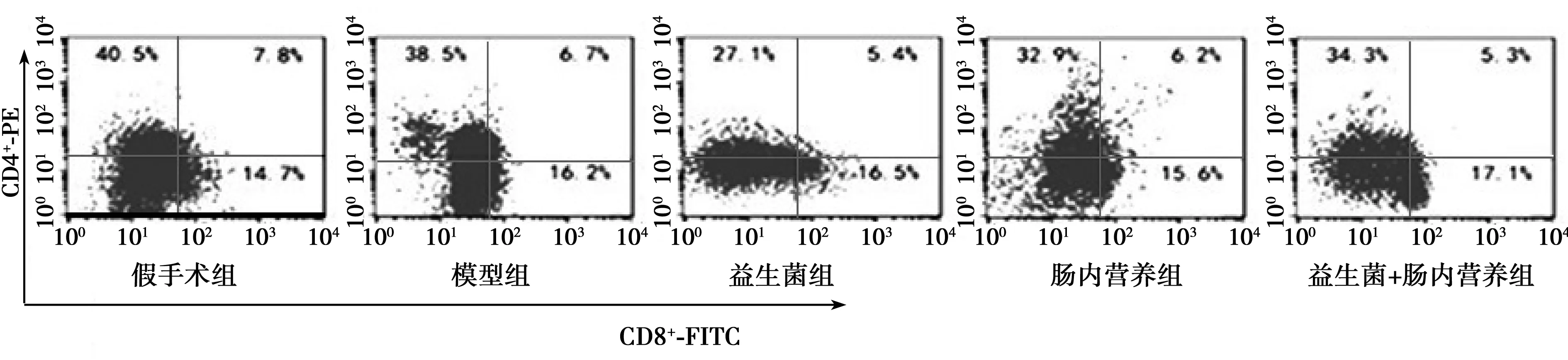
图1 各组血清中T淋巴细胞CD4+、CD8+比例
2.3各组认知功能比较
2.3.1各组神经功能缺损评分比较 与假手术组〔(0.00±0.000)分〕相比,模型组神经功能缺损评分明显升高〔(2.81±0.27)分,P<0.05〕;与模型组相比,益生菌组〔(1.96±0.19)分〕、肠内营养组〔(1.93±0.26)分〕、益生菌+肠内营养组〔(0.98±0.16)分〕神经功能缺损评分均明显降低(均P<0.05);与益生菌组、肠内营养组相比,益生菌+肠内营养组神经功能缺损评分均明显降低(P<0.05)。
2.3.2各组水迷宫实验结果比较 与假手术组(6.80±1.20)相比,模型组水迷宫实验从第3天起平均逃避潜伏期明显升高(P<0.05),穿越原平台位置次数明显降低(P<0.05);与模型组相比,益生菌组、肠内营养组、益生菌+肠内营养组水迷宫实验从第3天起平均逃避潜伏期明显降低(P<0.05),穿越原平台位置次数升高(P<0.05);与益生菌组、肠内营养组相比,益生菌+肠内营养组大鼠水迷宫实验从第3天起平均逃避潜伏期明显降低(P<0.05),穿越原平台位置次数明显升高(P<0.05),见表3。

表3 各组平均逃避潜伏期、大鼠穿越原始位置次数比较
3 讨 论
脑-肠轴是脑和肠道之间由神经、激素和免疫信号组成并相互影响的通信系统,通过该通信系统,机体大脑和肠道之间可相互影响,即神经系统可通过脑-肠轴影响肠道微生物的组成及数量,介导肠道免疫及吸收功能;肠道微生物群及其代谢物也可通过脑-肠轴调节神经系统功能,影响神经系统相关疾病的发病进程,因为肠道微生物在其中起到关键作用,故又称为微生物-脑-肠轴〔17〕。脑梗死会影响患者肠道菌群组成,使致病菌增多,有益菌下降,损伤肠黏膜屏障,肠内营养治疗可纠正肠道菌群组成,修复肠黏膜结构,提高免疫功能〔18〕。益生菌是胃肠道的共生菌,可恢复肠道菌群正常组成,修复肠道屏障功能,并通过调节肠道细胞免疫反应提供机体免疫力〔19〕。对重度颅脑损伤患者的治疗中,益生菌联合肠内营养可有效调整肠道菌群,改善患者的营养状况,降低菌群失调、肺部感染和腹泻的发生率〔20〕,根据“脑-肠轴”学说,益生菌联合肠内营养预计可提高脑梗死患者免疫力,修复肠黏膜屏障,提高患者认知功能。本研究结果表明脑梗死大鼠肠黏膜屏障明显受损,免疫力降低,神经功能受损,认知能力下降。揭示脑梗死大鼠会因脑损伤引起肠肠黏膜屏障及免疫功能受损,和“脑-肠轴”学说理论相符。本研究结果表明益生菌、肠内营养治疗均可修复大鼠肠黏膜屏障,恢复受损神经功能,提高免疫力及认知能力,两者联合应用具有协同作用,比单独应用效果好,揭示益生菌联合肠内营养对治疗脑梗死具有良好的效果,为脑卒中的临床治疗提供了新的思路。

