Bcl-2转录抑制因子1在肝癌组织中的表达及意义
刘佳玲,黄林生,张朔,祁莎莎,鲍阳,李飞
(1.湖北医药学院药学院 药理学系,湖北 十堰 442000;2.湖北省十堰市太和医院 肝胆胰外科,湖北 十堰 442000;3.武当特色中药研究湖北省重点实验室,湖北 十堰 442000)
原发性肝癌是指肝细胞或肝内胆管上皮细胞发生的恶性肿瘤,包括肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和混合型(HCC-ICC) 3种不同病理类型,其中HCC占85%~90%以上[1]。《临床肿瘤杂志》[1]最新全球癌症数据显示:肝癌发病率位居世界第6位,病死率位居第4位,其5年生存率位居第4位,大约在5%~30%左右[2]。流行病学研究指出,慢性乙型肝炎、慢性丙型肝炎、大量饮酒、食用被黄曲霉污染的食物、肥胖、吸烟和2型糖尿病是导致HCC的主要危险因素[3]。HCC早期治疗方法包括手术切除、射频消融或肝移植,经导管化疗栓塞是中晚期的治疗方法[4-7]。尽管化疗介入、分子靶向治疗等为肝癌治疗带来显著改善,但由于大部分患者就诊时已是晚期且肝内和远端转移率高发,导致患者预后情况不容乐观[8-9]。因此,进一步探究HCC发生发展相关分子机制,以寻求新的HCC肿瘤标志物,早诊早治改善患者预后[10]。
Bcl-2 转录抑制因子1(Bcl-2 inhibitor of transcription 1,Bit1)是2004年发现的一种与失巢凋亡相关的新蛋白[11]。Bit1基因PTRH2,位于17q23.2,mRNA长约1 kb,编码179个氨基酸,Bit1蛋白定位于线粒体外膜[12],分子量约为27 kD。Bit1是一种失巢凋亡效应分子,其可能影响肿瘤发生发展。近年,只在部分肿瘤中对Bit1进行了相关研究,且表达情况呈肿瘤特异性,目前尚无学者研究Bit1与HCC的关系。本课题采用qRT-PCR、Western blot、IHC法检测HCC患者癌组织及对应癌旁组织Bit1 mRNA及蛋白水平,首次探究Bit1在HCC组织中的表达情况及临床意义,为Bit1可望成为HCC患者诊断预后标志物或个体化治疗作用靶点奠定理论基础。
1 材料与方法
1.1 标本来源
收集2016年6月—2018年6月十堰市太和医院34例HCC患者术后肿瘤组织及对应癌旁组织(距病灶边缘5 cm)。患者手术前均未接受放化疗治疗,年龄36~73岁。本研究通过湖北医药学院伦理审查委员会批准,所有患者均签署知情同意书。该样品用于Western blot及qRT-PCR实验,初步探究Bit1在HCC组织中的表达水平。
180点HCC组织芯片(购自上海芯超生物科技有限公司,芯片号:HLivH180Su07)收录了2006年 2月—2007年5月期间接受正规手术治疗的90例患者资料,术后随访至2012年2月,随访5~6年。所有患者术前均未接受过任何治疗,具有完整的随访资料。该样品用于免疫组化实验,进一步探究Bit1表达与HCC患者临床病理参数及预后生存情况的关系。
1.2 主要试剂
反转录试剂盒iScript gDNA Clear cDNA Synthesis Kit、iTaq Universal SYBR Green Supermix购自Bio-rad;TRIzol购自Invitrogen;RIPA Buffer(CST,#9806);Cocktail (CST,#5871);BCA试剂盒(Thermo Scientific,PL212739);Anti-PTRH2 antibody(Abcam,ab36990);β-actin(13E5)Rabbit mAb(CST,#4970);细胞色素C氧化酶IV(COX IV)antibody(CST,#4850S);Goat anti-Rabbit IgG H&L(HRP)(Abcam,ab97051);免疫组化试剂盒EnVision™ FLEX+,Mouse,High pH,(Link)购自Dako;苏木素(Sigma aldrich,SLBT4555)。
1.3 方法
1.3.1 qRT-PCR检测Bit1 mRNA表达水平引物由上海英骏生物技术有限公司合成,PTRH2上游:5'-TGA CTT AAA GAT GGG AAA AGG G-3',下游:5'-CCA ATA ATG CAA TCA GGG TT-3';GAPDH上 游:5'-TGA CTT CAA CAG CGA CAC CCA-3',下游:5'-CAC CCT GTT GCT GTA GCC AAA-3'。总RNA的提取:取30 mg组织,加入 1 mL TRIzol试剂,冰上剪碎匀浆,按常规TRIzol法提取总RNA。NanoDrop2000c分光光度计(Thermo Scientific)测定A260/A280的比值及总RNA浓度。qRT-PCR:使用反转录试剂盒iScript gDNA Clear cDNA Synthesis Kit合 成cDNA。以cDNA样品为模板、GAPDH为内参基因,按照iTaq universal SYBR Green Supermix说明书配置10 μL反应体系,反应条件:95 ℃预变性 3 min;再进行95 ℃、3 s变性,PTRH2 52.5 ℃、1 min退火延伸,GAPDH 59.2 ℃、1 min退火延伸,重复40个循环,荧光定量PCR仪进行qRTPCR,每个样品设置3个复孔,采用Bio-Rad CFX manager软件分析,按照2-ΔΔCt法计算PTRH2的mRNA相对表达量。
1.3.2 Western blot检测Bit1蛋白表达水平总蛋白提取:取30 mg组织,加入300 μL1×RIPA裂解液(含cocktail)。冰上剪碎、匀浆超声后,裂解30 min。12 000 r/min,4 ℃离心20 min,获取组织总蛋白。BCA试剂盒进行蛋白浓度测定,ddH2O将样品稀释至同一浓度,加入2×loading buffer混匀,沸水煮10 min后,冰浴5 min,于 -80 ℃储存。SDS-PAGE:每孔加入约30 μg蛋白样品,进行10%/12.5%SDS-PAGE电泳分离后,将蛋白转印到0.22或0.45 μm PVDF上,冰浴中300 mA恒流转膜90 min,将PVDF膜移至5%脱脂牛奶室温封闭2 h后,转移至相应一抗(β-actin 1:2 000,Bit1 1:500,COX IV 1:10 000)孵育2 h,Goat Anti-Rabbit IgG H&L二抗(1:10 000)室温孵育1.5 h后,ImageQuant LAS4000凝胶成像仪拍照并进行光密度值分析。
1.3.3 免疫组化检测Bit1蛋白表达水平将组织芯片放入烘箱,63 ℃,烘蜡1 h。二甲苯脱蜡、梯度酒精水化和ddH2O洗涤后,置于柠檬酸修复液,加热进行抗原修复,自然冷却至室温,使用商品化的即用阻断剂阻断内源性过氧化物酶。PBS洗涤 3次,山羊血清封闭后,滴加Bit1一抗(1:200),4 ℃孵育过夜。第二天PBS洗涤3次后,加反应增强剂,37 ℃孵育30 min,滴加二抗,室温孵育30 min。DAB显色、苏木素复染、0.25%的盐酸酒精中浸没后,用自来水洗涤,室温晾干后封片。结果判定标准:根据染色阳性率评分,0分(阴性)、1分(1%~25%)、2分(26%~50%)、3分(51%~75%)、4分(76%~100%)根据染色强度评分,0分(阴性)、1分(1+)、2分(2+)、3分(3+),以“染色阳性率评分”和“染色强度评分”的乘积为总评分进行分组,0~5分为低表达,6~12分为高表达。
1.4 统计学处理
所有资料采用SPSS 22.0统计软件进行分析,计量资料采用均值±标准差(±s),癌组织与对应癌旁组织蛋白灰度扫描值与mRNA相对表达量的比较采用配对t检验,计数资料的比较采用χ2检验,分析Bit1的表达与性别、年龄、肿瘤大小、分化程度、TNM分期等临床病理参数的关系。Kaplan-Meier生存曲线分析Bit1不同表达的HCC患者术后5年生存率。P<0.05为差异有统计学意义。
2 结 果
2.1 34例HCC组织及其对应癌旁组织中Bit1 mRNA表达水平
PTRH2、GAPDH溶解曲线均为特异性单峰,表明引物特异性较好(图1A-B)。qRT-PCR结果显示:Bit1 mRNA在HCC组织中的相对表达水平为2.24±0.28,对应癌旁组织中的相对表达水平为1.00±0.09,其差异具有统计学意义(P=0.007)(图1C)。

图1 qRT-PCR法检测Bit1 mRNA表达Figure 1 Expressions of Bit1 mRNA detected by qRT-PCR
2.2 34例HCC患者癌组织及其对应癌旁组织中Bit1蛋白表达水平
COX IV是线粒体内膜上的跨膜蛋白复合体,在线粒体蛋白的检测中,COX IV可用作线粒体蛋白上样内参。Western blot结果显示,HCC组织中Bit1蛋白表达水平显著高于癌旁组织(图2A):8例样品为代表图。其灰度扫描值的统计结果为:以β-actin为内参,Bit1在HCC组织中的灰度值为3.46±0.40,癌旁组织为1.00±0.20(图2B);以COX Ⅳ为内参,Bit1在HCC组织中的灰度值为3.75±0.45,癌旁组织为1.00±0.22(图2C),其差异均有统计学意义(P=0.000)。
2.3 免疫组化检测组织芯片中Bit1蛋白表达水平
2.3.1 Bit1在HCC及癌旁组织中的表达Bit1蛋白定位于细胞质,镜下阳性细胞呈棕黄色,与癌旁组织比较,Bit1在癌组织中的染色阳性率、染色强度明显高于癌旁组织(图3);且在90例HCC组织中,74例(82.2%)Bit1蛋白高表达,在 90例癌旁组织中50例(55.6%)Bit1蛋白高表达,Bit1蛋白在HCC组织中的高表达率明显高于癌旁组织(P<0.001)(表1)。

图2 Western blot检测Bit1蛋白表达Figure 2 Expressions of Bit1 protein detected by Western blot

图3 免疫组化法检测组织芯片中Bit1蛋白表达(左:×20,右:×200)Figure 3 Expressions of Bit1 protein in tissue chip detected by immunohistochemical staining (left:×20,right:×200)

表1 在HCC组织及癌旁组织中Bit1蛋白表达率比较[n(%)]Table 1 Comparison of expression rates of Bit1 protein in HCC tissues and adjacent tissues [n (%)]
2.3.2 Bit1在HCC组织中的表达水平与临床病理参数的关系结果显示Bit1蛋白表达与肿瘤复发,病理分级均有关(均P<0.05),与性别、年龄、肿瘤大小、数量、是否患乙肝、是否肝硬化、肝硬化结节大小、AFP水平、肿瘤是否有包膜、TNM分期均无明显关系(均P>0.05)(表2)。
2.3.3 Bit1蛋白表达水平与HCC患者生存期的关系经Kaplan-Meier生存分析及Log-rank检验显示,Bit1蛋白高表达患者总生存率和无病生存率缩短,可能由于样本例数较少,差异无统计学意义(P=0.547、0.414)(图4)。
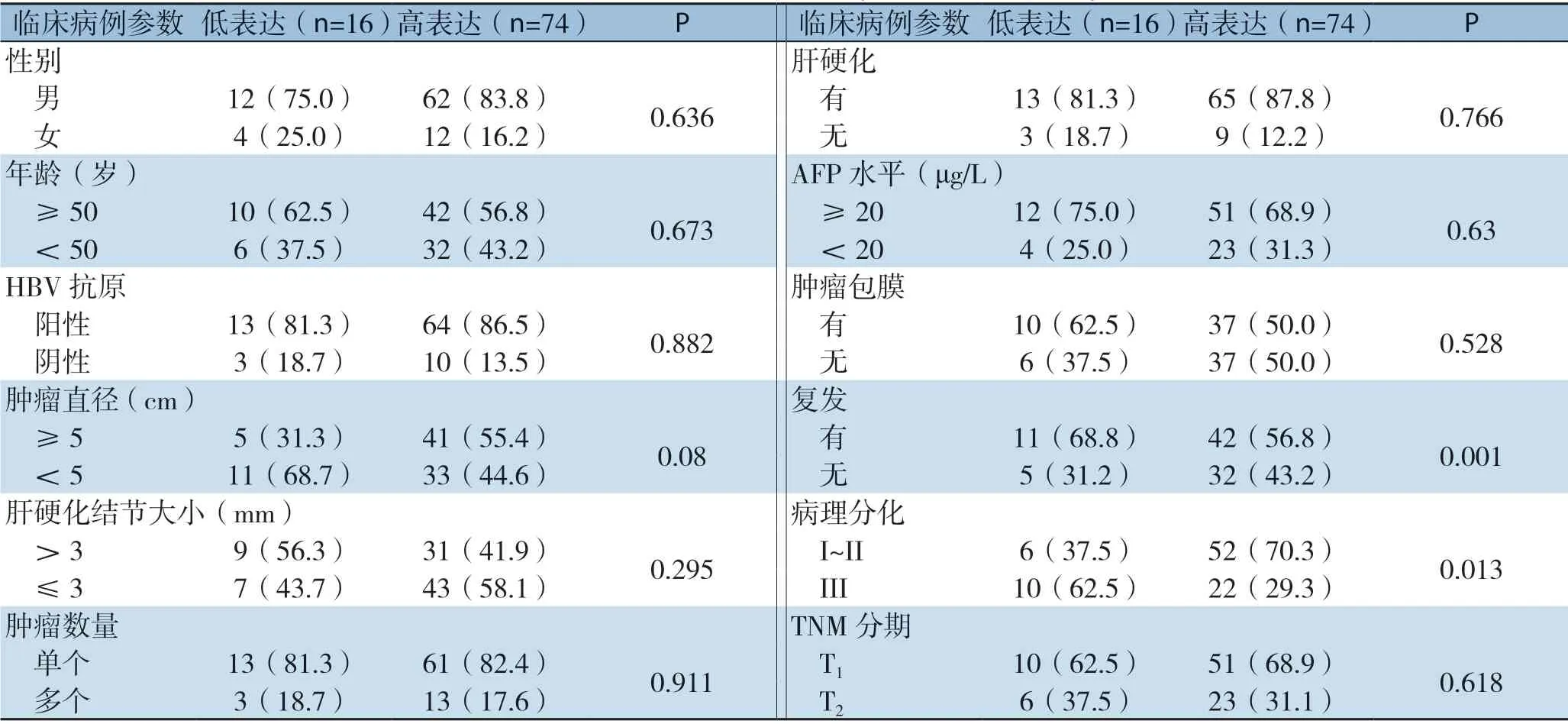
表2 Bit1在HCC组织中的表达与临床病理参数的关系[n(%)]Table 2 Association of Bit1 levels with clinical parameters of HCC patients [n (%)]

图4 Kaplan-Meier分析Bit1表达水平对HCC患者术后总生存的影响Figure 4 Influence of Bit1 expression level on postoperative survival of the HCC patients analyzed by Kaplan-Meier method
3 讨 论
目前为止,与HCC相关的主要基因有p53、细胞色素P450 1A1(CYP1A1)、醌氧化还原酶(NQO1)、环氧化物水解酶(EPHX1)、乙醛脱氢酶2(ALDH2)基因等,这些基因的异常表达导致相关信号通路的调控紊乱进而影响HCC的发生与发展[13-19]。常见的HCC标志物有甲胎蛋白(AFP)、α-L岩藻糖苷酶(AFU)、去饱和-γ-羧基-凝血酶原(DCP)、磷脂酰肌醇蛋白聚糖-3(GPC-3)[20-24]等,其中AFP是目前推荐在临床上常规使用筛查HCC高危人群的标志物,但多数肿瘤标志物在疾病早期处于正常值,而到中晚期才出现异常升高,因此探究HCC早期肿瘤标志物对疾病的早发现、早治疗及改善患者预后至关重要。
研究发现Bit1是一种失巢凋亡效应分子,在肿瘤发展过程中,肿瘤细胞通过抵抗失巢凋亡得以生存,因而,Bit1可能参与多种肿瘤发生发展,有望成为肿瘤患者的诊断、预后标志物或个体化治疗靶点。目前,已有的研究结果显示Bit1表达情况呈肿瘤特异性,与癌旁组织比较,Bit1在食管癌、口腔癌、卵巢癌、胃癌等组织中高表达[25-28],而在肺癌、胰腺癌、乳腺癌等组织中低表达[29-31]。同时发现,在食管鳞状细胞癌组织(esophageal squamous cell carcinoma,ESCC)中,伴淋巴结转移、TNM III和IV期ESCC组织中Bit1 mRNA及蛋白水平显著高于未淋巴结转移、TNM I和II期ESCC组织Bit1表达水平,且低分化癌组织中的Bit1 mRNA水平明显高于高分化和中分化癌组织,因此研究[27,32]认为Bit1在ESCC中可能作为一种癌基因,促进癌细胞转移,加速癌症进展。然而,Bit1在胰腺癌组织中低表达,且表达水平与患者血清CEA水平及神经浸润程度相关,Bit1可能作为一种抑癌基因阻碍胰腺癌进一步恶化[33]。Bit1可通过影响肿瘤细胞增殖、凋亡、迁移和侵袭等能力从而在不同肿瘤中发挥促癌和抑癌两种截然相反的作用。Bit1可能通过激活FAK-PI3K-Akt-NF-κB或FAK-paxillin等通路发挥促癌作用[34],或负性调节Erk通路及抑制EMT发生发挥抑癌作用[35]。
至今尚未见Bit1与HCC之间关系的研究。本研究通过qRT-PCR、Western blot实验检测34例HCC患者手切切除的癌组织及对应癌旁组织中的Bit1 mRNA及蛋白表达水平,免疫组化法检测组织芯片中90例对应匹配的癌组织及癌旁组织中Bit1的蛋白表达水平,结果均显示:与癌旁组织比较,Bit1在HCC组织中的mRNA及蛋白表达水平显著上调,提示Bit1可能在HCC中作为一种癌基因影响肿瘤发生发展,根据患者相关的临床病理信息及术后随访资料,统计分析显示:Bit1表达与HCC患者的肿瘤复发及病理分级密切相关,且Bit1蛋白高表达患者总生存时间和无病生存时间均低于低表达患者,这一结果提示Bit1高表达预示患者术后预后不良,故其可能对HCC患者的诊断、治疗、预后产生重要影响,以上结果为更进一步研究Bit1在HCC中的生物学功能及具体作用机制奠定理论基础。目前,本课题组其他成员通过慢病毒转染技术沉默HCC细胞株内源性Bit1表达水平,利用细胞划痕实验及Transwell实验检测其对癌细胞迁移和侵袭能力的影响,CCK-8实验、流式细胞术及TUNEL实验检测其对细胞增殖和凋亡的影响,结果显示:沉默Bit1可明显抑制HCC细胞增殖、迁移、侵袭,而促进HCC细胞凋亡,印证了本文Bit1在HCC中作为一种癌基因影响肿瘤发展这一观点。
综上所述,本课题组首次发现Bit1在HCC组织中高表达,其可能作为一种癌基因,成为HCC患者诊断及预后的生物标志物或个体化治疗靶点,但其具体作用机制、应用价值还有待于进一步研究。

