肿瘤坏死因子-α和基质金属蛋白酶-1与老年心肌梗死后心室重构的关联研究
赵志坤 翟红霞 李良 刘润梅 夏云峰
冠心病属于缺血性心脏病变,是因冠状动脉发生粥样硬化性改变导致的管腔不同程度狭窄或闭塞而诱发的心肌缺血、缺氧性心脏病。急性心肌梗死(AMI)为冠心病的一种急危重症型。近年来我国AMI的发病率出现上升趋势,该病已经成为危害中老年人健康与生命安全的一项重要疾病。老年人因机体诸多功能衰退,为AMI的高危人群。同时,AMI发生后更易出现心室重构,而心室重构则为心力衰竭的一项主要诱因,因此尽早确诊心室重构及时治疗是提高老年AMI患者预后的基础[1-3]。在冠状动脉粥样硬化的形成与演进过程中诸多细胞因子的表达水平随之发生异常改变,特别AMI后诸多炎性因子、细胞黏附因子、内皮细胞因子等均出现改变[4-6]。其中基质金属蛋白酶(MMPs)系列因子受到临床广泛关注,目前临床上研究较多的集中在MMP-9、MMP-10上,对于MMP-1的研究较少。MMPs为细胞外基质降解的重要蛋白水解物系统,其系列因子均具有削减纤维帽稳定性,促进动脉内粥样硬化斑块与血栓形成的作用。在正常成人组织中,MMP-1的表达极低,但在病理重塑过程中,MMP-1的表达异常增加,并且随着AMI的加重,心肌中MMP-1的表达显著增加[7]。肿瘤坏死因子-α(TNT-α)是由单核/巨噬细胞分泌的多肽类物质,在感染、组织修复、肿瘤等过程中能够反映机体的炎症活跃程度。当心肌梗死在体内发生时,TNF-α由心脏巨噬细胞产生,同时也可能由梗死区及其周围区域的心肌细胞产生。AMI发生后,TNF-α水平立即升高,12 h内达到峰值[8]。此外,TNF-α是与炎性反应相关的重要因子,而局部炎性细胞浸润和释放具有生物学活性的介质是导致冠状动脉内硬化斑块不稳定的重要因素[9]。为了明确炎性因子TNF-α、MMP-1与老年AMI患者心室重构的关联,本院特开展本次研究,报道如下。
1 资料与方法
1.1 一般资料 于2016年1月至2018年1月本院收治的急性心肌梗死(AMI)老年患者中,选取PCI术后1个月内发生左心室重构的48例患者纳入研究组,选取同期未发生左心室重构的48例患者纳入对照组。2组入选患者年龄、性别构成、体重指数(BMI)比较,差异均无统计学意义(P>0.05)。见表1。

表1 2组一般资料比较 n=48
1.2 病例选取标准
1.2.1 诊断与治疗标准:《急性心肌梗死诊断和治疗指南》[8]、《经皮冠状动脉介入治疗指南》[9],左心室重构标准:PCI术后出院前与术后1个月时左心室收缩末期容积(LVESV)增大≥15%[10,11]。
1.2.2 纳入标准:①经本院医学影像学、心肌酶学、心电图等检查后符合上述AMI诊断标准的AMI首发患者;②同时符合PCI治疗标准的AMI患者;③在本院接受PCI治疗后1个月内发生心室重构的患者;④年龄≥65岁的患者;⑤本人和(或)家属自愿加入本次研究的。
1.2.3 排除标准:①陈旧性AMI复发患者;②合并心房颤动、病窦综合征、Ⅱ~Ⅲ度房室传导阻滞、度房室传导阻滞、病窦综合征、室性心律失常、心源性休克者;③合并结缔组织病,肺、肝、肾等重要脏器功能不全的患者;④入组前2周内有重大外伤或手术史的患者;⑤合并先天性心脏病、心瓣膜病、心肌病等其他心脏疾病及继发性高血压的患者;⑥心功能Ⅳ级患者。
1.3 观察方法 观察2组患者PCI术后1个月的心功能指标:左心室质量指数(LVMI)、左心室射血分数(LVEF)、室间隔厚度(IVS)、左心室收缩末期容积(LVESV),血清指标:血清TNF-α、MMP-1表达水平;分析血清指标与左心室质量指标、心功能间的相关性,血清指标与患者AMI后发生心室重构间的关系。
1.3.1 心功能指标使用彩色多普勒超声诊断仪检测,连续测量3个心动周期的舒张末左心室内径(LVDd)、左心室后壁厚度(PWT)、舒张末期室间隔厚度(IVS)取均值,按Deiereux左心室质量(LVM)校正公式:LVM(g)=0.8×10.4[(IVST+PWT+LVDd)3-LVDd3]+0.6计算;按公式:LVMI(g/m2)=LVM/BSA(体表面积)计算LVMI。
1.3.2 血清指标:血清TNF-α、MMP-1表达水平检测,采集全部入选患者空腹外周静脉血样3 ml,使用离心机按3 000 r/min速度离心10 min后取得上层血清,按免疫酶联吸附法(ELISA),试剂盒均购自上海酶联生物科技公司。
2 结果
2.1 心功能指标 2组患者lVMI、LVEF、IVS、LVESV水平比较,差异均有统计学意义(P<0.05)。见表2。

表2 2组患者心功能指标比较
2.2 血清指标 2组患者血清TNF-α、MMP-1表达水平比较,差异均有统计学意义(P<0.05)。见表3。

表3 2组患者血清指标比较
2.3 相关性分析 TNF-α与LVMI、IVS、LVESV及是否发生心室重构间呈高度正相关(P<0.05),与LVEF呈高度负相关性(|r|≥0.8,P<0.05);MMP-1与LVMI、LVESV呈高度正相关(|r|≥0.8),与IVS呈中度正相关(P<0.05)、与LVEF呈中度负相关性(0.5≤|r|<0.8),与是否发生心室重构间呈低度正相关(0.3≤|r|<0.5,P<0.05)。见表4。
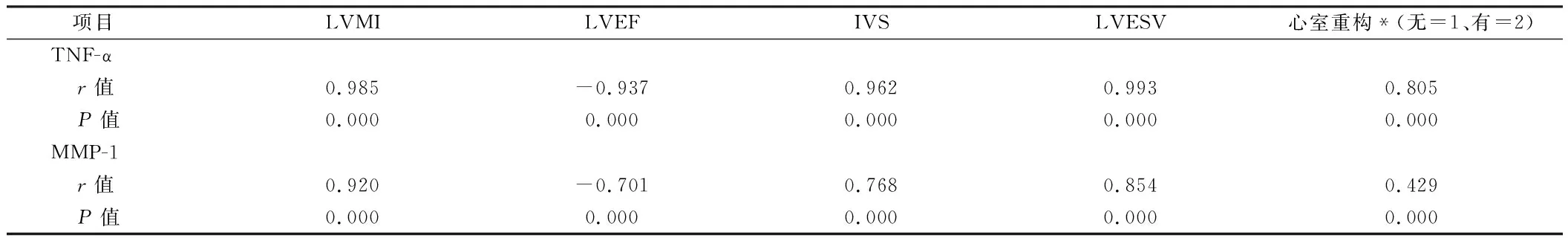
表4 血清指标与心功能、心室重构相关性分析统计值明细
2.4 二元Logistic分析 Logistic分析结果提示:血清TNF-α、MMP-1均为AMI后心室重构发生的独立危险因素(OR>1,P<0.05)。见表5。

表5 血清TNF-α、MMP-1与心室重构关系的Logistic分析统计值明细
3 讨论
目前,AMI临床诊断的主要生物标志物包括肌钙蛋白、肌红蛋白和肌酸激酶同工酶等[12]。虽然上述血清生物标志物在AMI的早期诊断中已达到一定水平的敏感性和特异性,但研究人员致力于开发具有高灵敏度和特异性的新的危险因素,特别是对于能够有效反映AMI患者预后的危险因素[13]。心脏为心肌细胞与心肌细胞的外间质所组成,发生AMI后心肌重构的过程包括心肌细胞的肥厚、凋亡与坏死等一系列病理改变与细胞外间质异常改变[14,15]。AMI后心室重构AMI后心力衰竭的一项主要诱因,对患者的预后质量与生存周期均构成不良影响[16]。
目前临床上认为MMPs与AMI后心室重构具有明确相关性[17,18]。MMPs是一组专门降解细胞外基质成分的酶家族。人体内有20多种MMPs,其中MMP-1是胶原酶。纤维类胶原是其主要的水解底物,包括Ⅰ、Ⅱ、Ⅲ型。MMPs的过度表达可导致心肌细胞外基质结构的改变,并导致心室重构[19]。正常状态下MMPs正常表达以维持心脏的正常胶原代谢过程。AMI的发生使心肌细胞发生缺血性凋亡,增大胶原吸收,使MMPs合成出现异常升高,活性异常增强,致使梗死区域的胶原降解加快,引发病理性胶原降解亢进,使胶原网络的心肌支持力下降,梗死区发生膨展、心肌细胞出现滑位,临终导致心室重构、心脏进行性扩张、心功能衰竭。MMP-1为MMPs家庭中的重要成员,其具有较高敏感性。TNF主要由TNF-α和TNF-β两种亚型组成,虽然它们属于同一个家族,但它们却具有着不同的生物学功能。前者主要由单核巨噬细胞分泌,负责机体的炎性反应;后者主要来源于淋巴细胞,主要负责机体的免疫调节和免疫反应。炎性的一般过程是炎性区的免疫细胞首先激活,释放各种趋化因子和炎性因子,诱导血液中的炎性细胞迁移到炎性部位。在趋化因子和炎性因子的介导下,各种炎性细胞交换信息,激活生物功能,最终达到消炎的目的。当然,并不是所有的炎性反应在疾病发生过程中都是有益的,也不是任何程度的炎性反应都是适当的[20]。TNF-α对于成熟性的心肌细胞具有明确的负性肌力,能够改变心室的舒张黏性与弹性。AMI发生后心肌细胞随之发生炎性应激反应,致使TNF-α等诸多炎性细胞因子的表达水平发生异常升高,而TNF-α的释放量上升可致左心室容积的异常增加,加重了左室腔顺应性的损伤,从而发挥了抑制左心室射血功能的作用。TNF-α主要经由以下渠道抑制心肌的收缩能力:(1)减低肌浆网的功能,拮抗收缩性心肌与Ca2+的结合而直接抑制心肌收缩;(2)TNF-α可由一氧化氮介导发挥降低肌丝组织对于Ca2+的敏感程度,而间接抑制心肌收缩;(3)TNF-α还可降低Ca2+的释放量而抑制心肌收缩能力,同时发挥破坏L型Ca2+通道的作用。在AMI患者中,过度的炎性反应往往会导致更差的预后。TNF-α在炎性反应初期由单核巨噬细胞分泌,并且它能激活其他炎性因子,增加血管通透性,诱导和趋化其他免疫细胞迁移至炎症部位。TNF-α是“瀑布样”炎性反应最关键的引发因子。TNF-α同时还能够通过诱导单核巨噬细胞吞噬氧化低密度脂蛋白,进而促进冠状动脉粥样硬化斑块形成[21]。
本次研究中我们根据老年AMI患者PCI后是否发生心室重构进行了分组对比分析,结果表明,2组患者的心功能指标与血清TNF-α、MMP-1表达水平均具有明确的统计学差异,提示AMI后心室重构的老年患者的心功能指标:LVMI、LVEF、IVS、LVESV与血清TNF-α、MMP-1表达水平与未发生心室重构的老年患者具有明确差异性,为后续研究提供了理论可行性。通过统计学分析表明,TNF-α、MMP-1的异常升高表达与LVMI、IVS、LVESV呈正相关性,与LVEF呈负相关性,提示TNF-α、MMP-1表达水平越高则患者的LVMI、IVS、LVESV也随之恶化,LVEF亦随之降低。TNF-α、MMP-1的异常升高表达与是否发生AMI后心室重构具有明确相关性。MMP-1与是否发生心室重构的相关性较低,但其与LVESV具有中度相关性,分析其原因我们认为与以下几点有关:(1)患者在PCI术后均应用 CEI与β-肾上腺素受体阻滞剂治疗,其中β-肾上腺素受体阻滞剂可抑制MMPs的表达与活性;(2)患者均长期应用他汀类药物进行PCI后续维持治疗,而他汀类药物对MMPs活性具有明确抑制作用;(3)MMP-1、MMP-3、MMP-9、MMP-10等MMPs系列因子的启动存在有多态性,AMI患者因MMPs基因的多态性而使其转录水平出现个体性差异;最后,AMI后心室重构为慢性进行性病变,本次研究时间点为AMI患者PCI治疗后的1个月,患者的梗死愈合程度、PCI的恢复情况与心室重构的发生程度均具有一定差异性使MMP-1的表达水平出现较大差异。为了明确血清TNF-α、MMP-1表达水平与AMI后心室重构的关系,我们对本组资料进行了进一步Logistic分析,结果表明TNF-α、MMP-1升高表达均为AMI后心室重构的独立危险因素。
综上所述,TNF-α和MMP-1与老年心肌梗死后心室重构的发生具有明确相关性,并与患者的心功能具有相关性;TNF-α和MMP-1的升高表达为老年心肌梗死后心室重构发生的独立危险因素。

