基于在体肠袢模型研究荭草活性成分在正常及心肌缺血模型大鼠的肠吸收特性
陆 苑,黎 娜,2,刘春花,潘 洁,李勇军,王永林,孙 佳
(贵州医科大学 1.贵州省药物制剂重点实验室/省部共建药用植物功效与利用国家重点实验室,2.药学院,3.民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004)
荭草,蓼科植物荭蓼(PolygonumorientaleL.)的干燥全草,具有清热解毒、祛风除湿、活血消肿的功效,常用于治疗风湿性关节炎、冠心病、疮肿等[1-3]。在贵州省分布广泛,民间常用于治疗气短、胸痛及胸闷等疾病。研究发现甾类皂苷类、黄酮类、木质素类等为荭草药材中的主要化学成分,且现代药理学研究表明荭草能增加心肌营养血流量及冠脉流量,从而改善急性心肌缺血缺氧的状态[3,4]。
基于荭草对心肌缺血具有较好的疗效,课题组在前期对荭草的药用部位、化学成分、提取工艺等进行了研究,并结合血清药理、血清谱效关系等明确了以异荭草、荭草素、牡荆素、槲皮苷、原儿茶酸等为代表的黄酮类成分及酚酸类成分为其主要活性成分[4-6]。且研究报导异荭草素及荭草素具有清除1,1-diphenyl-2-picrylhydrazyl(DPPH)自由基和抗炎的作用[7-8],槲皮苷通过阻断黄嘌呤氧化酶,螯合铁,具有直接清除羟基和超氧阴离子自由基,抑制脂质过氧化而产生抗氧化作用[9]。但是,目前关于荭草提取物活性成分在心肌缺血模型大鼠体内的吸收过程尚不清楚,因此,本实验拟通过建立大鼠在体肠袢吸收模型,从药物经肠道吸收入血的含量变化来研究荭草提取物(polygonumorientaleL.extracts,POE)中主要活性成分在正常及心肌缺血(myocardial ischemia,MI)模型大鼠体内的吸收特性及差异,从而为荭草的进一步研究提供参考依据。
1 材料
1.1 仪器UPLC-TQS(美国沃特世公司Acquity®三重四级杆串联质谱仪);BT100-2J恒流泵(河北保定兰格恒流泵有限公司);ZH-2涡旋混合器(天津药典标准仪器厂);MTN-2800D氮吹浓缩装置(天津奥特塞恩斯仪器有限公司);XYN-15LP氮吹仪氮气发生器(上海析友分析仪器有限公司);AE240十万分之一电子天平(梅特勒-托利多仪器上海有限公司);EL204万分之一电子天平(梅特勒-托利多仪器上海有限公司);DK-98-Ⅱ恒温水浴锅(天津泰斯特仪器有限公司);Allegra 64R低温高速离心机(美国Beckman Coulter公司)。
1.2 药物与试剂葛根素(上海源叶生物科技有限公司,批号S02M9B54875);山奈素-3-O-β-D-葡萄糖苷、槲皮苷、原儿茶酸、荭草素、异荭草素、牡荆素对照品(四川省维克奇生物科技有限公司,批号分别为wkq16022301、wkq16080402、wkq16012105、wkq16041301、wkq16080404、wkq16031003,纯度≥98%);盐酸异丙肾上腺素(阿拉丁化学试剂公司);肝素钠(北京索莱宝科技有限公司,批号:421F025);荭草(产自中国贵州);甲酸、乙腈、甲醇等试剂均为色谱纯。
1.3 实验动物及模型制备Sprague-Dawley(SD)大鼠,♂,体质量为(250±20)g,由长沙市天勤生物技术有限公司提供,为SPF级动物,合格证号:SCXK(湘)2014-0011。在室温(20~25) ℃,相对湿度(60±10)%的条件下饲养,自由进食、进水。本研究经贵州医科大学伦理委员会批准与同意(批准号1702077)。
取健康SD大鼠70只,实验前禁食12 h,自由饮水,随机分为正常组及MI模型组,每组35只。模型组大鼠按50 mg·kg-1的剂量皮下注射盐酸异丙肾上腺素(isoproterenol,ISO)生理盐水,每天注射一次,连续注射2 d,正常组大鼠注射等剂量的生理盐水。末次注射后24 h后即得到大鼠心肌缺血模型[10-11]。
2 方法
2.1 溶液的配制
2.1.1标准溶液及内标溶液的配制 精密称取葛根素对照品10.40 mg,置于10 mL量瓶中,加甲醇溶解后定容至刻度,摇匀,即得浓度为1.04 g·L-1的葛根素储备液。精密称取异荭草素、荭草素、牡荆素、槲皮苷对照品10.26、10.90、10.48、10.34 mg,分别置于10 mL量瓶中,加甲醇溶解后定容至刻度,摇匀,即得浓度分别为1.026、1.090、1.048、1.034 g·L-1的对照品储备液。分别精密吸取各对照品储备液适量,置于10 mL量瓶中。上述溶液均置于-20 ℃保存备用。
2.1.2Tyrode缓冲液的配制 称取NaCl 8.00 g、KCl 0.20 g、NaHCO31.00 g、NaH2PO40.05 g、MgCl20.10 g、CaCl20.20 g、葡萄糖 1.00 g,用少量蒸馏水溶解,其中CaCl2单独溶解后逐滴加入,最后加入葡萄糖溶解,溶解后用蒸馏水定容至1 L,即得Tyrode缓冲液。
2.1.3POE灌流液的配制 取荭草干燥药材10 kg,分别加10倍水煮3次,每次1 h,过滤,合并滤液,滤液浓缩至1 g生药/mL;搅拌下缓慢加入乙醇使溶液含醇量大65%,继续搅拌30 min,静置12 h,抽滤,滤液浓缩至1 g生药/mL;以1/2倍的水饱和正丁醇萃取4次,合并正丁醇相,减压回收正丁醇;正丁醇提取物加80%乙醇溶解后,上聚酰胺柱,用8倍体积的80%乙醇洗脱,收集流穿液和洗脱液,减压回收乙醇,残留物微波真空干燥,得POE,收膏率为5.02%[12]。称取荭草提取物适量,用Tyrode缓冲液超声溶解,过滤,得到终浓度分别为5.0、10.0、20.0 g·L-1的POE灌流液。
2.2 分组给药与样品采集取正常和心肌缺血模型大鼠(禁食12 h,可自由饮水),腹腔注射10%水合氯醛(0.04 mL·kg-1)麻醉,固定于37 ℃的恒温加热板上,经静脉插管手术插管,供实验过程中从颈静脉补充注射含肝素钠(10 g·L-1)的新鲜血液,使体内血液总量一致。腹部剃毛,沿腹中线,做正中切口,充分暴露手术视野分离出7~10 cm小肠,在实验肠段两端避开血管各切一小口,在小口处插入直径为0.3 cm的硅胶软管,并用线扎紧。连接恒流泵,使其与恒流泵形成一个回路,将37 ℃的生理盐水缓缓泵入肠管,洗去肠管内容物至净,然后排空肠道内的水分。钝性分离肠系膜静脉,结扎肠系膜静脉,插管用以收集给药段的肠系膜静脉的血液。将伤口用浸有生理盐水的脱脂棉覆盖保湿。取37 ℃荭草活性成分循环液50 mL于量筒中,以2.0 mL·min-1的流速与目标肠段内循环平衡10 min后,将恒流泵的流速调节为1.0 mL·min-1,并立刻收集给药段的肠系膜静脉的血液300 μL至含肝素钠的离心管中,同时缓慢从颈静脉补充新鲜血液300 μL。之后在不同时间点(10、30、60、90、120 min)按同样的方法来取样,恒流泵循环2 h后结束实验,处死大鼠。收集到的血液,6 000 r·min-1离心 6 min,取血浆冻存于-20 ℃冰箱,待测定[13-14]。
2.2.1不同浓度的荭草活性成分对吸收的影响 取正常和MI模型SD大鼠,按每组5只随机分组。选取大鼠十二指肠段(自幽门1.0 cm处开始往下 10 cm处),按“2.2”项下操作,制备大鼠在体肠袢模型,取用浓度为5.0、10.0、20.0 g·L-1的荭草活性成分溶液分别作为肠循环灌流液,按时间点经肠系膜静脉取血约300 μL置有肝素的塑料离心管中,6 000 r·min-1离心6 min,分离血浆于-20 ℃冰箱中保存待用。
2.2.2荭草活性成分在不同肠段的吸收特点 取正常和MI模型SD大鼠,按每组5只随机分组。选取大鼠各肠段:十二指肠段(自幽门1.0 cm处开始往下 10 cm处);空肠段(自幽门15 cm起往下 10 cm处);回肠段(离盲肠上行 20 cm处开始往下10 cm处);结肠段(从盲肠后端开始往下取 10 cm处),按“2.2”项下操作,制备大鼠在体肠袢模型,选择浓度为10.0 g·L-1的荭草活性成分溶液作为肠循环灌流液,按时间点经肠系膜静脉取血约300 μL置有肝素的塑料离心管中,6 000 r·min-1离心6 min,分离血浆于-20 ℃冰箱中保存待用。
2.3血浆处理方法 取大鼠血浆100 μL,置于1.5 mL塑料离心管中,加内标溶液13 μL(葛根素10 mg·L-1),涡混1 min,加入1%甲酸水100 μL,涡混1 min,加入甲醇400 μL,涡混1 min,超声10 min,4 ℃,13 000 r·min-1离心10 min,取上清液置离心管中,37 ℃下用N2吹干,残留物加150 μL甲醇水(50 ∶50,v/v)溶解,涡混3 min,超声10 min,4 ℃下13 000 r·min-1离心10 min,取上清液进样UPLC-TQS分析。
2.4 UPLC-MS/MS液质条件
2.4.1液相条件 超高效液相色谱-三重四级杆质谱联用仪(美国Waters公司);色谱柱Acquity UPLC BEH C18(2.1×50 mm,1.8 μm);柱温40 ℃;流动相A为0.1%甲酸乙腈;流动相B为0.1%甲酸水;流速0.3 mL·min-1;梯度洗脱程序:0.0~0.5 min,10% A;0.5~1.0 min,10%~19% A;1.0~3.0 min,19% A;3.0~3.1 min,19%~90% A;3.1~3.5 min,90% A;3.5~4.0 min,90%~10% A;进样量:1 μL
2.4.2质谱条件 电喷雾电离源(ESI);去溶剂气(氮气1 000 L·h-1);去溶剂气温度(550 ℃);扫描方式为多反应离子监测模式(MRM)。异荭草素等6种指标性成分及内标化合物的监测离子见Tab 1。
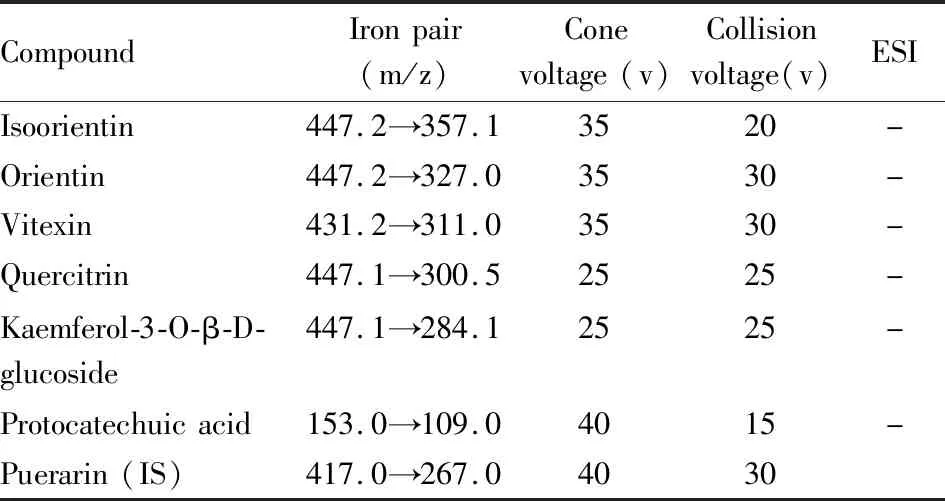
Tab 1 Mass spectrometry parameters of each compound

3 结果
3.1 不同浓度的POE中六个主要成分浓度对吸收的影响照“2.2.1”项下方法操作,分别制备正常及MI模型大鼠的十二指肠的在体循环肠灌流模型,分别以5.0、10.0、20.0的POE为循环灌流液,于循环稳定后不同时间点经肠系膜血管收集血液,分析计算各时间点的血药浓度,计算AUC,结果如Fig 1所示。结果显示,正常状态下,荭草素等6个成分在2 h内的时间曲线下面积随浓度的升高而升高,呈现浓度依赖性。在心肌缺血模型状态下,原儿茶酸、山柰素-3-O-β-D-葡萄糖苷和槲皮苷的AUC随浓度的升高而升高,均不存在高浓度饱和现象;而荭草素、异荭草素和牡荆素在中浓度(10.0 g·L-1)时的AUC最小,在高浓度(20.0 g·L-1)时最大。且在3个浓度下,模型组对异荭草素、荭草素及原儿茶酸的吸收均较正常组降低(P<0.05),在低浓度及高浓度时对牡荆素及槲皮苷的吸收较正常组降低(P<0.05),山奈素-3-O-β-D-葡萄糖苷的吸收则在高浓度时较正常组降低(P<0.05)。见Fig 1。
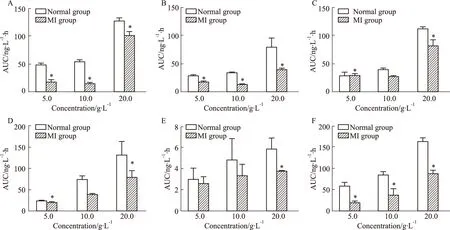
Fig 1 AUC of the isoorientin(A),orientin(B),vitexin(C),quercitrin(D),kaemferol-3-O-β-D-glucoside(E) and protocatechuic acid(F) of three concentrations POE in normal and MI model n=5)*P<0.05 vs normal group
3.2 POE中六个主要成分在不同肠段的吸收特性照“2.2.2”项下方法操作,分别制备正常及MI模型大鼠的十二指肠、空肠、回肠及结肠的在体循环肠灌流模型,以10.0 g·L-1的POE为循环灌流液,于循环稳定后不同时间点经肠系膜血管收集血液,分析计算各时间点的血药浓度,计算AUC,结果见Fig 2所示。结果显示,与正常组相比,POE中6个成分在MI模型大鼠各个肠段中的AUC值均较低,提示模型状态下,6个成分经4个肠段吸收入血的量较低。在正常状态下,6个活性成分在回肠和十二指肠中的AUC值较高,而模型状态下则为回肠和结肠的AUC值较高。比较同一肠段在正常及模型状态下对同一成分的吸收可以发现模型状态下对各成分的吸收均小于正常状态下的吸收。其中十二指肠及空肠对6个成分的吸收差异具有显著性(P<0.05);回肠对异荭草素、牡荆素、槲皮苷及山奈素-3-O-β-D-葡萄糖苷的吸收差异具有显著性(P<0.05);结肠对原儿茶酸及槲皮苷的吸收差异具有显著性(P<0.05)。见Fig 2。
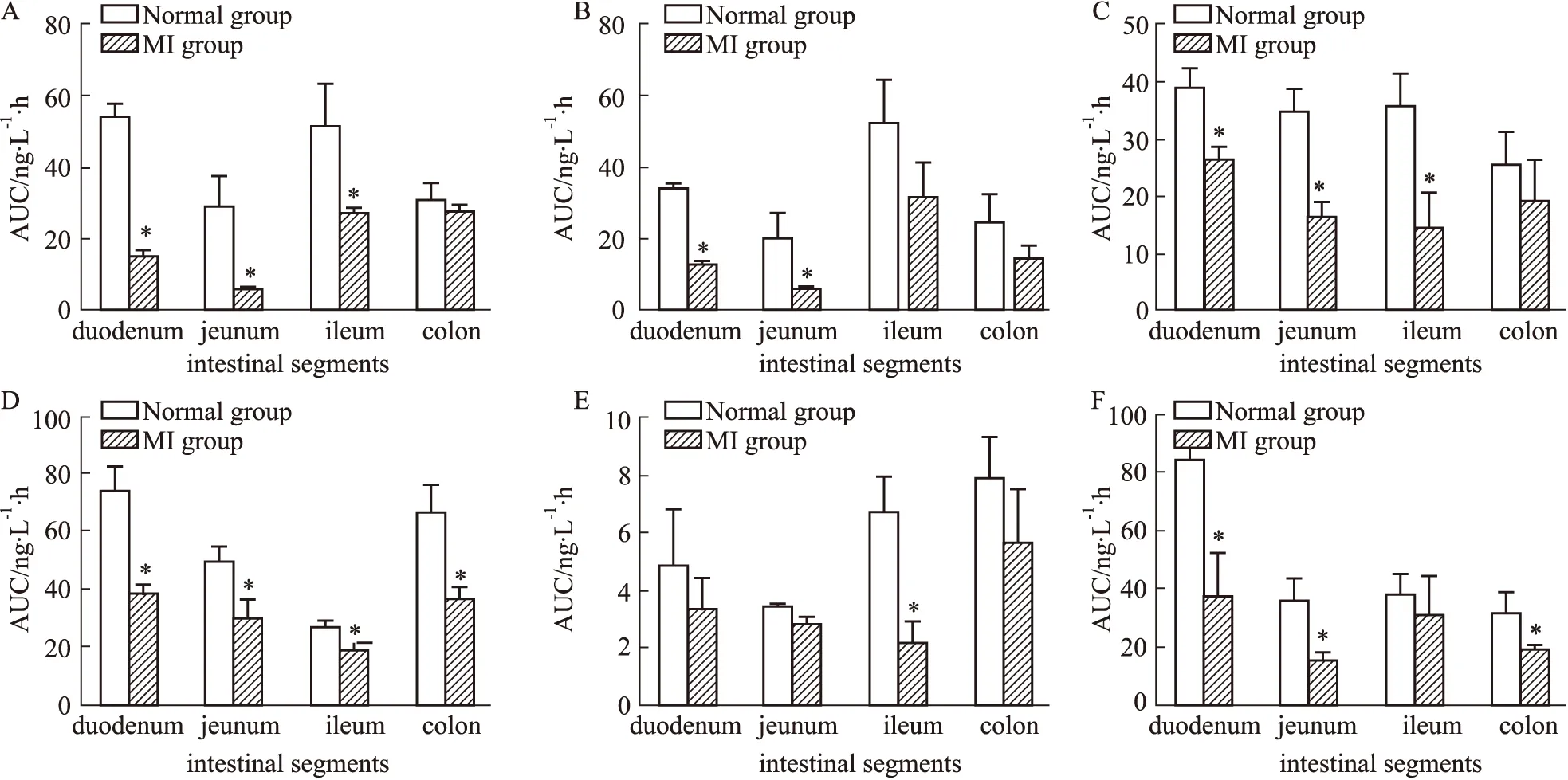
Fig 2 AUC of isoorientin(A),orientin(B),vitexin(C),quercitrin(D),kaemferol-3-O-β-D-glucoside(E) and protocatechuic acid(F) of POE in normal and MI model rats at various intestinal segments n=5)*P<0.05 vs normal group
4 讨论
本研究建立了一种简便、快速、灵敏的分析LC-MS/MS方法,适用于同时测定大鼠血浆样品中6种成分的含量。方法学考察结果显示6种成分及内标峰之间分离度良好,无内源性物质干扰测定;6个成分在分析浓度范围内均呈现较好的线性关系,且R2均大于0.999;日内及日间精密度的RSD值均小于10%,准确度范围为85.0%~105.3%;提取回收率范围为109.6%~85.8%,基质效应范围为107.6%~86.3%;血浆样品在进样器中放置6 h及经过3次循环冻融后的RSD值均小于10.3%。提示该方法线性较好,精密度高,回收率较高且稳定性好,符合生物样品的测定要求。
在体肠袢模型是在不影响血流供应和神经支配的前提下,通过肠段给药,并进行肠系膜静脉插管,定时收集血样,测定血中药物浓度的一种实验方法。由于在体法不切断血管及神经,可保持肠道神经完好及肠道中酶的活性,也保证了血液及淋巴液供应不变,使得生物活性有所提高,测得的吸收速率速率指标与在体法相近[13-14]。
POE中6个成分在正常及MI模型大鼠体内经肠袢模型吸收入血的量呈现出较大差异。通过分析6个成分经十二指肠、空肠、回肠及结肠吸收入血的AUC值,发现十二指肠及回肠为正常组的主要吸收肠段,而MI模型组大鼠中结肠对各成分的吸收增加,且回肠及结肠为主要吸收部位。研究显示,中药的药代动力学特征受机体状态的影响,当机体发生生理及病理变化时,相关药物转运蛋白、药物代谢酶及细胞通透性等发生变化[15-16],这可能是引起POE中六个成分在MI模型组的吸收部位后移的原因。其次,通过比较同一肠段在正常及MI模型状态下对同一成分的吸收,发现各成分在模型状态下的吸收均小于正常组。产生这一现象的原因可能与大剂量注射盐酸异丙肾上腺素诱导心肌产生不可逆的缺血性损伤有关。研究发现,药物的吸收受机体的血流速率、血液灌注量等因素影响。而盐酸异丙肾上腺素为β受体激动剂,使心脏兴奋性增加、心率加快及耗氧量增加,从而造成机体血流量降低、血液灌注减少及供氧下降[17]。
在本次研究中,在正常及MI模型状态下同一肠段对6个成分的吸收具有较大差异,在正常组中,6个成分在十二指肠的吸收均随着浓度的升高而增大,呈现浓度依赖性,提示荭草素等6个活性成分在正常大鼠体内的吸收机制可能是被动扩散。研究发现,黄酮类化合物的吸收非常复杂,其吸收程度不仅取决于分子的脂溶性或是否糖基化,还依赖于其和膜表面大量转运体以及酶的众多作用。黄酮类化合物中,少数糖苷类以原型的形式通过主动转运被小肠吸收,大多数通常水解为苷元,由于黄酮苷元具有较大的疏水性,可以通过被动扩散透过生物膜而被吸收[18]。而在模型状态下,六个成分在十二指肠的吸收较正常组复杂,提示模型6状态下,6个成分的吸收机制不是单纯的被动扩散,可能还存在其他的跨膜装运形式,其吸收机制还需进一步研究。