二氢杨梅素通过TFEB-自噬途径抑制地塞米松诱导的成骨细胞凋亡
周湘华,周寿红,赵其辉
(1.湖南环境生物职业技术学院药理教研室,湖南 衡阳 421001;2.广西脑与认知神经科学重点实验室,3.桂林医学院基础医学院生理学教研室,广西 桂林 541104)
关健词:二氢杨梅素;成骨细胞;地塞米松;凋亡;转录因子EB;自噬
骨质疏松症(osteoporosis,OP)是人体衰老的主要表现形式。OP的主要临床表现为骨骼的密度降低,骨质被破坏和容易引发骨折。继发性OP的常见原因之一是大量的糖皮质激素的使用,被称为糖皮质激素引起的骨质疏松症(glucocorticoid-induced osteoporosis,GIOP)[1]。自噬是通过溶酶体途径,降解和重新利用细胞中的大分子物质、衰老蛋白和受损的细胞器的一种生物过程。研究发现[2],OP的发生发展进程与异常的自噬关系密切。转录因子EB(transcriptionfactor EB,TFEB)是调节细胞自噬的重要途径[3]。二氢杨梅素(dihydromyricetin,DMY)是一种天然的二氢黄酮类物质,最初被发现存在于蛇葡萄类植物藤茶的茎叶中[4]。DMY药理学功效较为广泛,包括抗炎、抑制肿瘤、抗氧化、胃粘膜保护和神经保护作用等[5]。有研究发现[6],DMY参与了骨代谢的调控,DMY对骨代谢具有双层调控作用,既促进成骨也抑制破骨效应,DMY还可以减轻去卵巢引起的雌性大鼠的骨质丢失[7],但其机制还不清楚。研究发现[8],染料木黄酮等天然黄酮类物质可调节TFEB的活性,提示黄酮类化合物能调节细胞自噬。因此,本研究旨在观察DMY对地塞米松(dexamethasone,DEX)诱导的小鼠成骨细胞MC3T3-E1细胞凋亡的影响,并从TFEB-自噬途径的角度探讨DMY抑制OP的可能机制。
1 材料与方法
1.1 药品与试剂小鼠成骨细胞株MC3T3-E1细胞为美国模式培养物研究所的产品。DMY为中国大连美仑生物科技有限责任公司的产品(批号:935653-81-6),α-MEM培养基(α-minimum Eagle’s medium)为美国英杰生命(Invitrogen)技术有限公司的产品(批号:758267),胎牛血清为杭州四季青生物科技公司的产品(批号:195271),地塞米松(批号:MFCD00064136)、胰蛋白酶(批号:87254-019)、噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT](批号:BS1912)、二甲基亚砜(Dimethyl sulfoxide,DMSO)(批号:34869)、抗坏血酸(批号:A92902)、乙二胺四乙酸(Elhylene diamine tetraacetic acid,EDTA)(批号:200-449-4)为美国Sigma公司的产品。二喹啉甲酸法法蛋白定量测试盒(批号:77191)为美国皮尔斯(Pierce)公司的产品。兔抗鼠TFEB(批号:sc-58742-R)、Beclin 1(批号:sc-47821)和微管相关蛋白1 轻链3(microtubule-associated protein light chain-3,LC3) (批号:sc-47821)、p62/SQSTM1(批号:sc-47821)和β-actin(批号:sc-68972-R)一抗以及相应二抗(批号:sc-68972-R)为美国Santa Cruz公司的产品。
1.2 仪器TECNAI 20 U-TWIN型透射电镜(荷兰飞利浦电子光学公司);F.A.M.E.16/20型全自动酶标仪(瑞士哈美顿公司);UV-3600型紫外分光光度计(日本岛津);SZ51/SZ61型光学显微镜(日本奥林巴斯);CO2细胞培养箱(日本岛津)。
1.3 细胞培养与实验分组用α-MEM培养基培养MC3T3-E1细胞,培养液含有50 mg·L-1抗坏血酸和0.1胎牛血清,细胞培养在37 ℃和5%的CO2的培养箱中。每2 d更换一次细胞培养液,细胞传代时,先用胰蛋白酶适度消化,制备成细胞悬液,再进行传代。处于对数生长期的MC3T3-E1细胞被用于后续的研究。细胞随机地分为以下各组:对照组:用α-MEM培养液培养细胞12 h;DEX组:用含10 μmol·L-1DEX的培养液培养细胞12 h;DMY组:用含10、20和40 μmol·L-1DMY的培养液培养细胞12 h;DEX+DMY组:先用10、20和40 μmol·L-1DMY处理细胞0.5 h,再加入10 μmol·L-1的DEX继续共同处理12 h。雷帕霉素组:用含雷帕霉素(5 μmol·L-1)的α-MEM培养基培养MC3T3-E1细胞12 h。DEX+DMY+ 雷帕霉素组:先用5 μmol·L-1雷帕霉素处理细胞0.5 h,用20 μmol·L-1DMY处理细胞0.5 h,然后再加入10 μmol·L-1的DEX共同继续培养12 h。
1.4 MTT分析各处理因素结束后,将MTT工作液20 μL加入到每个细胞培养孔中,继续进行培养4 h。再将DMSO溶液150 mL加入到每个细胞培养孔中,培养板置于摇床上,摇晃振动10 min。用酶标仪测量各细胞培养孔的吸光度,检测波长预先设为570 nm。
1.5 流式细胞仪检测处理结束后,用磷酸盐缓冲液洗MC3T3-E1细胞3次,通过离心收集MC3T3-E1细胞。加入500 μL的Binding buffer重悬细胞,再加入5 μL磷脂结合蛋白V(Annexin V)工作液,混匀,再加入5 μL碘化丙啶(Propidium iodide,PI)工作液,混匀;避光室温下孵育15 min,上机检测。计数MC3T3-E1细胞被Annexin V-PI双染呈现阳性的细胞数,然后算出细胞的凋亡百分率。每组设3个复孔。
1.6 Western blot检测提取各组细胞的总蛋白,通过试剂盒提取核蛋白。采用二喹啉甲酸法测定样本的蛋白浓度。将总蛋白样品添加到加样缓冲液中,用电炉烧开煮沸,以使蛋白质完全充分变性。通过聚丙烯酰胺凝胶电泳的方法将已经完全变性的蛋白质分离,再通过电转移的方法将蛋白质转移至聚偏氟乙烯(polyvinyl fluoride,PVDF)膜上。为了阻断非特异性抗原,将PVDF膜与脱脂牛奶(0.05)在室温下进行孵育2 h。加入兔抗小鼠TFEB(1 ∶500)、Beclin-1(1 ∶400)、LC-3(1 ∶300)、p62(1 ∶400)和β-actin(1 ∶400)的一抗,4 ℃过夜。采用Tris-Tween缓冲盐溶液(Tris Tween buffer salt solution,TBST)液清洗PVDF膜3次,然后加入二抗,继续在4 ℃条件下孵育4 h,再通过TBST液清洗PVDF膜3次。经曝光、显影、定影后,通过图像分析软件对胶片进行扫描,核蛋白的检测以组蛋白为内参照,其他以β-actin作为内参照,对目的蛋白的表达水平进行半定量分析。
1.7 透射电镜观察MC3T3-E1细胞以每孔1×106个细胞的数量接种在6孔细胞培养板中。当细胞生长融合度达到0.85时加入各处理因素,在处理结束后,用胰酶对细胞进行消化,通过离心收集细胞于离心管。将细胞块状颗粒放到戊二醛溶液(0.02)中进行固定,在4 ℃下固定时间为2 h。细胞团块经常规的包埋、切片、重金属染色后,通过透射电镜观察细胞的超微结构,然后拍照记录结果。用图像分析软件测量细胞中单个自噬体的面积,计算自噬体的总面积,然后计算自噬体总面积占细胞质面积的百分率。

2 结果
2.1 DMY对DEX诱发的MC3T3-E1细胞凋亡的影响结果如Tab 1所示:MC3T3-E1细胞的凋亡率DEX组与对照组比较明显增加(P<0.05),而DMY组(10、20和40 μmol·L-1)与对照组相比较MC3T3-E1细胞凋亡率的差异没有统计学意义。与DEX组比较,DEX+DMY(20、40 μmol·L-1)组细胞凋亡率明显降低,差异有统计学意义(均P<0.05)。与对照组比较,不同浓度DMY和DEX对MC3T3-E1细胞的细胞活力的差异没有统计学意义(Tab 2)。由于DEX+DMY(40 μmol·L-1)组与DEX+DMY(20 μmol·L-1)组相比较其细胞的凋亡率虽然有降低趋势,但是其差异没有统计学意义,而40 μmol·L-1DMY有导致细胞活力降低的趋势(Tab 2)。因此选择DMY(20 μmol·L-1)用于后续实验。
Tab 1 Effects of DMY on apoptosis induced by dexamethasone in MC3T3-E1 cells n=5)
Tab 2 Effects of DEX and DMY on viability of MC3T3-E1 cells n=3)
2.2 DEX和DMY对MC3T3-E1细胞超微结构的影响结果如Fig 1所示,对照组MC3T3-E1细胞的细胞核染色质分布较均匀,胞质中可见少量的自噬体,细胞的形状多数呈现为椭圆形。DEX组MC3T3-E1细胞的胞质内可见具有双层膜结构的自噬体(箭头所示),细胞核大多呈现不规则形。DEX组细胞中自噬体的数量明显高于对照组,差异有统计学意义(P<0.05),自噬体在细胞质中所占比例明显高于对照组(0.018±0.002和0.165±0.009),差异有统计学意义(P<0.05)。DEX+DMY(20 μmol·L-1)组的自噬体数量明显低于DEX组,且自噬体在细胞质中所占比例明显降低(0.165±0.009,0.049±0.005),差异有统计学意义(P<0.05)。
2.3 DEX和DMY对MC3T3-E1细胞中自噬相关蛋白表达的影响结果如Fig 2所示,与对照组比较,DEX组细胞中Beclin-1和LC3-Ⅱ的蛋白表达及LC3-Ⅱ/LC3-Ⅰ的比值均明显增加,p62的蛋白表达明显降低(均P<0.05)。与DEX组比较,DEX+DMY(20 μmol·L-1)组Beclin-1、LC3-Ⅱ的表达和LC3-Ⅱ/LC3-Ⅰ的比值均明显降低,而p62的表达明显增加,差异均有统计学意义(均P<0.05)。
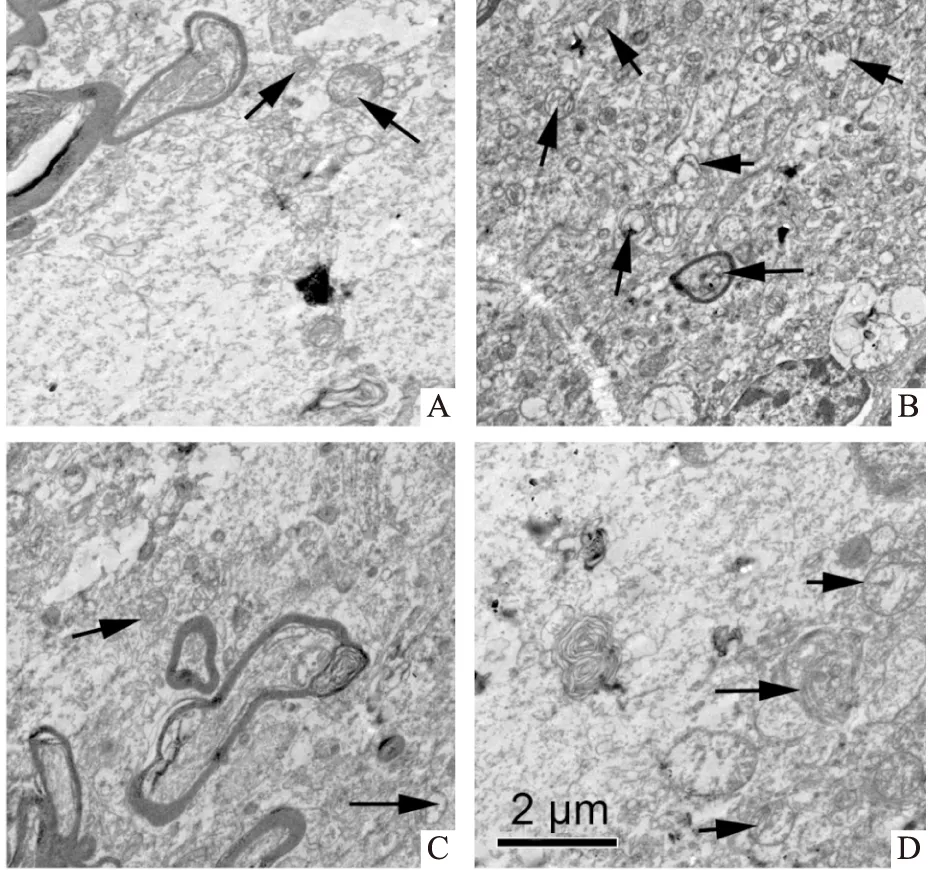
Fig 1 Effect of DEX and DMY on ultrastructure of MC3T3-E1 cellsA:Cell control;B:DEX (1 μmol·L-1);C:DMY(20 μmol·L-1);D:DEX+DMY.Arrows show autophagic vacuole.
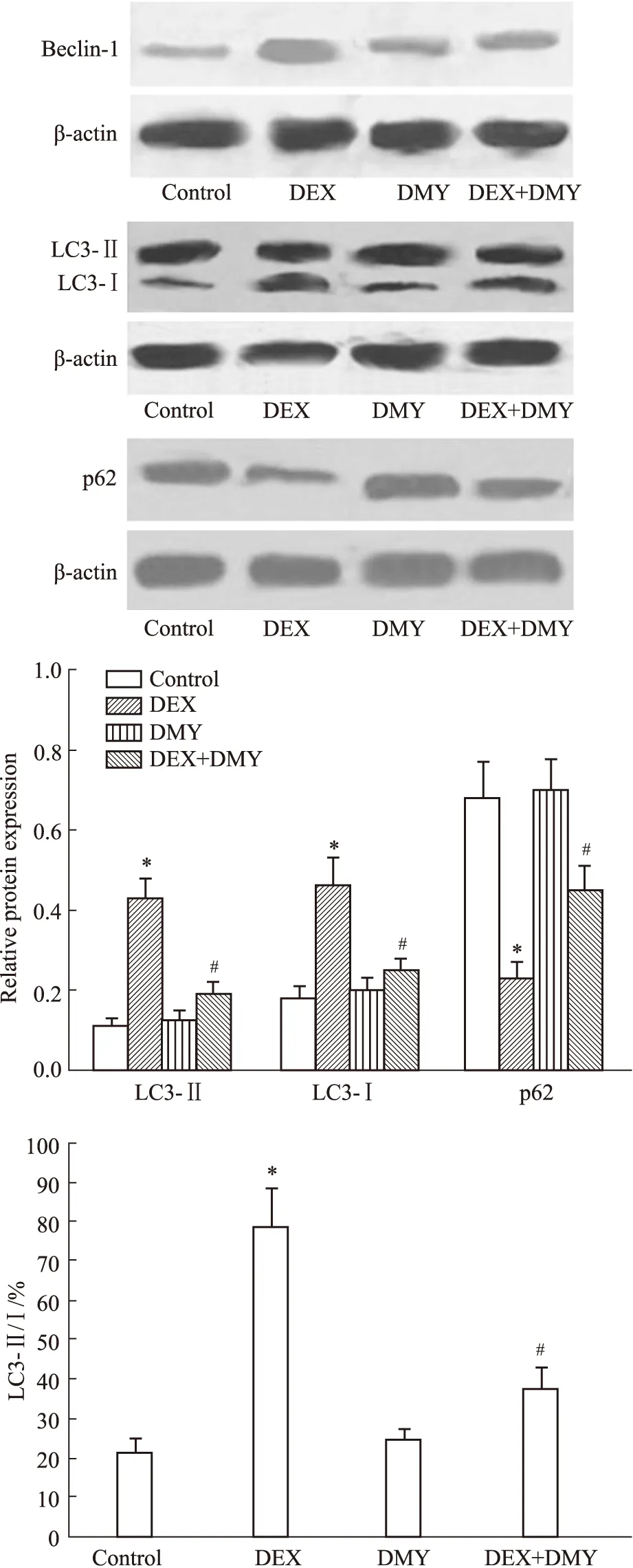
Fig 2 Effect of DEX and DMY on expressions of autophagy related proteins in MC3T3-E1 n=5)*P<0.05 vs control group;#P<0.05 vs DEX group.
2.4 雷帕霉素对DMY抑制DEX诱导的MC3T3-E1细胞凋亡的影响结果如Tab 3所示,DEX+DMY(20 μmol·L-1)+ 雷帕霉素组MC3T3-E1细胞凋亡率与DEX+DMY(20 μmol·L-1)组相比较明显增加,差异有统计学意义(P<0.05)。这提示细胞自噬诱导剂雷帕霉素部分逆转了DMY抑制DEX诱导的MC3T3-E1细胞凋亡的作用。
Tab 3 Effect of rapamycin on DMY inhibiting apoptosis in MC3T3-E1 cells n=5)
2.5 DMY对MC3T3-E1细胞中TFEB蛋白表达和核转位的影响结果如Fig 3所示,与对照组比较,DEX组细胞中TFEB总蛋白和TFEB在细胞核中的表达及TFEB在核中表达与TFEB总蛋白的比值均明显增加,差异均有统计学意义(均P<0.05)。与DEX组比较,DEX+DMY(20 μmol·L-1)组细胞中TFEB总蛋白和TFEB在细胞核中的表达及TFEB在核中表达与TFEB总蛋白的比值均明显降低,差异均有统计学意义(均P<0.05)。
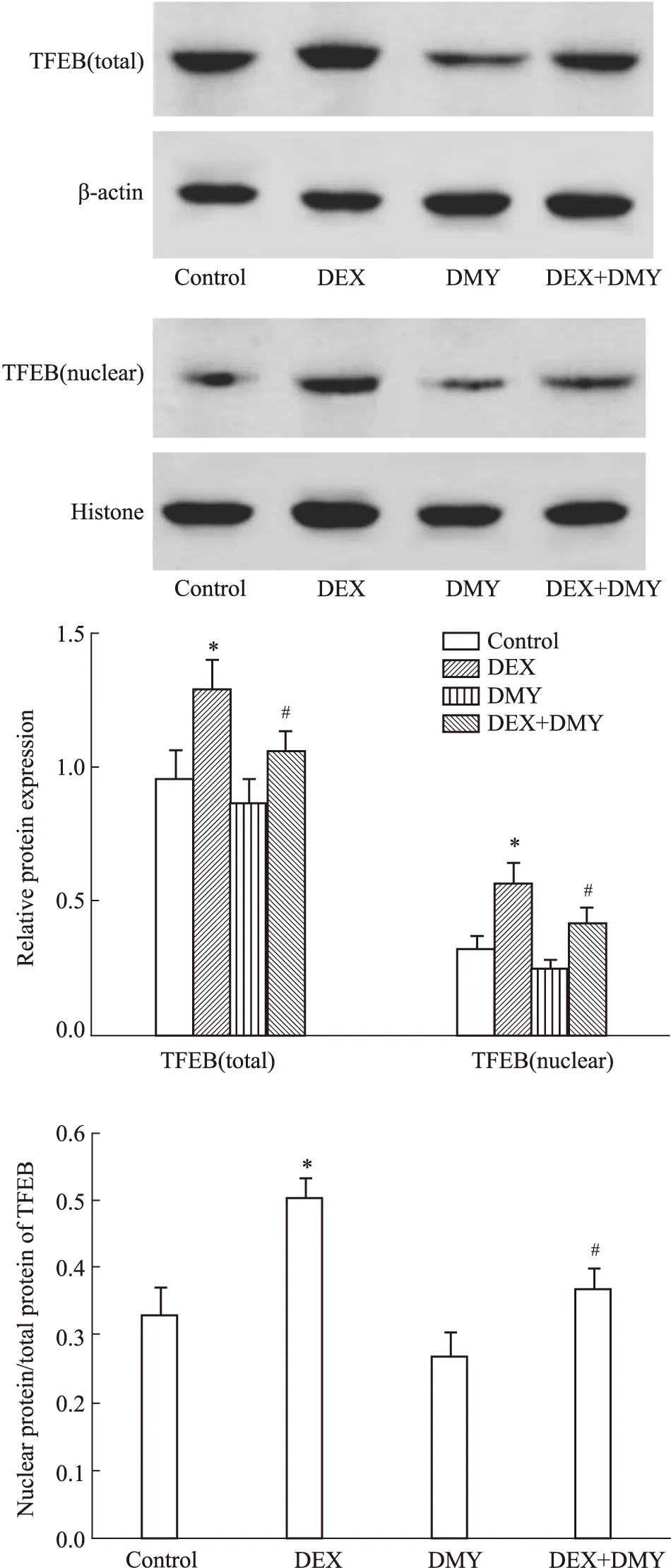
Fig 3 Effect of DMY on TFEB protein expression and nuclear translocation in MC3T3-E1 n=5)*P<0.05 vs control group;#P<0.05 vs DEX group.
3 讨论
本研究的结果显示,10 μmol·L-1的DEX处理MC3T3-E1细胞12 h后,细胞凋亡率明显升高,而DMY+ DEX组与DEX组比较,细胞凋亡率明显降低。DEX处理MC3T3-E1细胞后,成骨细胞的自噬活性明显增加,而DMY可抑制DEX诱导的成骨细胞的自噬活性增加,进一步的结果显示,细胞自噬诱导剂雷帕霉素部分取消了DMY抑制DEX诱导的MC3T3-E1细胞凋亡的效应。DMY明显降低了DEX诱导的TFEB总蛋白和TFEB在细胞核中表达及TFEB在核中表达与TFEB总蛋白的比值增加。
糖皮质激素的药理作用广泛,如:抑制免疫反应、抗毒、抗休克和消炎等。研究发现,糖皮质激素参与了骨代谢的调控过程,生理浓度的糖皮质激素既可促进成骨细胞的成骨效应,也可增强破骨细胞的溶骨效应,维持骨的生成与破坏之间的平衡,维持正常的骨代谢。然而,过量的糖皮质激素会破坏成骨与骨溶解间的平衡,最终引发GIOP。研究发现,高浓度的DEX能导致成骨细胞的凋亡[9]。本研究采用10 μmol/L的DEX处理成骨细胞系MC3T3-E1细胞,结果显示,DEX明显提高了MC3T3-E1细胞的凋亡率,这与以往的研究结果是一致的。因此抑制成骨细胞凋亡可能是防止GIOP的重要策略和途径。
藤茶是一种常用于感冒发热和咽喉肿痛等疾病的中药,DMY是藤茶的主要活性成分,是一种天然的双氢黄酮类化合物。DMY的药理学功效较广,如:抑制氧化应激、抑制炎症反应、抑制肿瘤细胞的生长、抗动脉粥样硬化和神经保护作用等,因此DMY具有较好的临床应用前景[10]。研究表明[11],DMY具有抑制OP的功效,DMY能抑制由磨损颗粒诱导的小鼠颅骨组织的骨溶解,抑制破骨细胞的破骨作用,提高骨骼的密度,但是其具体的机制尚不完全清楚。本研究的结果表明,DMY抑制了DEX诱导的成骨细胞凋亡,因而抑制成骨细胞凋亡可能是DMY发挥抗OP功效的机制之一。
DEX导致成骨细胞凋亡的机制十分复杂,研究表明自噬参与了DEX引发的成骨细胞凋亡的过程[12]。自噬是一种通过溶酶体的作用来降解细胞内的错误折叠的蛋白、长寿蛋白质、损伤的细胞器和病原微生物的生物过程,是维持细胞内稳态的重要代谢途径[13]。研究发现,DEX处理可增加大鼠成骨细胞自噬水平,抑制成骨作用,诱导GIOP,而通过自噬抑制剂抑制成骨细胞的自噬可抑制GIOP[14]。有研究发现,DMY对细胞的自噬活性具有调控作用,从而调控细胞的自噬性死亡[15]。本实验的结果发现,DEX明显提高了MC3T3-E1细胞的凋亡率,也明显增加了MC3T3-E1细胞中自噬体的数量,明显上调了Beclin-1和LC3-Ⅱ自噬标志性蛋白的蛋白表达水平以及LC3-Ⅱ/LC3-Ⅰ的比值,而明显下调自噬底物p62的蛋白表达。这些结果提示DEX提高了MC3T3-E1细胞的自噬水平,这与以前的研究结果是一致的[16]。本实验结果进一步显示,DMY处理明显减少MC3T3-E1细胞中自噬体的数量,明显下调了Beclin-1和LC3-Ⅱ的蛋白表达以及LC3-Ⅱ/LC3-Ⅰ的比值,明显上调p62的蛋白表达。这些结果提示DMY可抑制DEX诱导的MC3T3-E1细胞凋亡,也可降低MC3T3-E1细胞的自噬水平。为了明确MC3T3-E1细胞的自噬水平的改变是否参与了DMY抑制DEX诱导的MC3T3-E1细胞凋亡的过程,我们进一步观察了自噬诱导剂雷帕霉素对DMY作用的影响,结果表明,雷帕霉素逆转了DMY抑制DEX诱发的MC3T3-E1细胞凋亡的作用。这些结果提示DMY抑制DEX诱发的MC3T3-E1细胞凋亡的作用机制可能与DMY抑制细胞自噬活性有关。但是DMY对细胞自噬的影响还存在矛盾的地方,我们以往的研究显示,DMY可上调细胞自噬活性,而抑制MPP+诱导的PC12细胞损伤[17],这些矛盾产生的原因可能与细胞种类不同以及不同病理生理过程中自噬的作用不一样有关。
细胞自噬的调控过程十分复杂,涉及到PI3KⅠ/mTOR、PI3KⅢ和AMPK/Sirt1等信号通路[18],而这些均是在蛋白翻译后的水平对自噬进行调控。近年来的研究发现,在转录水平的调节也是细胞自噬调控的重要方式。mTOR的活性被抑制后可激活TFEB,而TFEB通过核转位后可调节自噬相关基因和溶酶体生成与成熟相关的多个关键基因的转录,进而增强细胞的自噬水平。本实验的结果显示,DMY明显降低了DEX诱导的TFEB总蛋白和TFEB在细胞核中的表达上调,也明显抑制了DEX诱导的核转位。这些结果提示DMY抑制DEX诱导的MC3T3-E1细胞自噬水平增加可能涉及到TFEB信号。引发TFEB核转位的原因有很多,包括TFEB的脱磷酸化和内质网应激等。那么DMY是如何导致TFEB发现核转位,进而调控细胞自噬,抑制DEX诱发的成骨细胞凋亡,这些问题均有待进一步的研究。
总之,本研究结果提示DMY抑制DEX诱发的成骨细胞凋亡,其作用机制可能与DMY下调TFEB表达,抑制其核转位,进而抑制细胞自噬有关。本研究为二氢杨梅素用于GIOP的防治提供了新的线索和实验依据。
(致谢:本课题在南华大学神经科学研究所实验室完成,特别感谢实验室的指导老师及各位参与者!)
——雷帕霉素