基于代谢组学的对乙酰氨基酚诱导大鼠急性肝损伤机制研究
李修龙,胡 诚,李云鹤,杨 蓉,陈 龙,贾益群
(上海中医药大学科技实验中心分析测试室,上海 201203)
肝脏是机体重要的新陈代谢和解毒器官,容易被一些化学物质如酒精、四氯化碳和对乙酰氨基酚(acetaminophen,APAP)损伤[1]。APAP是一种广泛使用的解热镇痛药;但是,已有大量的报道过量摄入是急性肝功能衰竭的主要原因,甚至可能导致死亡[2-3]。人们普遍认为,对乙酰氨基酚可被肝细胞色素酶P450(cytochrome P450,CYP450)代谢为N-乙酰基-对苯醌亚胺(N-Acetyl-P-Benzoquinon Imine,NAPQI),后者可以与谷胱甘肽(glutathione,GSH)结合,形成 APAP-谷胱甘肽、APAP-半胱氨酸和 APAP-N-乙酰半胱氨酸来解毒。但是,过量的NAQPI会使细胞内GSH耗竭,剩余的NAPQI可以共价结合细胞生物大分子形成NAQPI蛋白质加物,扰乱细胞内氧化还原平衡,从而导致氧化应激反应,线粒体功能障碍和细胞核 DNA 断裂,最终导致肝细胞坏死和肝损伤[4-5]。目前,临床对药物性肝损伤(drug-induced liver injury,DILI)的诊断仍有很多不足,传统检测指标如谷氨酸转氨酶(glutamate aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)等存在敏感性低、特异性差的特点,尚未找到理想的DILI生物标志物。最新版《药物性肝损伤诊治指南》(2015年版)指出,新生物标志物在DILI诊断中的贡献还有待进一步研究[6]。
代谢组学由Nicholson等[7]于1999年首次提出。它是运用高通量仪器,对机体内分子质量小于1 000的代谢物质进行定性定量分析,旨在寻找与生理病理存在规律的特异性分子标志物,适用于研究代谢性疾病的发病机制及治疗药物的作用机制[8]。根据研究发现[9],APAP肝毒性剂量(2.5 g·kg-1)给大鼠口服后48 h,从大鼠肝肾组织的病理切片观察,产生了明显的肝损伤;肝肾组织的活性氧(reactive oxygen species)、一氧化氮(nitric oxide)和丙二醛(malondiadehyde)含量增加和GSH含量以及血清的多项生化指标与空白组相比也产生了显著的差异,说明肝损伤后大鼠机体代谢系统发生了紊乱。因此,本实验在该文献的基础上首次采用液相色谱-高分辨质谱技术(UPLC-Q-Orbitrap-MS)结合多变量数据统计分析方法,探讨大鼠口服对APAP后不同时间段血清中内源性代谢物的变化及可能的通路分析,为临床诊断和用药安全提供依据。
1 材料
1.1 药品与试剂对乙酰氨基酚(Sigma-Aldrich中国,批号099K0127);2-氯苯丙氨酸(上海阿拉丁生化科技股份有限公司,批号D1404053),乙腈为色谱纯(美国Honeywell公司,批号K3021728);甲醇(批号20181113)、甲酸(批号3208K240)(均为色谱纯,德国CNW公司)。
1.2 仪器FA2004N 型电子天平(上海精密科学仪器有限公司),Thermo 液相色谱-质谱仪(UPLC-Q-Orbitrap-MS);TARGINTMVX-Ⅱ多管涡旋振荡器(北京踏锦科技有限公司);1730R离心机(基因有限公司);SK8200LHC 超声波清洗器(上海科导超声仪器有限公司);TBA-40FR生化分析仪(日本东芝公司)。
1.3 实验动物SPF级Wistar大鼠,♂,24 只,体质量(180±20)g,由上海中医药大学实验动物中心提供,置于动物饲养笼中,保持室内温度(18~22) ℃,室内昼夜自然明暗交替照明,饲养标准大鼠饲料。动物许可证号:SCXK(沪)2017-0005,伦理审查编号:PZSHUTCM190315013。
2 方法
2.1 大鼠分组及给药健康雄性Wistar大鼠24只,适应性饲养1周后,随机分为4组,即正常对照组和APAP低(1 g·kg-1)、中(2 g·kg-1)、高(3 g·kg-1)剂量组,每组6只。正常对照组口服0.5% CMC-Na溶液,APAP组口服相应剂量0.5% CMC-Na溶液配制的200 g·L-1APAP溶液。给药前一晚大鼠禁食不禁水;饲养过程中保持温度、光照、湿度等环境条件均衡,自由进食饮水。灌胃后分别于6、24、48 h颈静脉取血;全血于5 000 r·min-1、4 ℃离心10 min,取血清置于4 ℃冰箱备用。在48 h取完血后,取大鼠肝脏,分出肝大叶,立即用福尔马林固定。
2.2 生化指标的测定取50 μL血清,于全自动生化分析仪上测定AST和ALT值。
2.3 肝组织病理学检测取用福尔马林固定的肝大叶,HE 染色,光镜下观察肝细胞形态。
2.4 代谢组学
2.4.1血清样品制备 取解冻后血清样品50 μL,加入200 μL 甲醇和5 μL 2-氯苯丙氨酸(5 g·L-1),振摇 1 min,于4 ℃离心机中以12 000 r·min-1离心10 min,吸取100 μL上清,转入进样小瓶中待检测。同时,各组取等量样品混合,制备质控样品。
2.4.2LC-MS分析条件 ① 色谱条件 色谱柱:[Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm];流速0.3 mL·min-1;柱温为40 ℃;流动相组成为 A:纯水+0.1%甲酸,B:乙腈+0.1%甲酸;梯度洗脱程序见Tab 1;体积流量0.3 mL·min-1;进样量4 μL。② 质谱条件:静电场轨道离子阱,ESI 离子源,正离子模式为加热器温度300 ℃;鞘气体积流量45 arb;辅助气体积流量15 arb;尾气体积流量1 arb;电喷雾电压3.0 kV;毛细管加热温度350 ℃;负离子模式为加热器温度300 ℃;鞘气体积流量45 arb;辅助气体积流量15 arb;尾气体积流量1 arb;电喷雾电压3.2 kV;毛细管加热温度350 ℃。鞘气和辅助气均为氮气,扫描范围m/z:50~1 000。
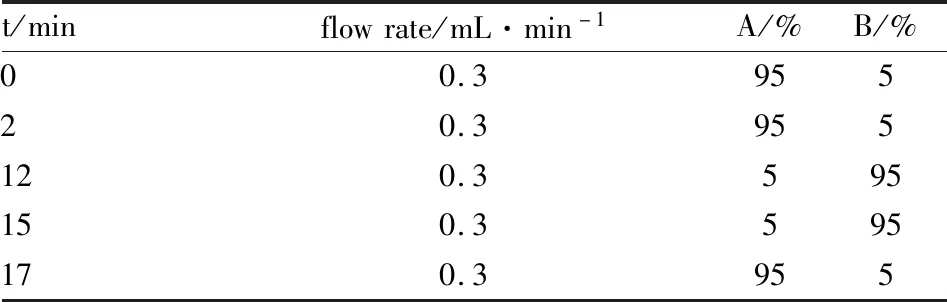
Tab 1 Mobile phase elution procedure

3 结果
3.1 APAP对ALT、AST水平的影响ALT和AST水平反映了大鼠肝细胞的损伤程度;与正常对照组相比,在6 h,给药组大鼠血清ALT、AST无显著变化;在24 h,中、高剂量组大鼠血清ALT和AST水平明显升高(P<0.01);在48 h,低、中、高剂量组大鼠血清ALT和AST水平均明显升高(P<0.05,P<0.01),见Fig 1。
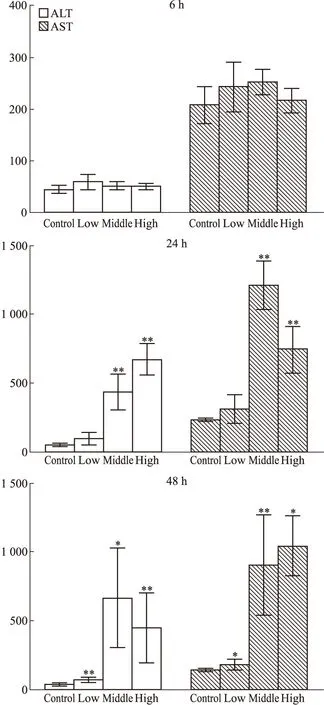
Fig 1 Rat serum ALT,AST detection*P<0.05,**P<0.01 vs control
3.2 大鼠肝组织病理变化如Fig 2所示,正常对照组大鼠肝细胞正常,低剂量组大鼠肝组织出现少许空泡状肝细胞,细胞间隙扩大;中、高剂量组大鼠肝细胞严重坏死,有大量炎细胞浸润;损伤程度均较低剂量组的严重,且高剂量组的大鼠肝组织损伤程度比中剂量组更严重。
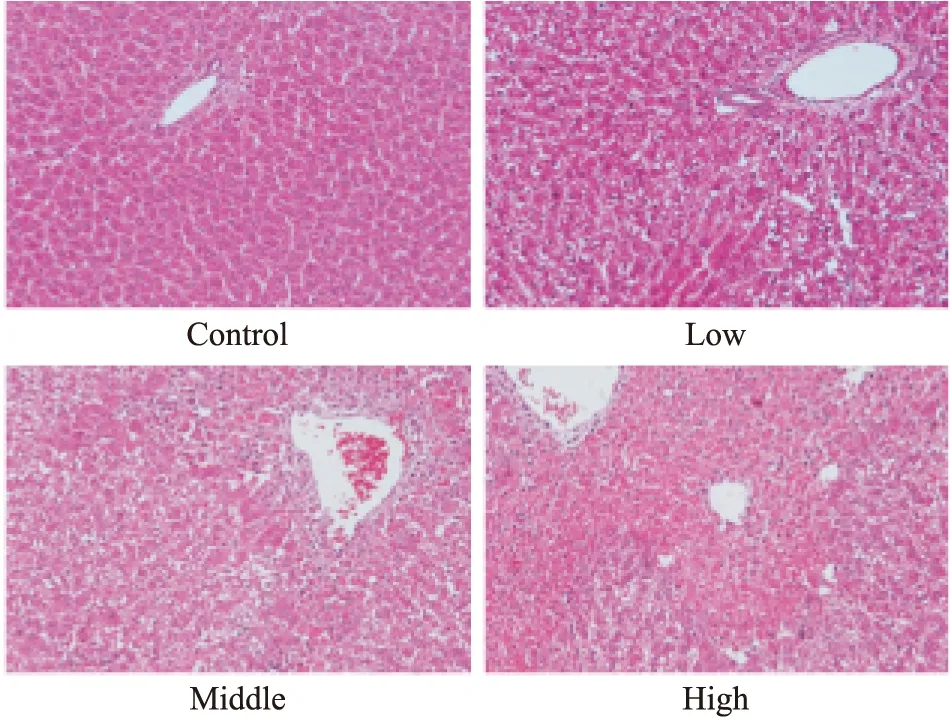
Fig 2 HE staining results of rat liver tissues(HE×200)
3.3 大鼠血清代谢物PCA分析在正模式(ESI+)及负模式(ESI-)下对大鼠血清样本进行 PCA 分析,从Fig 3可以看出,正常对照组、给药组和质控的血清样品能明显分开。可知给药组大鼠与正常大鼠之间的差异可以通过代谢谱有效地辨别。
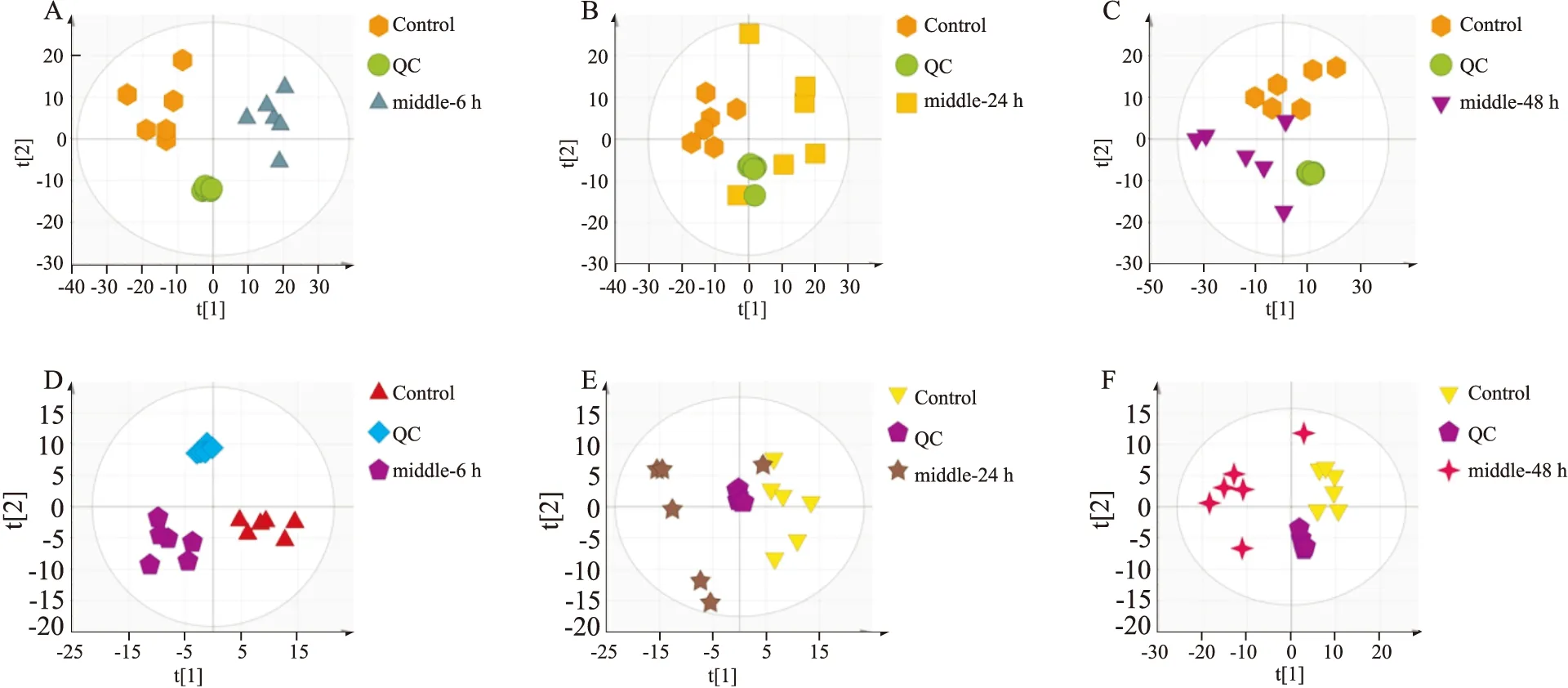
Fig 3 PCA results of APAP(2 g·kg-1)serum metabolomicsPositive:A:6 h,B:24 h,C:48 h;negative:D:6 h,E;24 h,F:48 h
3.4 大鼠血清代谢物 OPLS-DA 分析在正模式(ESI+)及负模式(ESI-)下对大鼠血清样本进行 OPLS-DA 分析,正常对照组、给药组的血清样品分离,在正离子模式下,6 h的R2X、R2Y、Q2分别为0.619、0.995、0.876,24 h的分别为0.633、0.998、0.657,48 h的分别为0.728、0.999、0.901;在负离子模式下,6 h的R2X、R2Y、Q2分别为0.655、0.998、0.714,24 h的分别为0.644、0.997、0.781,48 h的分别为0.765、0.999、0.902,见Fig 4。结果显示,所建立的模型有效,模式质量良好,可用于后续的组间差异成分的寻找与分析。
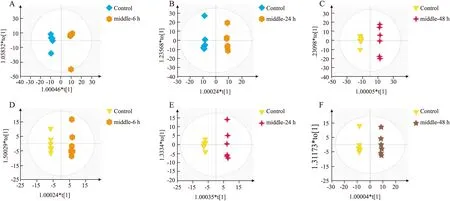
Fig 4 OPLS results of APAP(2 g·kg-1)serum metabolomicsPositive:A:6 h,B:24 h,C:48 h;negative:D:6 h,E:24 h,F:48 h
3.5 代谢物的鉴定及通路分析通过 OPLS-DA 分析,可以找到变量权重(VIP)>1 以及P<0.05的差异性代谢物,经 HMDB、KEGG 等谱库检索筛选,本实验共找出了45个差异性代谢物,正模式下鉴定出 33个,负模式下共鉴定出12个(与正模式下鉴定出的相同物质删去不表),结果见Tab 2、Tab 3。将主要产物大致归类为:磷脂类(LysoPC(22:4(7Z,10Z,13Z,16Z))、LysoPC(14:0)、LysoPE(0:0/16:0)等),鞘脂代谢产物(鞘氨醇:sphinganine),胆酸(牛磺胆酸:taurocholic acid;3a,7a-二羟基胆酸:3a,7a-dihydroxycholanoic acid)、嘧啶类(尿嘧啶:uracil)、不饱和脂肪酸类(二十碳五烯酸:eicosapentanoic acid)、花生四烯酸产物(N-花生四烯酸甘氨酸:N-arachidonoyl glycine)、糖代谢产物(对乙酰氨基酚葡萄糖醛酸:acetaminophen glucuronide),等。
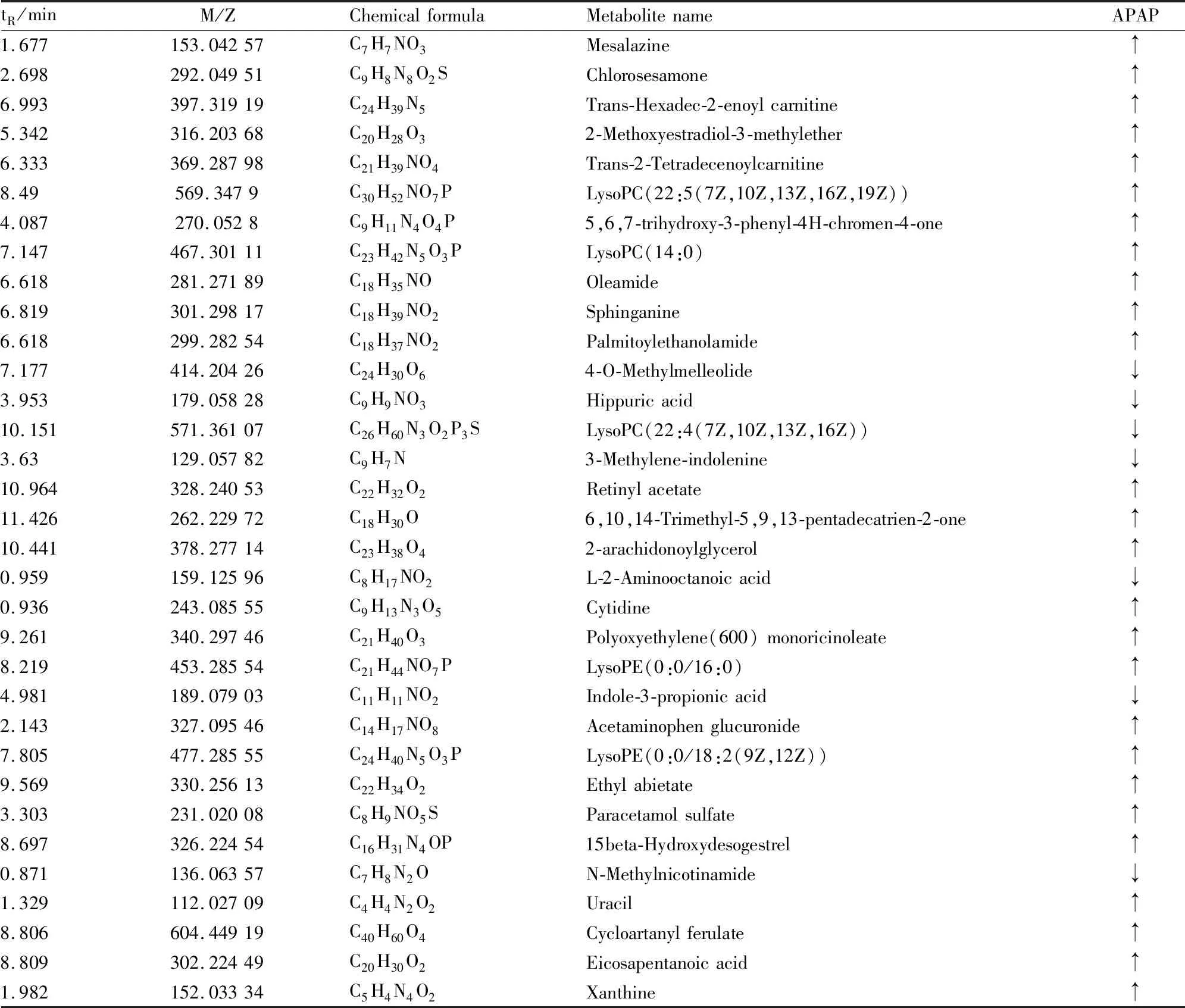
Tab 2 Differential metabolites in serum samples of positive ion mode

Tab 3 Differential metabolites in serum samples of negative ion mode
热图是数据的一种二维呈现,可以更加清晰地表示代谢物的组间差异,因此将上述化合物构建热图,见Fig 5。其中发现,服用APAP后上调的差异物有Sph、TCA、LysoPC(14:0)、LysoPE(0:0/18:2(9Z,12Z))等;下调的差异物有LysoPC(22:4(7Z,10Z,13Z,16Z))、3a,7a-二羟基胆酸、硫酸吲哚酚(Indoxyl sulfate)等。
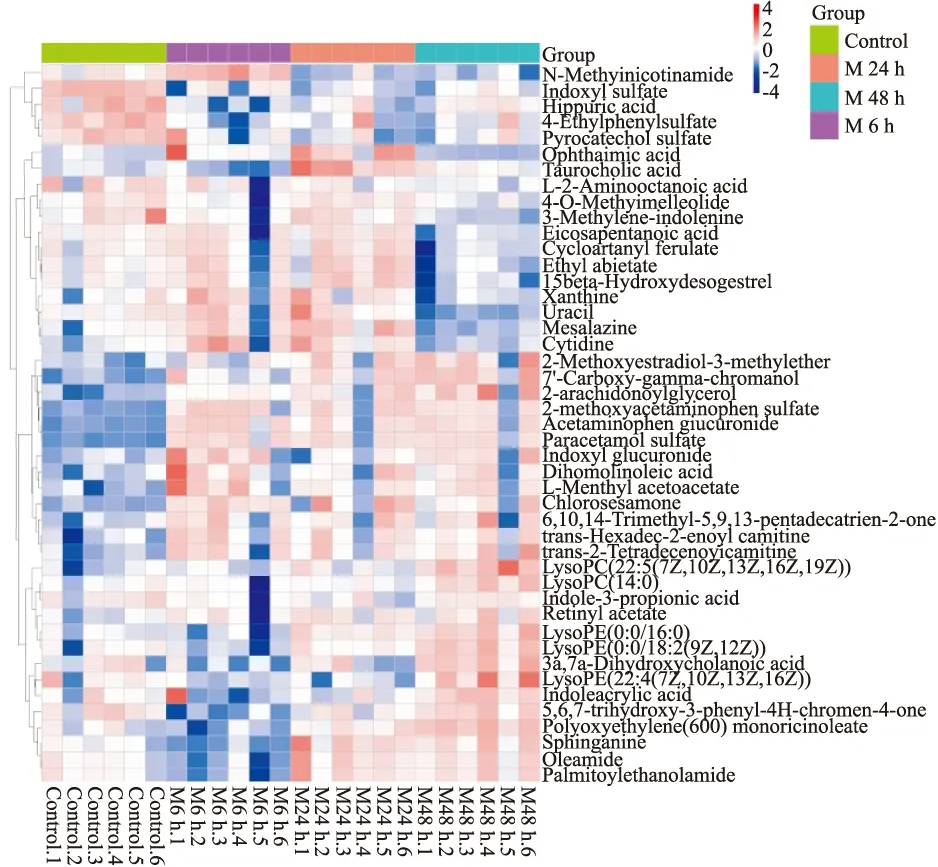
Fig 5 Thermographic analysis of potential biomarkersNormal group(Control 1~Control 6),middle group 6 h(M 6h.1~M 6h.6),middle group 24h(M 24h.1~M 24h.6),middle group 48 h(M 48h.1~M 48h.6)
将Tab 2、Tab 3中的差异代谢物通过 Metabo Analyst进行通路分析得知,对乙酰氨基酚致肝损伤的作用机制可能与嘧啶代谢、甘油磷脂代谢、鞘脂代谢、嘌呤代谢、泛酸和CoA生物合成及初级胆汁酸的生物合成等11条代谢通路有关,见Tab 4、Fig 6。结合 KEGG 通路分析发现,甘油磷脂代谢、鞘脂代谢,以及初级胆汁酸的生物合成可能是其主要相关代谢通路。
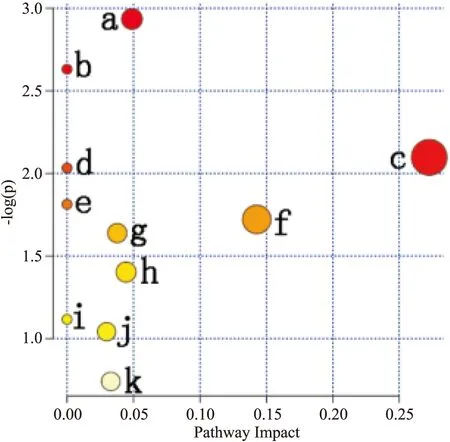
Fig 6 Metabolic pathway of serum samples
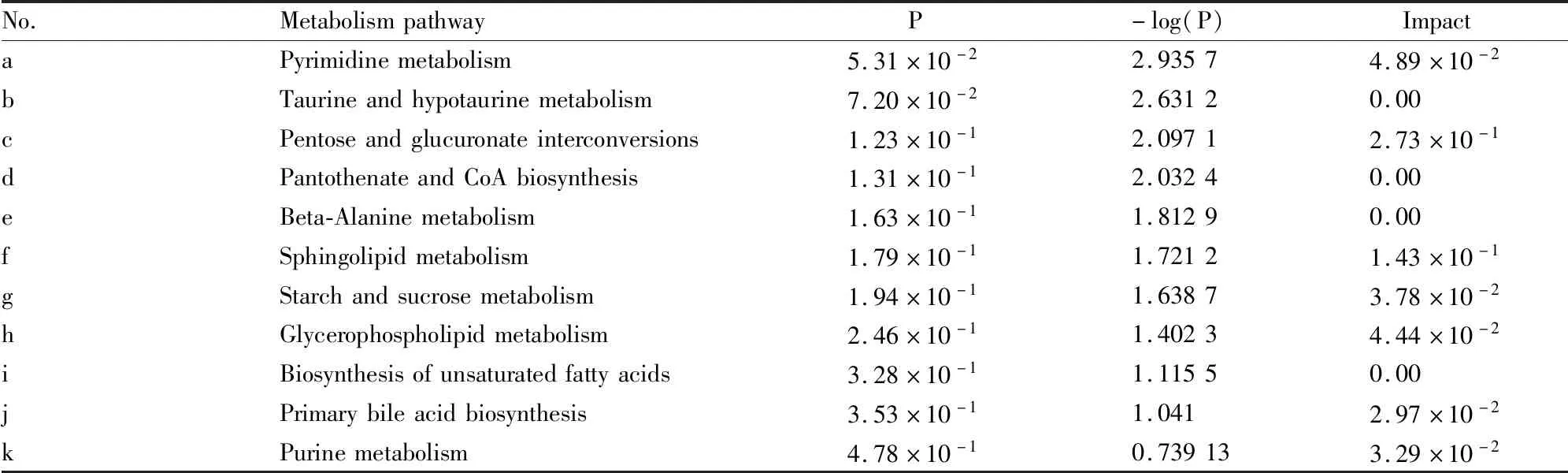
Tab 4 Metabolic pathway
4 讨论
APAP是临床上广为使用的解热镇痛药,但是过量服用会超过机体代谢和排毒的能力,经肝脏代谢后生成的毒性中间产物NAPQI不能及时被谷胱甘肽结合而清除排出体内,从而导致中间产物与肝组织内的蛋白质结合,引起肝细胞坏死,出现血清ALT 与 AST 的急剧升高。血清中 ALT 和 AST 含量的升高是肝损伤的特异性标志,可反映细胞损伤和坏死程度[10]。本实验结果表明,3个剂量组大鼠最终血清的ALT与AST水平均明显高于正常对照组,且中、高剂量组于24 h差异就产生显著性;病理组织学显示,随着APAP剂量的递增,炎性细胞浸润增多,结构损伤加重。说明服用过量的APAP可能于24 h开始产生肝毒性,剂量越大肝损伤的程度越严重。
本实验首次采用UPLC-Q-Orbitrap-MS结合多变量数据统计分析方法,探讨大鼠口服APAP后不同时间段血清中内源性代谢物的变化及可能的通路分析;结果表明其可能主要与甘油磷脂代谢、鞘脂代谢,以及初级胆汁酸的生物合成等代谢通路有关。
甘油磷脂代谢:从Tab 2可知,甘油磷脂是肝损伤大鼠血清中主要的生物标记物,包括LPCs、LPEs等;亦是生物体内含有量最丰富、种类最复杂的磷脂之一,是肝细胞以及线粒体膜的重要组成部分[11]。甘油磷脂在磷脂酶的作用下催化降解生成LPC,甘油磷脂还可以通过影响体内药物代谢的酶,如药物II相代谢酶尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase)、药物Ⅰ相代谢酶CYP450等,从而影响药物的代谢及加重代谢紊乱,并且会导致肝脏疾病;LPC可促进炎症反应,并且与许多疾病的发生有关;LPC亦具有细胞毒性,使细胞结构和功能异常[12]。本实验发现,大鼠口服APAP后体内LysoPC(14:0)、LysoPE(0:0/16:0)、LysoPE(0:0/18:2(9Z,12Z))、LysoPC(22:5(7Z,10Z,13Z,16Z,19Z))、LysoPC(22:4(7Z,10Z,13Z,16Z))含量升高;且PE 可与 PC 相互转化,PE 与细胞生长、增殖和分化密切相关,是细胞凋亡的诱因[13],由此可知,可能是APAP导致了甘油磷脂代谢紊乱,产生了有毒的代谢产物,导致肝细胞结构破坏和细胞凋亡,引起了肝损伤。
鞘脂代谢:鞘脂(sphingolipids,SPL)的代谢较为复杂,其中神经酰胺(ceramide,Cer)处于鞘脂代谢网络中的核心位置;SPL是一类以鞘氨醇(sphingsine,Sph)为骨架的较复杂的化合物,Sph在体内生成的唯一途径是神经酰胺在神经酰胺酶(ceramidase)的作用下去乙酰化而产生的[14]。有文献报道,神经酰胺可以引起细胞内GSH的耗竭及线粒体去极化,从而诱导肝细胞氧化应激损伤[15]。本实验研究结果显示,大鼠口服APAP后Sph的含量升高,而Sph只能通过Cer转化产生,由此可推测,APAP可能引起鞘脂代谢紊乱,从而导致肝损伤。且有文献报道[16],在多种肝脏疾病如酒精性肝病、肝脏缺血/再灌注损伤、脂肪性肝病等中,其体内的Cer和Sph含量均有明显的变化。尽管有些神经酰胺和鞘氨醇的作用机制还有待研究,但在一定程度上可作为肝损伤的生物标记物。
初级胆汁酸的生物合成:肝脏在胆汁酸代谢中占重要地位,与胆汁酸的合成、分泌、转化等具有密切关系,胆汁酸的变化亦被认为是肝损伤的代谢组学标志物[17]。初级胆汁酸是肝细胞以胆固醇为原料直接合成的,其从肝内被分泌出来后进入肠腔,在一些酶和细菌的代谢下成为次级胆汁酸[18]。本次研究结果所得,大鼠口服APAP后牛磺胆酸(Taurocholic acid,TCA)的含量升高,3a,7a-Dihydroxycholanoic acid(亦称鹅去氧胆酸)的含量下降;据文献报道[13],TCA为疏水性胆汁酸,可通过与体内甘氨酸及牛磺酸结合产生,其含量升高可引起肝内胆汁淤积,导致肝内胆汁酸代谢紊乱,进而产生肝毒性。
综上所述,本实验在前期研究基础上探讨了低、中、高3个剂量的APAP分别在6、24、48 h对大鼠肝脏造成的影响;首次采用液相色谱-高分辨质谱技术(UPLC-Q-Orbitrap-MS)结合多变量数据统计分析方法进行代谢差异物及通路分析,结果显示,APAP致肝毒性代谢通路可能与甘油磷脂代谢、鞘脂代谢,以及初级胆汁酸的生物合成等代谢通路紊乱有关,为后期深入研究APAP致肝毒性的作用机制及治疗药物的开发提供一定的依据。